2020.10.19
- プレスリリース
- 研究
中枢神経原発悪性リンパ腫PCNSLの 原因と進行のメカニズムおよび治療標的分子の解明
横浜市立大学学術院医学群 脳神経外科学 立石健祐助教、三宅勇平助教、山本哲哉教授、国立がん研究センター 細胞情報学分野 河津正人ユニット長、間野博行分野長、脳腫瘍連携研究分野 市村幸一分野長らの研究グループは、独自に樹立したヒト由来脳腫瘍マウスモデル(PDXモデル)を通じて、中枢神経原発悪性リンパ腫(PCNSL)の腫瘍形成・進展機序の解明とともに、標的となる分子機構を明らかにしました。今回樹立したPCNSLのPDXモデルは生体における治療反応性を高いレベルで再現できることから、同モデルを用いることで今後の新規治療法開発の進展が期待されます。
本研究は、『米国癌学会誌 Cancer Research』に掲載されました。(米国時間10月16日10時付:日本時間10月16日23時付オンライン)
本研究は、『米国癌学会誌 Cancer Research』に掲載されました。(米国時間10月16日10時付:日本時間10月16日23時付オンライン)
研究成果のポイント
|
研究の背景
中枢神経原発悪性リンパ腫(primary central nervous system lymphoma; PCNSL)は中枢神経(脳・脊髄)及び眼内に限局した悪性リンパ腫を指します。
PCNSLは全脳腫瘍のうち、1993年に1.9 %、2009年に3.1 %、2017年に4.9%と増加傾向にあります(脳腫瘍全国集計調査報告第14版 2017)。全身性悪性リンパ腫と比較して一般的に予後不良であるとともに、標準的治療であるメソトレキセート(MTX)と全脳への放射線照射併用による治療は、再発率が高いだけでなく、遅発性に白質脳症を誘発することで中枢神経機能を悪化させるリスクが知られています。このため生命予後と機能予後を改善させる治療法の開発が望まれています。
PCNSLに高頻度に存在するMYD88/CD79B変異などの分子異常はがん増殖の主要なシグナルであるNF-kB経路を活性化させるため、これらの遺伝子異常はPCNSLの発生・進行に重要であると考えられていました。しかしながらこれらの仮説の検証に必要な細胞・動物モデルは、PCNSL自体の希少性や技術的に樹立困難とされており、研究発展の妨げとなっていました。そこで、研究者らのグループは、免疫不全マウス脳内にPCNSL細胞を移植することでPCNSLのヒト由来脳腫瘍モデル (patient-derived xenograft; PDX)を樹立し、このモデルを通じて病態の解明と治療標的分子の同定を行うことを考えました。
PCNSLは全脳腫瘍のうち、1993年に1.9 %、2009年に3.1 %、2017年に4.9%と増加傾向にあります(脳腫瘍全国集計調査報告第14版 2017)。全身性悪性リンパ腫と比較して一般的に予後不良であるとともに、標準的治療であるメソトレキセート(MTX)と全脳への放射線照射併用による治療は、再発率が高いだけでなく、遅発性に白質脳症を誘発することで中枢神経機能を悪化させるリスクが知られています。このため生命予後と機能予後を改善させる治療法の開発が望まれています。
PCNSLに高頻度に存在するMYD88/CD79B変異などの分子異常はがん増殖の主要なシグナルであるNF-kB経路を活性化させるため、これらの遺伝子異常はPCNSLの発生・進行に重要であると考えられていました。しかしながらこれらの仮説の検証に必要な細胞・動物モデルは、PCNSL自体の希少性や技術的に樹立困難とされており、研究発展の妨げとなっていました。そこで、研究者らのグループは、免疫不全マウス脳内にPCNSL細胞を移植することでPCNSLのヒト由来脳腫瘍モデル (patient-derived xenograft; PDX)を樹立し、このモデルを通じて病態の解明と治療標的分子の同定を行うことを考えました。
研究の内容
ヒト由来PCNSL細胞株(PDX)モデルの樹立
研究者らのグループは、手術にて得られた検体の細胞化処理を行い免疫不全マウス(SCID Beige)マウス脳内に移植することで、これまでに12種類のヒト由来PCNSL細胞株(PDX)モデルの樹立をしました。病理学的検討、分子遺伝学的解析を通じてPDXモデルは患者腫瘍の遺伝型、表現型を忠実に再現するモデルであることを確認しました(図1)。これらのPDXモデルを使用し、以下の検討を行いました。
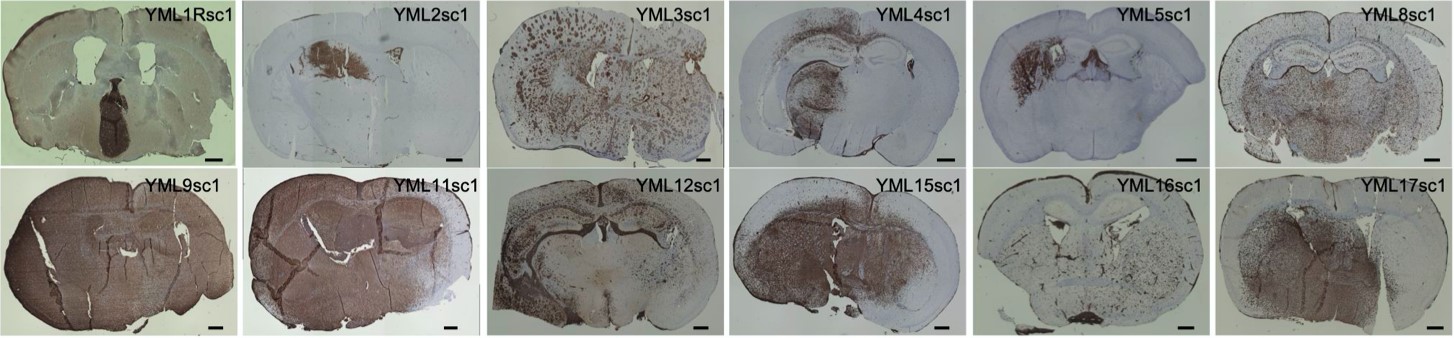
図1:樹立したPCNSL PDXモデル(CD20免疫染色)
網羅的遺伝子解析により判明したドライバー遺伝子異常
PCNSLでは通常再発時には腫瘍生検を行わないことから、腫瘍内における遺伝子異常に関する動的な変化を評価することは困難でした。そこで患者検体-PDX間、更には異なる継代数のPDX-PDX間における遺伝子異常の変化を解析するため、Epstein-Barrウイルス(EBV)陰性PCNSL例に対し全エキソン解析を行いました。その結果、患者検体-PDX間において90%以上の遺伝子異常が保持されていました。また腫瘍のドライバー遺伝子候補を探求したところ、MYD88、CD79B、HIST1H1Eの3つの遺伝子変異が検出されました。中でもMYD88 L265P変異は全体の80%、CD79B変異は全体の60%に認められ、CD79B変異を有する腫瘍にはいずれもMYD88変異が検出されました。これらの遺伝子変異は常にPDX内に保持されていました。次にサブクローンの多様性について評価を行いました。上述のMYD88やCD79B変異は早期ゲノムイベントであることが判明した一方、サブクローンはPDXの継代を通じて動的変化を示すことが明らかになりました(図2)。重要な点として本解析を通じてMYD88やCD79B変異はPCNSL治療における有力な標的遺伝子異常であると考えられました。
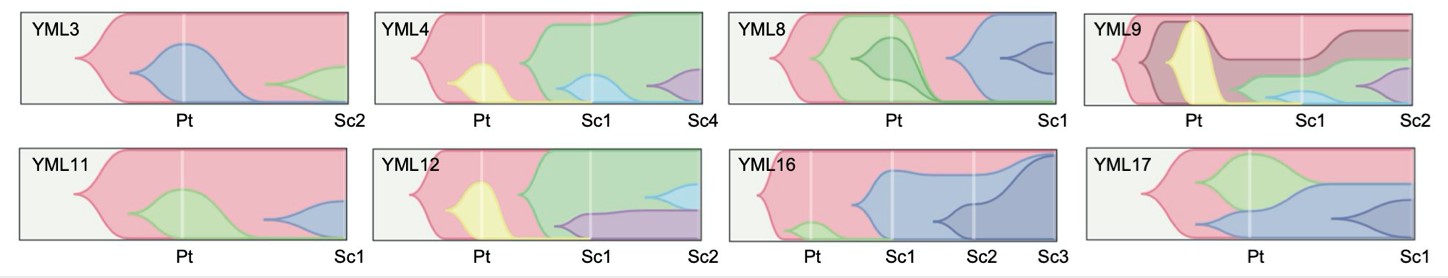
図2 PCNSLモデルを通じたクローン多様性の解明
PCNSLは解糖系への強い依存性を示す
当施設症例のFDG-PET結果を後方視的に検討したところ、正常脳白質と比較して腫瘍部では約4倍超のFDG集積が認められました。解糖系蛋白発現を比較すると、腫瘍部では解糖系関連蛋白であるglucose transporter 1(Glut-1)やhexokinase 2(HK-2)が正常脳と比較して高発現していました。同様にPDXモデルにおいてもFDG高集積、Glut-1, HK-2高発現を確認しました。そこで解糖系を阻害することによる抗腫瘍効果を検討するため、解糖系を標的とした阻害剤さらにはshRNAを用いてGLUT1, HK2遺伝子を抑制したところ、細胞、動物モデルで強い抗腫瘍効果が認められました。このことから強い糖代謝はPCNSLの生存に重要な役割を果たしていることが判明しました。
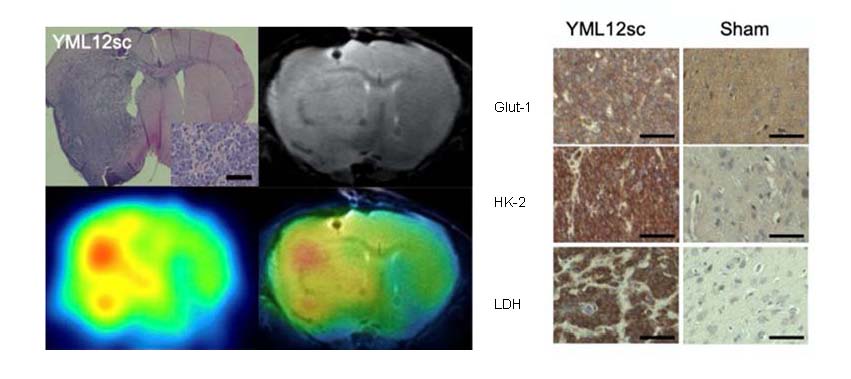
図3:PCNSLの強い解糖系依存機序をPDXモデルで再現
PCNSLではNF-kB活性化が解糖系を亢進させることで腫瘍進展が生じる
我々は、PCNSLで重要と考えられているMYD88/CD79B遺伝子変異に起因するNF-kB経路の活性化が上述の解糖系依存を誘導していると仮説を立てました。そこでMYD88/CD79B遺伝子をshRNAにより抑制したところNF-kB経路関連蛋白であるRelA/p65の発現抑制とともにHK-2の発現低下が認められ、更には細胞活性の減弱を認めました。また動物モデルでもPDX形成抑制が認められました。またNF−kB阻害剤 (IKK阻害剤)、shRNAでのNF-kB RELA遺伝子抑制にて、HK-2発現抑制、細胞活性の減弱が生じました。このことからRelA/p65-HK-2経路がPCNSLの進展に重要な役割を果たすことが示されました。
Pin1活性によるRelA/p65安定化がPCNSL進展を促進させる
今回の検討では2症例からはPDXが形成されませんでした。PDXが樹立されない機序解明の中で、これらの細胞の蛋白発現を検討したところ、リン酸化RelA/p65の発現低下とともにRelA/p65の安定化に関与するPin1の発現が低下していました。そのためPin1発現がRelA/p65の安定をもたらしPCNSL腫瘍形成に関与すると仮説を立てました。興味深いことにPIN1遺伝子を抑制することでリン酸化RelA/p65とともにHK-2発現の低下が認められました。このことからMYD88やCD79B変異などによるNF-kB経路に関連する遺伝子異常とPin1は相補的にRelA/p65発現を誘導することでPCNSL進展を促進させることが判明しました。
EBV陽性PCNSLではLMP1とPin1によるRelA/p65恒常的発現がPCNSL進展を促進させる
免疫不全状態ではEBV陽性PCNSLが誘発されることが知られています。3症例のEBV陽性PCNSLでは、いずれの例でもEBV関連蛋白であるLMP1の強い発現が認められました。LMP1をshRNAを用いて抑制したところRelA/p65発現低下が観察されました。このことからもEBVが腫瘍形成に大きな役割を果たすことが裏付けられました。一方、1例ではPDXが樹立されなかったため、それぞれの検体のRelA/p65発現を検討したところ、PDXを樹立した検体でより高いRelA/p65発現が認められ、PDX樹立例ではPin1の強い発現が認められました。更にLMP1, PIN1遺伝子を抑制した細胞をマウス脳に移植すると著明に腫瘍形成遅延をきたしました。またRELA遺伝子を抑制したところEBV陽性PCNSLでもEBV陰性PCNSL同様にHK-2発現の低下を認めました。このことからLMP1とPin1によるRelA/p65恒常的発現が解糖系を亢進させることで腫瘍形成を引き起こすことが判明しました。
メソトレキセート大量化学療法の感受性はNF-kB経路の活性抑制により規定される
臨床におけるメソトレキセート(MTX)の感受性がPCNSL細胞株にて再現されるか検証したところ、強い関連性が存在することが判明しました。そこでMTX投与後の蛋白発現を解析したところ、MTXに対する感受性が高い細胞ではリン酸化RelA/p65とともにHK-2発現の低下が認められました。一方MTX抵抗細胞ではこれらの変化は観察されませんでした。これらの所見は動物モデルでも再現されました。このことからMTX大量化学療法による細胞毒性効果はNF-kB経路の活性抑制により誘導されることが明らかになりました。
研究者らのグループは、手術にて得られた検体の細胞化処理を行い免疫不全マウス(SCID Beige)マウス脳内に移植することで、これまでに12種類のヒト由来PCNSL細胞株(PDX)モデルの樹立をしました。病理学的検討、分子遺伝学的解析を通じてPDXモデルは患者腫瘍の遺伝型、表現型を忠実に再現するモデルであることを確認しました(図1)。これらのPDXモデルを使用し、以下の検討を行いました。

図1:樹立したPCNSL PDXモデル(CD20免疫染色)
網羅的遺伝子解析により判明したドライバー遺伝子異常
PCNSLでは通常再発時には腫瘍生検を行わないことから、腫瘍内における遺伝子異常に関する動的な変化を評価することは困難でした。そこで患者検体-PDX間、更には異なる継代数のPDX-PDX間における遺伝子異常の変化を解析するため、Epstein-Barrウイルス(EBV)陰性PCNSL例に対し全エキソン解析を行いました。その結果、患者検体-PDX間において90%以上の遺伝子異常が保持されていました。また腫瘍のドライバー遺伝子候補を探求したところ、MYD88、CD79B、HIST1H1Eの3つの遺伝子変異が検出されました。中でもMYD88 L265P変異は全体の80%、CD79B変異は全体の60%に認められ、CD79B変異を有する腫瘍にはいずれもMYD88変異が検出されました。これらの遺伝子変異は常にPDX内に保持されていました。次にサブクローンの多様性について評価を行いました。上述のMYD88やCD79B変異は早期ゲノムイベントであることが判明した一方、サブクローンはPDXの継代を通じて動的変化を示すことが明らかになりました(図2)。重要な点として本解析を通じてMYD88やCD79B変異はPCNSL治療における有力な標的遺伝子異常であると考えられました。

図2 PCNSLモデルを通じたクローン多様性の解明
PCNSLは解糖系への強い依存性を示す
当施設症例のFDG-PET結果を後方視的に検討したところ、正常脳白質と比較して腫瘍部では約4倍超のFDG集積が認められました。解糖系蛋白発現を比較すると、腫瘍部では解糖系関連蛋白であるglucose transporter 1(Glut-1)やhexokinase 2(HK-2)が正常脳と比較して高発現していました。同様にPDXモデルにおいてもFDG高集積、Glut-1, HK-2高発現を確認しました。そこで解糖系を阻害することによる抗腫瘍効果を検討するため、解糖系を標的とした阻害剤さらにはshRNAを用いてGLUT1, HK2遺伝子を抑制したところ、細胞、動物モデルで強い抗腫瘍効果が認められました。このことから強い糖代謝はPCNSLの生存に重要な役割を果たしていることが判明しました。

図3:PCNSLの強い解糖系依存機序をPDXモデルで再現
PCNSLではNF-kB活性化が解糖系を亢進させることで腫瘍進展が生じる
我々は、PCNSLで重要と考えられているMYD88/CD79B遺伝子変異に起因するNF-kB経路の活性化が上述の解糖系依存を誘導していると仮説を立てました。そこでMYD88/CD79B遺伝子をshRNAにより抑制したところNF-kB経路関連蛋白であるRelA/p65の発現抑制とともにHK-2の発現低下が認められ、更には細胞活性の減弱を認めました。また動物モデルでもPDX形成抑制が認められました。またNF−kB阻害剤 (IKK阻害剤)、shRNAでのNF-kB RELA遺伝子抑制にて、HK-2発現抑制、細胞活性の減弱が生じました。このことからRelA/p65-HK-2経路がPCNSLの進展に重要な役割を果たすことが示されました。
Pin1活性によるRelA/p65安定化がPCNSL進展を促進させる
今回の検討では2症例からはPDXが形成されませんでした。PDXが樹立されない機序解明の中で、これらの細胞の蛋白発現を検討したところ、リン酸化RelA/p65の発現低下とともにRelA/p65の安定化に関与するPin1の発現が低下していました。そのためPin1発現がRelA/p65の安定をもたらしPCNSL腫瘍形成に関与すると仮説を立てました。興味深いことにPIN1遺伝子を抑制することでリン酸化RelA/p65とともにHK-2発現の低下が認められました。このことからMYD88やCD79B変異などによるNF-kB経路に関連する遺伝子異常とPin1は相補的にRelA/p65発現を誘導することでPCNSL進展を促進させることが判明しました。
EBV陽性PCNSLではLMP1とPin1によるRelA/p65恒常的発現がPCNSL進展を促進させる
免疫不全状態ではEBV陽性PCNSLが誘発されることが知られています。3症例のEBV陽性PCNSLでは、いずれの例でもEBV関連蛋白であるLMP1の強い発現が認められました。LMP1をshRNAを用いて抑制したところRelA/p65発現低下が観察されました。このことからもEBVが腫瘍形成に大きな役割を果たすことが裏付けられました。一方、1例ではPDXが樹立されなかったため、それぞれの検体のRelA/p65発現を検討したところ、PDXを樹立した検体でより高いRelA/p65発現が認められ、PDX樹立例ではPin1の強い発現が認められました。更にLMP1, PIN1遺伝子を抑制した細胞をマウス脳に移植すると著明に腫瘍形成遅延をきたしました。またRELA遺伝子を抑制したところEBV陽性PCNSLでもEBV陰性PCNSL同様にHK-2発現の低下を認めました。このことからLMP1とPin1によるRelA/p65恒常的発現が解糖系を亢進させることで腫瘍形成を引き起こすことが判明しました。
メソトレキセート大量化学療法の感受性はNF-kB経路の活性抑制により規定される
臨床におけるメソトレキセート(MTX)の感受性がPCNSL細胞株にて再現されるか検証したところ、強い関連性が存在することが判明しました。そこでMTX投与後の蛋白発現を解析したところ、MTXに対する感受性が高い細胞ではリン酸化RelA/p65とともにHK-2発現の低下が認められました。一方MTX抵抗細胞ではこれらの変化は観察されませんでした。これらの所見は動物モデルでも再現されました。このことからMTX大量化学療法による細胞毒性効果はNF-kB経路の活性抑制により誘導されることが明らかになりました。
今後の展開
今回樹立したPCNSL細胞株は患者腫瘍の組織像を模倣するものであり、生体外で腫瘍の進展を評価し得るものです。これらのPDXモデルを用いて検討を重ねた結果、PCNSLに対する多くの疑問点が明らかになりました。中でもEBV陰性PCNSL、EBV陽性PCNSLは、それぞれ異なる遺伝子異常によりNF-kB経路が異常に活性化し、その結果強い解糖系依存を引き起こすことでPCNSL形成を促進することが判明しました(図4)。このことはNF-kB経路と糖代謝異常がPCNSLの成因に強く関与していることを裏付けるものです。
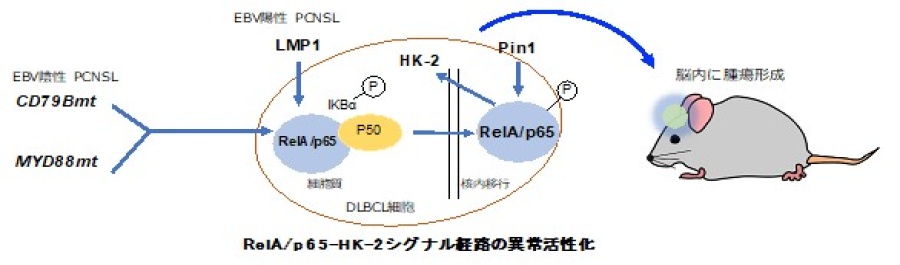
図4 PCNSLはNF-kB経路と解糖系酵素HK-2の活性化を通じて進展する
重要な点として、我々が樹立したPCNSL PDXモデルは生体における治療反応性をも忠実に再現するものであることから、これらの細胞株は今後の新規治療法開発の基盤材料となると考えられます。今回の研究でMTX治療後の細胞応答を検討したところ、薬剤感受性とNF-kB経路の抑制との関連付けが得られました。このことはいかにしてNF−kB経路を制御するかがPCNSLにおける重要な鍵となることを強く裏付けるものです。最近PCNSLに対し導入された分子標的薬(BTK阻害剤)はNF-kB経路の抑制を通じて抗腫瘍効果を発揮すると期待されています。一方でこれらの分子標的治療後の不応性や抵抗性の問題も挙げられていることから、次世代の治療法の開発に向けた研究を、PDXモデルを用いて引き続き行う必要があると考えられます。

図4 PCNSLはNF-kB経路と解糖系酵素HK-2の活性化を通じて進展する
重要な点として、我々が樹立したPCNSL PDXモデルは生体における治療反応性をも忠実に再現するものであることから、これらの細胞株は今後の新規治療法開発の基盤材料となると考えられます。今回の研究でMTX治療後の細胞応答を検討したところ、薬剤感受性とNF-kB経路の抑制との関連付けが得られました。このことはいかにしてNF−kB経路を制御するかがPCNSLにおける重要な鍵となることを強く裏付けるものです。最近PCNSLに対し導入された分子標的薬(BTK阻害剤)はNF-kB経路の抑制を通じて抗腫瘍効果を発揮すると期待されています。一方でこれらの分子標的治療後の不応性や抵抗性の問題も挙げられていることから、次世代の治療法の開発に向けた研究を、PDXモデルを用いて引き続き行う必要があると考えられます。
用語説明
*1 NF-kB:
転写因子として働くタンパク質複合体で、5種類のタンパク質より構成されています。中でもRelA/p65は古典的経路の中心的役割を果たし、リン酸化により複数の遺伝子転写を活性化します。
*2 PDX: patient-derived xenograft(異種同所性腫瘍モデル):
免疫不全マウスの脳内に患者腫瘍を移植して作成した脳腫瘍モデル。患者腫瘍の表現型、遺伝型を広範囲に再現する。
転写因子として働くタンパク質複合体で、5種類のタンパク質より構成されています。中でもRelA/p65は古典的経路の中心的役割を果たし、リン酸化により複数の遺伝子転写を活性化します。
*2 PDX: patient-derived xenograft(異種同所性腫瘍モデル):
免疫不全マウスの脳内に患者腫瘍を移植して作成した脳腫瘍モデル。患者腫瘍の表現型、遺伝型を広範囲に再現する。
論文情報
A hyperactive RelA/p65-hexokinase 2 signaling axis drives primary central nervous system lymphoma
Tateishi K1,2, Miyake Y1, Kawazu M1, Sasaki N, Nakamura T, Sasame J, Yoshii Y, Ueno T, Miyake A, Watanabe J, Matsushita Y, Shiba N, Udaka N, Ohki K, Fink AL, Tummala SS, Natsumeda M, Ikegaya N, Nishi M, Ohtake M, Miyazaki R, Suenaga J, Murata H, Aoki I, Miller JJ, Fujii Y, Ryo A, Yamanaka S, Mano H, Cahill DP, Wakimoto H, Chi AS, Batchelor TT, Nagane M, Ichimura K and Yamamoto T.
Cancer Res. 2020. DOI: 10.1158/0008-5472.CAN-20-2425
1筆頭著者、 2責任著者
※本研究は、科学研究費補助金 (16K10765、19K09488、19K18398、18K16565、17K16632、19K09476、18K16592、19K18418、16H05442、20H03795)、国立研究開発法人日本医療研究開発機構(AMED, JPcm0106502)、横浜市立大学学長裁量事業(かもめプロジェクト)、高松宮妃癌研究基金研究助成金、上原記念生命科学財団研究助成金、香川大学讃樹会研究助成金、新潟大学共同利用・共同研究助成金、日本対がん協会リレー・フォー・ライフ・ジャパンプロジェクト未来研究助成金、金原一郎記念医学医療振興財団研究助成金、日本脳神経財団研究助成金による支援を得て行われました。
Tateishi K1,2, Miyake Y1, Kawazu M1, Sasaki N, Nakamura T, Sasame J, Yoshii Y, Ueno T, Miyake A, Watanabe J, Matsushita Y, Shiba N, Udaka N, Ohki K, Fink AL, Tummala SS, Natsumeda M, Ikegaya N, Nishi M, Ohtake M, Miyazaki R, Suenaga J, Murata H, Aoki I, Miller JJ, Fujii Y, Ryo A, Yamanaka S, Mano H, Cahill DP, Wakimoto H, Chi AS, Batchelor TT, Nagane M, Ichimura K and Yamamoto T.
Cancer Res. 2020. DOI: 10.1158/0008-5472.CAN-20-2425
1筆頭著者、 2責任著者
※本研究は、科学研究費補助金 (16K10765、19K09488、19K18398、18K16565、17K16632、19K09476、18K16592、19K18418、16H05442、20H03795)、国立研究開発法人日本医療研究開発機構(AMED, JPcm0106502)、横浜市立大学学長裁量事業(かもめプロジェクト)、高松宮妃癌研究基金研究助成金、上原記念生命科学財団研究助成金、香川大学讃樹会研究助成金、新潟大学共同利用・共同研究助成金、日本対がん協会リレー・フォー・ライフ・ジャパンプロジェクト未来研究助成金、金原一郎記念医学医療振興財団研究助成金、日本脳神経財団研究助成金による支援を得て行われました。
問い合わせ先
横浜市立大学 広報室
E-mail :koho@yokohama-cu.ac.jp