2012.10.09
- プレスリリース
- 研究
微生物学の梁 明秀教授らのグループは、HIV蛋白質の翻訳後修飾を制御することでエイズウイルスの増殖を抑制する宿主蛋白質を新たに同定しました。
この研究成果は、2012年10月9日にScience Signaling 誌に掲載されました。
この研究成果は、2012年10月9日にScience Signaling 誌に掲載されました。
最近のウイルス研究領域のトピックとして、内因性抗レトロウイルス因子群の発見があげられます。これらは、原則としてI型インターフェロンで誘導され、細胞内のウイルス複製サイクルの一部を強力に阻害します。それ故、これらは本来ヒト細胞が備えている細胞内免疫関連因子の1つであると考えられています。
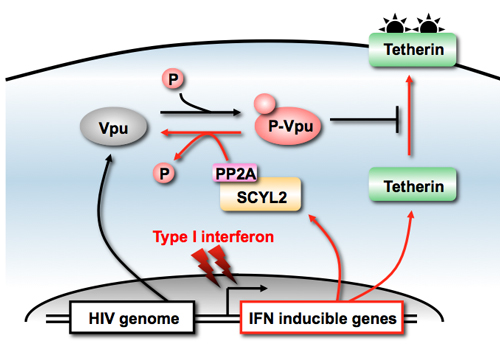
最近発見された内因性抗レトロウイルス因子Tetherinは、BST2やCD317とも呼ばれる一回膜貫通型タンパク質で、細胞膜上でHIV粒子を係留して、ウイルスの細胞外への放出を強力に阻止します。HIV-1のアクセサリータンパクVpuはTetherinと直接結合し、Tetherinを感染細胞のエンドソーム内に引き込んでライソゾーム依存的に分解します。
ただしVpu活性化には、Vpuの52番目と56番目のセリン残基のリン酸化が必要です。私たちはこのリン酸化/脱リン酸化の制御に関わる宿主因子の探索を試みました。本領域の公募研究員である愛媛大学の澤崎先生と共同で、Vpuに結合するヒト由来のリン酸化関連酵素群をコムギ無細胞タンパク質合成系とアルファスクリーンを用いたハイスループットスクリーニング法により探索しました。
その結果、約10種類の候補タンパク質が同定され、そのうちの1つであるSCYL2がvpu依存的にHIVの複製を阻害することがわかりました。よく調べてみるとSCYL2はキナーゼドメインを持つにも関わらず、キナーゼ活性は消失しており、むしろVpuタンパク質の脱リン酸化を促進しました。
さらなる解析により、SCYL2はPP2AフォスファターゼをVpuにリクルートすることで、Vpuの脱リン酸化を亢進させていました。さらに、SCYL2はI型インターフェロンで誘導され、Vpuの抗Tetherin活性を抑制する上流因子であることが分かりました。
ヒトとエイズウイルスとの戦いは過去から現在まで様々な形で変遷してきたことが想像されます。SCYL2-Vpu-Tetherinという関係性は、今後のウイルス進化の過程でさらに発展していくのかもしれません。
最近発見された内因性抗レトロウイルス因子Tetherinは、BST2やCD317とも呼ばれる一回膜貫通型タンパク質で、細胞膜上でHIV粒子を係留して、ウイルスの細胞外への放出を強力に阻止します。HIV-1のアクセサリータンパクVpuはTetherinと直接結合し、Tetherinを感染細胞のエンドソーム内に引き込んでライソゾーム依存的に分解します。
ただしVpu活性化には、Vpuの52番目と56番目のセリン残基のリン酸化が必要です。私たちはこのリン酸化/脱リン酸化の制御に関わる宿主因子の探索を試みました。本領域の公募研究員である愛媛大学の澤崎先生と共同で、Vpuに結合するヒト由来のリン酸化関連酵素群をコムギ無細胞タンパク質合成系とアルファスクリーンを用いたハイスループットスクリーニング法により探索しました。
その結果、約10種類の候補タンパク質が同定され、そのうちの1つであるSCYL2がvpu依存的にHIVの複製を阻害することがわかりました。よく調べてみるとSCYL2はキナーゼドメインを持つにも関わらず、キナーゼ活性は消失しており、むしろVpuタンパク質の脱リン酸化を促進しました。
さらなる解析により、SCYL2はPP2AフォスファターゼをVpuにリクルートすることで、Vpuの脱リン酸化を亢進させていました。さらに、SCYL2はI型インターフェロンで誘導され、Vpuの抗Tetherin活性を抑制する上流因子であることが分かりました。
ヒトとエイズウイルスとの戦いは過去から現在まで様々な形で変遷してきたことが想像されます。SCYL2-Vpu-Tetherinという関係性は、今後のウイルス進化の過程でさらに発展していくのかもしれません。
SCYL2によるHIV-1 Vpu阻害機構の模式図