2021.07.05
- プレスリリース
- 研究
ヌクレオソーム中のH2A-H2Bテイルの動的構造を解明
横浜市立大学大学院生命医科学研究科の大友秀明特任助教と西村善文特任教授(広島大学大学院統合生命科学研究科長兼任)らは、量子科学技術研究開発機構の河野秀俊グループリーダーらとの共同研究で、核磁気共鳴装置(NMR*1)と分子動力学(MD)シミュレーション*2を用いて、クロマチンの基本構造であるヌクレオソーム中のH2A-H2Bテイルの動的な構造を初めて解明しました。
本研究は、『Journal of Molecular Biology』に掲載されました。
本研究は、『Journal of Molecular Biology』に掲載されました。
研究成果のポイント
|
研究背景
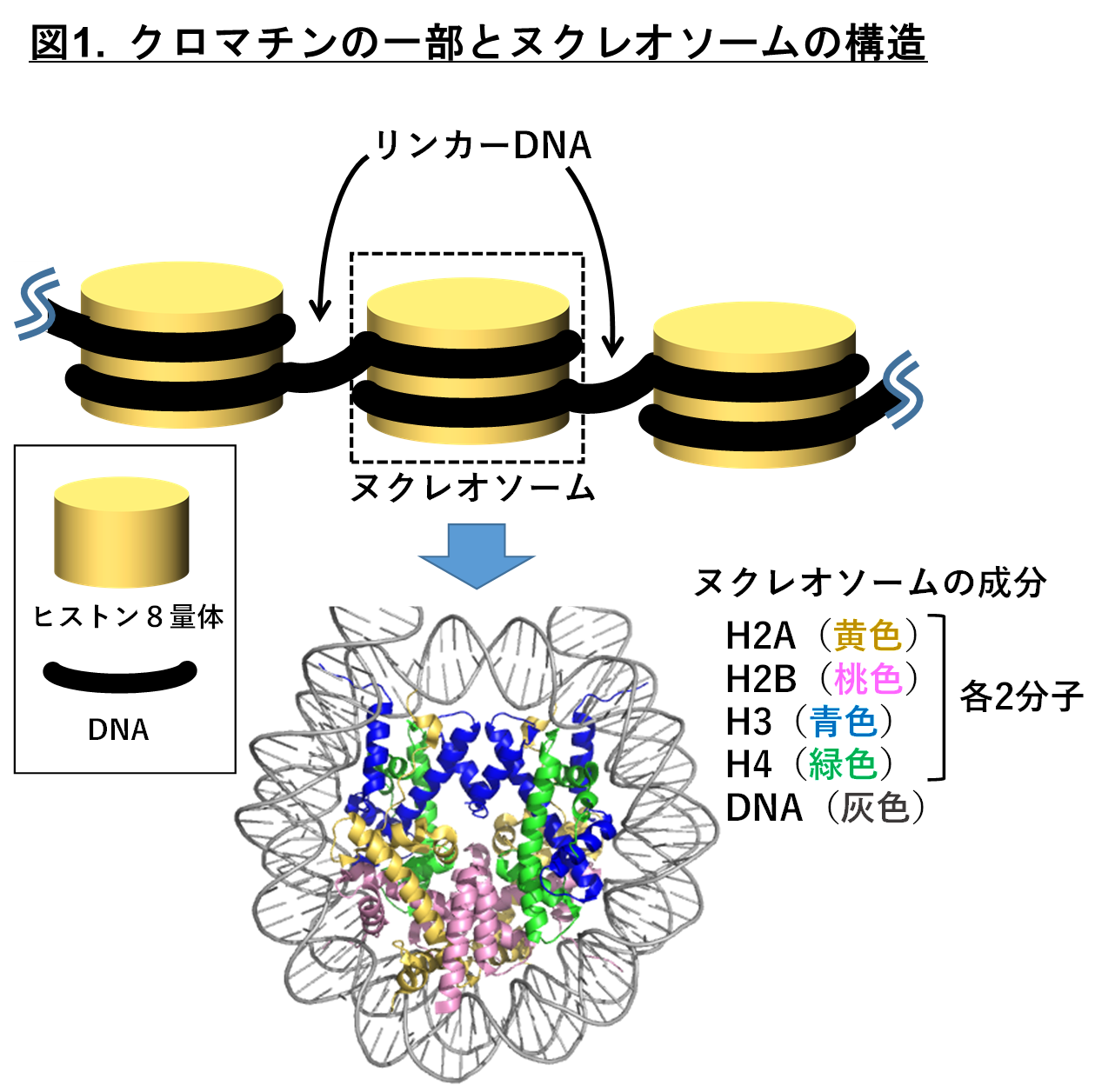 真核生物のDNAは様々な因子によって折りたたまれ、クロマチン構造と呼ばれる形をとっています。クロマチンは、ヒストンタンパク質にDNAが巻き付いたヌクレオソームという構造体がリンカーDNAで繋がれた繰り返し構造を基本とし、その構造はX線結晶構造解析やクライオ電子顕微鏡によって決定されています(図1)。ヌクレオソームには4種類のヒストン(H2A、H2B、H3、H4)が含まれており、H2AはN末端とC末端、H2B、H3、H4はN末端にそれぞれヒストンテイルという構造領域をもっています。
真核生物のDNAは様々な因子によって折りたたまれ、クロマチン構造と呼ばれる形をとっています。クロマチンは、ヒストンタンパク質にDNAが巻き付いたヌクレオソームという構造体がリンカーDNAで繋がれた繰り返し構造を基本とし、その構造はX線結晶構造解析やクライオ電子顕微鏡によって決定されています(図1)。ヌクレオソームには4種類のヒストン(H2A、H2B、H3、H4)が含まれており、H2AはN末端とC末端、H2B、H3、H4はN末端にそれぞれヒストンテイルという構造領域をもっています。 ヒストンテイルは、ヌクレオソームの安定性やクロマチン凝集に関与し、またアセチル化、メチル化、リン酸化、ユビキチン化などの翻訳後修飾を受けて遺伝子のはたらきを制御し、エピゲノム*3で重要な役割を担っています。ヌクレオソーム中でヒストンテイルはどのような構造をとっているのか、またどのように遺伝子の発現を制御しているのかがエピゲノム研究で重要な課題です。しかしヒストンテイルは柔軟に動いているのに対し、X線結晶構造解析やクライオ電子顕微鏡などの従来の方法では構造の動きを正確に見ることができていませんでした。それに対しNMRを用いた解析は、X線結晶構造解析やクライオ電子顕微鏡では見えない運動性の高い領域、動的構造を解析する非常に有力な手法です。
ヌクレオソーム中のヒストン各々のヒストンテイルが特徴的な動的構造を取り特徴的な役割を果たしていると考えられています。これまでに本研究室では、高磁場NMRを用いた研究で、ヌクレオソーム中のH4テイルのアセチル化によってH3テイルの動的構造が変化し、H3テイルのアセチル化が促進されてヌクレオソームを緩んだ構造に変化させる事や、ヌクレオソームのDNAの一部がヒストンシャペロンFACTの酸性領域で置換されるとH3テイルの動的構造が変化し、アセチル化が促進されヌクレオソームを緩んだ構造に変化させる事を明らかにしてきました。
本研究では、残るH2AとH2Bのテイルの動的構造を解析しています。NMRでは原子レベルで動的構造の違いを実測でき、さらにコンピューター上で分子の動きを計算する手法であるMDシミュレーションを行うことで、実測と計算の両面からH2AとH2BのN末端テイルの動的構造を明らかにしました。
研究内容
本研究では、リンカーDNAの無い145bpとリンカーDNAを含む193bpの長さのDNAを用いて2種類のヌクレオソームを調製し、その中のH2AとH2Bのテイル領域を高磁場NMRで解析しました。これは、リンカーDNAが無いヌクレオソームは遺伝子の発現が抑制されている基本構造、リンカーDNAがあるヌクレオソームは遺伝子の発現が活性な基本構造を表すと考え、それらを比較するためです。どちらのヌクレオソームでもこれまでのヒトのヌクレオソームの結晶構造で見えていない H2AのSer1-Gly8、Thr120-K129とH2BのGlu2-Lys27のNMRシグナルが観測されました(図2)。145bpヌクレオソームと193bpヌクレオソームを比較すると、H2AとH2BのN末端テイルのシグナルは同様でしたが、H2AのC末端テイルのシグナルが全体的に大きく変化していました(図3)。この結果はリンカーDNAの有無がH2AのC末端テイルの動的構造に大きく影響していることを示します。
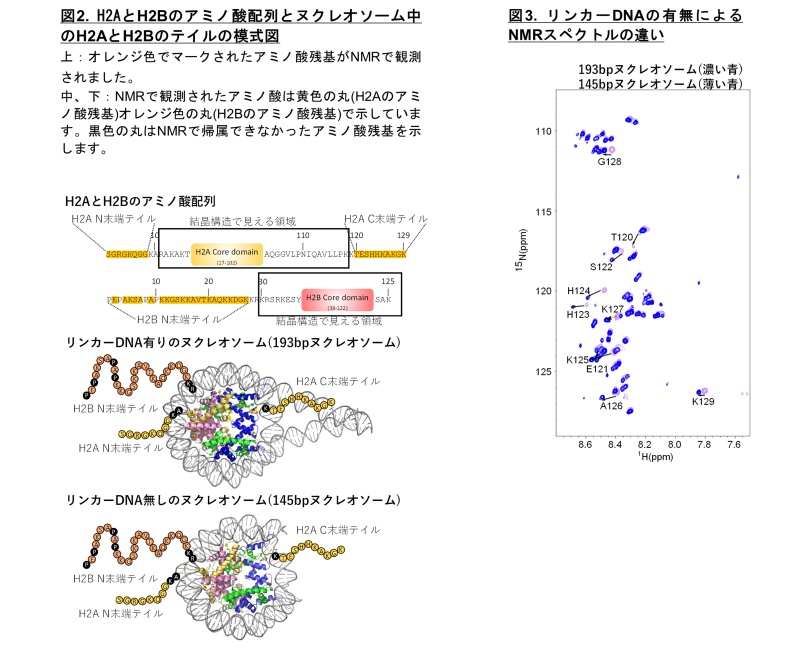
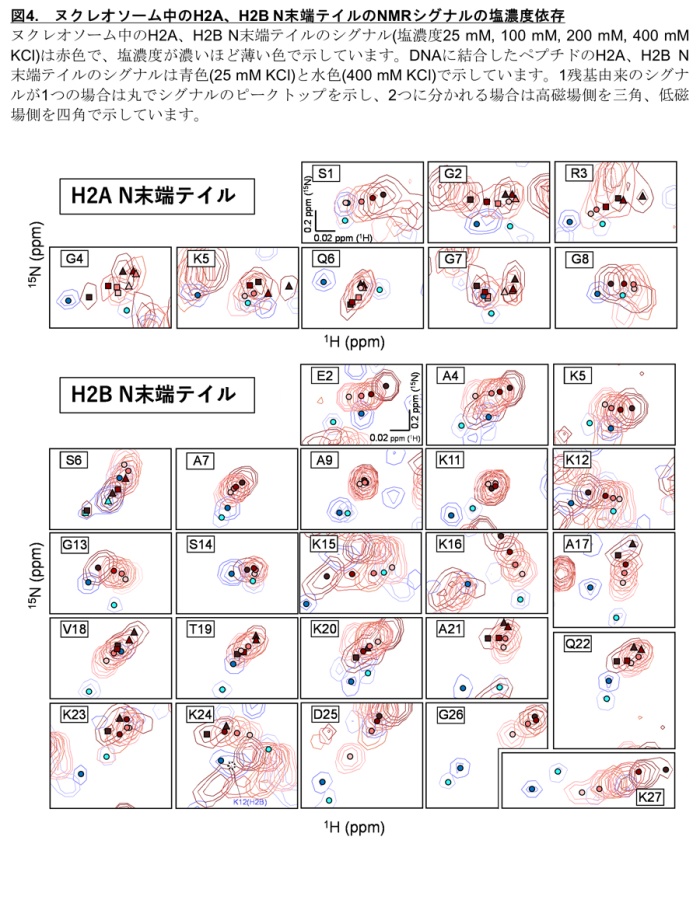
H2AとH2BのN末端テイルのH2A Gly2-Gly7とH2B Ser6, Ala17-Lys27では、1つのアミノ酸残基に2つのシグナルが観測されました。これらのシグナルは塩化カリウム濃度を25 mMから400 mMまで増加させると近づいて1つになります(図4)。この結果は、シグナルの分離がH2AとH2BのN末端テイルとヌクレオソームDNAの静電相互作用によることを示します。正電荷に帯電したヒストンテイルと負電荷に帯電したDNAは静電的に結合していると考えられ、塩化カリウムの濃度が低い時は静電的な結合が強く、高い時には弱くなるためです。またヌクレオソーム中のH2A、H2Bテイルとテイル部分だけを切り取ったペプチド断片を比較して、ヌクレオソーム中のテイルとヌクレオソーム中のDNAがどのように相互作用しているかを解析しました。H2AまたはH2Bのテイル領域のペプチド断片にDNAを結合させたときのスペクトルは、ヌクレオソーム中のH2AとH2Bのテイルと類似性がありました(図4)。
しかし、H2B Ser6以外のアミノ酸はDNAが結合してもシグナルは1つのままでした。DNAに結合したペプチドとヌクレオソーム中のH2A、H2Bのシグナルの比較と塩化カリウム濃度を増加させたときのシグナルの動きから判断すると、H2Aに関しては、2つにわかれたシグナルの内、1つはDNAとの相互作用が強く、もう1つは弱いことが示唆されました。
しかし、H2B Ser6以外のアミノ酸はDNAが結合してもシグナルは1つのままでした。DNAに結合したペプチドとヌクレオソーム中のH2A、H2Bのシグナルの比較と塩化カリウム濃度を増加させたときのシグナルの動きから判断すると、H2Aに関しては、2つにわかれたシグナルの内、1つはDNAとの相互作用が強く、もう1つは弱いことが示唆されました。
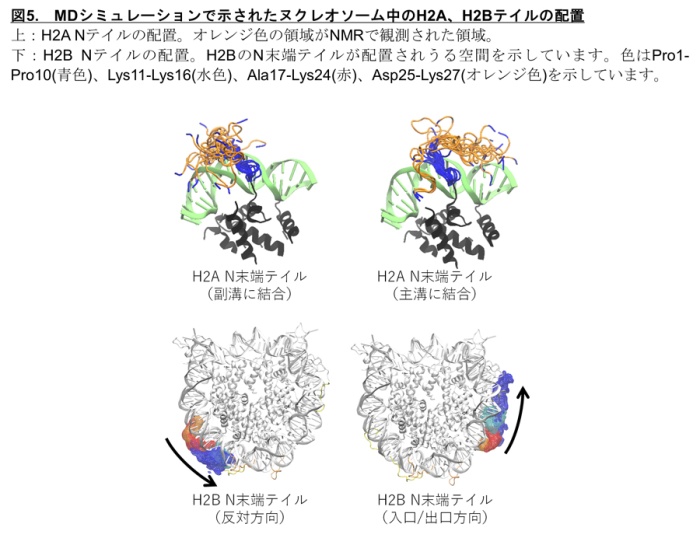
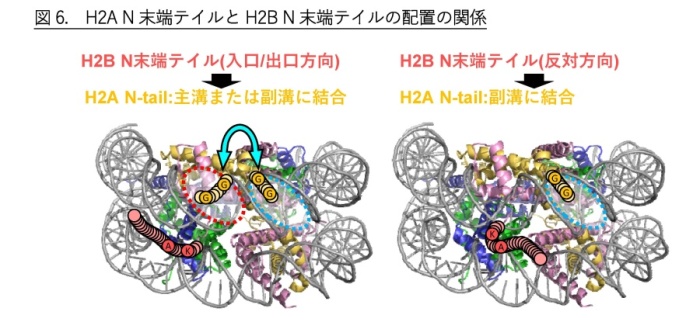
一方、H2Bの2つの動的構造に関してはDNAの結合の強弱にH2Aほどの明確な差は見られませんでした。そこで、H2AとH2BのN末端テイルがどのようにDNAと相互作用しているかを調べるために、MDシミュレーションを行いました。その結果、H2AのN末端テイルには主溝*4に結合した構造と副溝*4に結合した構造が存在することがわかりました(図5上)。また、H2BのN末端テイルにはヌクレオソームDNAの入口/出口の方向に配置する構造とその反対方向に位置する構造が存在しうることがわかりました(図5下)。 H2BのN末端テイルが入口/出口方向に位置するとき、H2AのN末端テイルは主溝と副溝のどちらにも配置できますが、H2BのN末端テイルが入口/出口と反対方向に位置するとき、H2AのN末端テイルは副溝にしか配置できないことがわかりました(図6)。
以上、本研究ではH2AのC末端テイルの動的構造がリンカーDNAの有無で大きく変化すること、また、NMRとMDシミュレーションを組み合わせた手法で明らかにしたH2AとH2BのN末端テイルの2種類の構造を世界で初めて報告しました。
以上、本研究ではH2AのC末端テイルの動的構造がリンカーDNAの有無で大きく変化すること、また、NMRとMDシミュレーションを組み合わせた手法で明らかにしたH2AとH2BのN末端テイルの2種類の構造を世界で初めて報告しました。
今後の展開
本研究では、リンカーDNAの有無でH2AのC末端テイルの動的構造が変化することが明らかにされました。また、NMRとMDシミュレーションを組み合わせた手法でヌクレオソーム中のH2AのN末端テイルの配置がH2BのN末端テイルの配置に影響されることを示しました。本研究に用いた手法を援用することにより、今後すべてのヒストンテイルにおけるネットワークの解明やH1のようなリンカーDNA構造を変化させる分子によるヒストンテイルへの影響の解明につながると期待できます。
研究費
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」、文部科学省「先端研究基盤共用促進事業(共用プラットフォーム形成支援プログラム) NMR共用プラットフォーム」、新学術領域「遺伝子制御の基盤となるクロマチンポテンシャル」の一環で行われました。
論文情報
N-terminal tails of histones H2A and H2B adopt two distinct conformations in the nucleosome with contact and reduced contact to DNA. Hideaki Ohtomo, Jun-ichi Kurita, Shun Sakuraba, Zhenhai Li, Yasuhiro Arimura, Masatoshi Wakamori, Yasuo Tsunaka, Takashi Umehara, Hitoshi Kurumizaka, Hidetoshi Kono, and Yoshifumi Nishimura
doi:https://doi.org/10.1016/j.jmb.2021.167110
doi:https://doi.org/10.1016/j.jmb.2021.167110
用語説明
*1 NMR:
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質などに対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。ふらふらと揺らいでいるタンパク質部位の原子レベルでの同定が可能である。
*2 分子動力学シミュレーション:
コンピューター上で、物理法則にもとづいて分子(または原子)の時々刻々の動きを再現する方法。
*3エピゲノム:
ゲノムを超えてという意味で、同じゲノムDNAを持っていても、例えばヒトでは心臓や肝臓や神経など約250種類の細胞に分化するのは、細胞ごとにDNAがとるクロマチン構造が変化しているためで、その変化にヒストンテイルの翻訳後修飾が非常に重要な役割を果たしている。
*4 主溝、副溝:
DNAの二重らせんには、幅の広い溝(主溝)と幅の狭い溝(副溝)がある。
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質などに対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。ふらふらと揺らいでいるタンパク質部位の原子レベルでの同定が可能である。
*2 分子動力学シミュレーション:
コンピューター上で、物理法則にもとづいて分子(または原子)の時々刻々の動きを再現する方法。
*3エピゲノム:
ゲノムを超えてという意味で、同じゲノムDNAを持っていても、例えばヒトでは心臓や肝臓や神経など約250種類の細胞に分化するのは、細胞ごとにDNAがとるクロマチン構造が変化しているためで、その変化にヒストンテイルの翻訳後修飾が非常に重要な役割を果たしている。
*4 主溝、副溝:
DNAの二重らせんには、幅の広い溝(主溝)と幅の狭い溝(副溝)がある。
