生きた細胞内で小胞の動きを可視化し、2種類の小胞融合機構を発見
マウス胚を包む卵黄嚢の細胞を用いて、細胞内で物質の輸送などを行う小胞を蛍光物質で標識し、これが融合する過程を可視化する技術を開発しました。これにより小胞の融合過程を観察したところ、融合には2つの異なる様式があること、また、その制御に細胞骨格アクチンが関与することを見いだしました。
細胞は、外界から物質を取り込み、エンドソームと呼ばれる小胞に包んで細胞内を輸送します。輸送過程で、小胞は、小胞同士、あるいは他の細胞内小器官と融合しますが、多くの細胞ではそのサイズが小さいために融合過程を観察することが難しく、その制御機構はよく分かっていませんでした。
本研究では、マウス胚の一番外側にある臓側内胚葉細胞に着目し、蛍光物質でエンドソームを標識することにより、顕微鏡下でその融合過程を観察することに成功しました。これにより、エンドソームの融合には、2つのエンドソームが急速に融合して1つの小胞になる「同型融合」と、リソソームにゆっくりと吸収される「異型融合」の2種類の様式があることを見いだしました。膜の力学モデルを用いて小胞融合過程の数理解析を行ったところ、小胞のサイズが融合様式を決めており、小胞が小さい時は同型融合が、小胞が大きくなると異型融合が起こること、また、小胞の膜にゆらぎの力を作用させると、大きなサイズでも同型融合が起こることが分かりました。エンドソームにはアクチンと呼ばれる細胞骨格タンパク質が結合しており、アクチンが同型融合を促進するゆらぎの力を発生させていると考えられました。さらに、アクチンのターンオーバーを促進するコフィリンや、アクチンと相互作用するミオシンも小胞融合に重要であることが明らかになりました。この観察系を用いることにより、細胞内小胞の融合や輸送の過程を制御する仕組みを解明できると期待されます。
本研究では、マウス胚の一番外側にある臓側内胚葉細胞に着目し、蛍光物質でエンドソームを標識することにより、顕微鏡下でその融合過程を観察することに成功しました。これにより、エンドソームの融合には、2つのエンドソームが急速に融合して1つの小胞になる「同型融合」と、リソソームにゆっくりと吸収される「異型融合」の2種類の様式があることを見いだしました。膜の力学モデルを用いて小胞融合過程の数理解析を行ったところ、小胞のサイズが融合様式を決めており、小胞が小さい時は同型融合が、小胞が大きくなると異型融合が起こること、また、小胞の膜にゆらぎの力を作用させると、大きなサイズでも同型融合が起こることが分かりました。エンドソームにはアクチンと呼ばれる細胞骨格タンパク質が結合しており、アクチンが同型融合を促進するゆらぎの力を発生させていると考えられました。さらに、アクチンのターンオーバーを促進するコフィリンや、アクチンと相互作用するミオシンも小胞融合に重要であることが明らかになりました。この観察系を用いることにより、細胞内小胞の融合や輸送の過程を制御する仕組みを解明できると期待されます。
研究代表者
筑波大学医学医療系桝 正幸 教授
富山大学学術研究部工学系
小池 誠一 特命助教
横浜市立大学理学部
立川 正志 准教授
自然科学研究機構生命創成探究センター/生理学研究所
根本 知己 教授
研究の背景
細胞は、外界から栄養物質などを取り込んで利用します。この働きをエンドサイトーシス注1)と呼び、細胞膜が細胞質内に引き込まれて物質を取り込んだり、細胞外液ごと物質を細胞内へ取り込んだりします。取り込まれた物質は、エンドソーム注2)と呼ばれる小さな袋状の構造に包まれて、細胞内小器官注3)へと輸送されます。エンドソームは、取り込んだ物質の仕分けを行い、リソソーム注4)などの細胞内小器官への輸送を担っています。エンドソームなど膜に包まれた袋状の構造(小胞)を介した物質の輸送(小胞輸送注5))は細胞機能の根幹を成すものであり、その仕組みを知ることは細胞を理解するために重要です。小胞輸送の過程で、細胞内小胞は、小胞同士、あるいは他の細胞内小器官と融合しますが、多くの細胞では小胞のサイズが小さいため顕微鏡で個々の融合過程を観察することが難しく、融合を制御する仕組みはよく分かっていませんでした。
研究内容と成果
本研究では、発生の早い時期(胎生8.5日頃)のマウス胚を生きたままの状態で取り出して、エンドソームを標識する蛍光物質を取り込ませた後に、顕微鏡を用いて観察しました。この方法により、マウス胚の一番外側にある卵黄嚢注6)の臓側内胚葉細胞と呼ばれる細胞内でのエンドソームの融合を観察することに成功しました。臓側内胚葉細胞は、胎盤が出来上がる前に、母親の子宮から胚へ多くの栄養分を運ぶ役割があるためにエンドサイトーシスが活発で、細胞内に非常に大きなエンドソームを持つため、観察が容易です。また、臓側内胚葉細胞では、頂端部からエンドサイトーシスによって物質を取り込み、それを細胞内の深い層にあるリソソームで分解し、分解された栄養物質を細胞底部から分泌して胚に届けていることが知られています(図1)。今回開発した手法を用いて臓側内胚葉細胞を観察したところ、後期エンドソームの融合には、エンドソーム同士が融合する「同型融合」注7)と、エンドソームとリソソームが融合する「異型融合」注7)の2種類の融合様式があることを発見しました。同型融合では、2つの後期エンドソームが接触して小孔が形成されると急速にその孔が拡大して1つの小胞になるのに対し、異型融合では、後期エンドソームとリソソームの間に形成された小孔が拡大せず、後期エンドソームがゆっくりとリソソームに吸収されていく様子が観察されました(図2)。力学モデルを用いて小胞が融合する過程の数理解析を行ったところ、主に小胞のサイズが融合様式を決定しており、サイズが小さい場合は同型融合が、大きな場合には異型融合が起こることが分かりました。臓側内胚葉細胞の後期エンドソームは大きく、理論上は異型融合が起こるはずですが、その場合でも膜に細胞骨格やモータータンパク質注8)からの「ゆらぎの力」注9)を作用させると、サイズの効果に打ち勝ち、同型融合を誘導できることも示されました。
さらに、レーザー共焦点顕微鏡を用いて臓側内胚葉細胞の小胞の構造を詳しく調べたところ、後期エンドソームの表面にアクチン注10)と呼ばれる細胞骨格タンパク質が結合しており、後期エンドソームに結合しているアクチンは、細胞の頂端部から底部へ向けて伸びる線維と、後期エンドソームから放射状に周囲に伸びる線維の2種類があることが分かりました(図3)。アクチンは、筋肉細胞でミオシン注11)と共に働き、筋肉の収縮に関わることは知られていますが、筋肉以外の細胞にも存在し、形態形成、細胞分裂、小胞輸送などさまざまな生物現象に関与しています。薬物を用いてアクチンの重合を阻害すると、同型融合の頻度と速度が減少し、高濃度の薬物を作用させると異型融合に似た融合様式になることから、アクチンが同型融合を促進する力を発生させていると考えられました。さまざまなミオシン阻害薬を投与すると同型融合と異型融合の頻度がいずれも減少することから、筋肉以外の細胞で働く種類のミオシンが小胞融合に必要なことが分かりました。さらに、アクチンを切断して重合・脱重合のターンオーバーを促進するタンパク質であるコフィリン注12)の機能を阻害すると同型融合の頻度が減少することから、コフィリンによるアクチン動態の制御が小胞融合に重要だと考えられました。
さらに、レーザー共焦点顕微鏡を用いて臓側内胚葉細胞の小胞の構造を詳しく調べたところ、後期エンドソームの表面にアクチン注10)と呼ばれる細胞骨格タンパク質が結合しており、後期エンドソームに結合しているアクチンは、細胞の頂端部から底部へ向けて伸びる線維と、後期エンドソームから放射状に周囲に伸びる線維の2種類があることが分かりました(図3)。アクチンは、筋肉細胞でミオシン注11)と共に働き、筋肉の収縮に関わることは知られていますが、筋肉以外の細胞にも存在し、形態形成、細胞分裂、小胞輸送などさまざまな生物現象に関与しています。薬物を用いてアクチンの重合を阻害すると、同型融合の頻度と速度が減少し、高濃度の薬物を作用させると異型融合に似た融合様式になることから、アクチンが同型融合を促進する力を発生させていると考えられました。さまざまなミオシン阻害薬を投与すると同型融合と異型融合の頻度がいずれも減少することから、筋肉以外の細胞で働く種類のミオシンが小胞融合に必要なことが分かりました。さらに、アクチンを切断して重合・脱重合のターンオーバーを促進するタンパク質であるコフィリン注12)の機能を阻害すると同型融合の頻度が減少することから、コフィリンによるアクチン動態の制御が小胞融合に重要だと考えられました。
今後の展開
生きた細胞内でエンドソームが融合する過程を可視化する実験系を確立したことで、小胞融合を制御する分子機構を調べることが可能になります。特に、マウス初期胚は、培養しながら各種薬物を作用させることができるため、細胞内で働く分子の働きを活性化したり阻害した時の効果を調べると、小胞融合を調節する仕組みを解明できます。また、さまざまな遺伝子改変マウスの胚を用いることで、おのおのの遺伝子の小胞輸送における役割を明らかにすることができます。
小胞輸送に異常が生じると、神経疾患、免疫疾患、糖尿病などが起こることが知られており、本研究は基本的な細胞機能だけでなく、さまざまな疾患の発症メカニズムの解明にもつながると期待されます。
小胞輸送に異常が生じると、神経疾患、免疫疾患、糖尿病などが起こることが知られており、本研究は基本的な細胞機能だけでなく、さまざまな疾患の発症メカニズムの解明にもつながると期待されます。
参考図
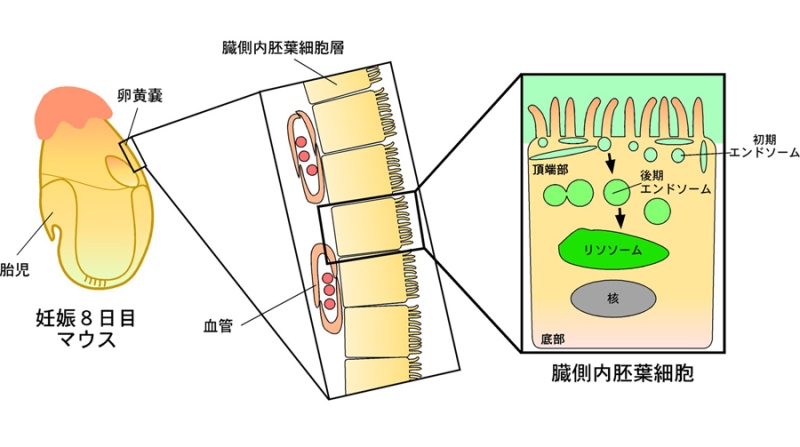

妊娠8日目のマウス胚を蛍光物質で標識した後、臓側内胚葉細胞を顕微鏡観察すると、細胞外から取り込まれた物質が、初期エンドソーム、後期エンドソームを経てリソソームへ運ばれる様子が観察された。
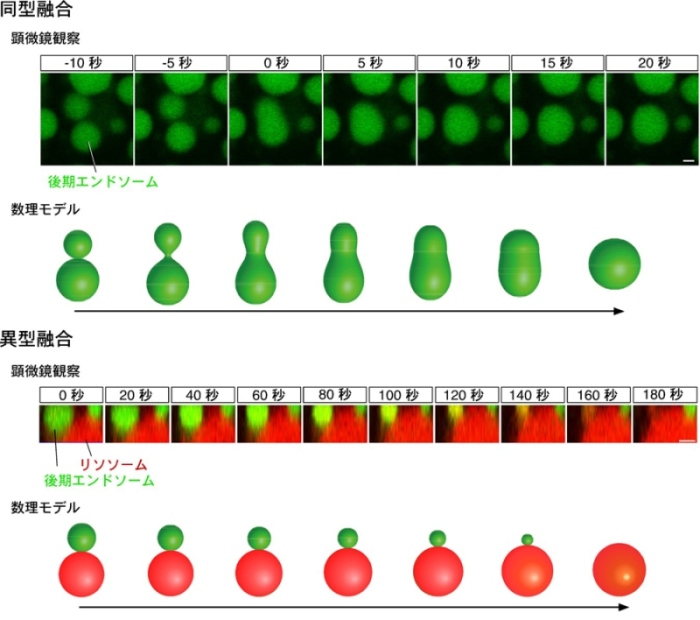

エンドソームの融合には、2つのエンドソーム(緑色)が急速に合体して1つの小胞になる同型融合(上段)と、エンドソームがゆっくりとリソソーム(赤色)に吸収されていく異型融合(下段)があることが分かった。この2種類の融合は、力学モデルを用いた数理解析で予想されたものとよく似ていた。
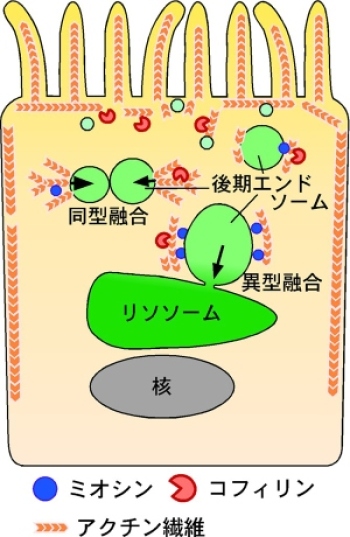

臓側内胚葉細胞の中では、最初に表層で同型融合が起こり、次いで深い層で異型融合が起こる。小胞の融合には、後期エンドソームの表面に結合しているアクチン線維を介した力が必要であり、アクチンの働きを調節するタンパク質も重要な役割を担っていることが分かった。
用語解説
注1) エンドサイトーシス
細胞が細胞外から物質を取り込むこと。極性を持つ大きな分子は脂質二重層である細胞膜を通り抜けることができないため、細胞膜上の受容体に結合した形で細胞膜が細胞質内
に引き込まれたり、細胞外液ごと小胞内に取り込むことにより、物質が細胞内へ取り込まれる。
注2) エンドソーム
細胞内小胞の一つ。エンドサイトーシスによって細胞内へ取り込まれた物質の選別・輸送に関わる。形態的・機能的特徴から、初期エンドソーム、後期エンドソーム、リサイク
リングエンドソームに大別される。初期エンドソームは取り込んだ物質の仕分けを行い、後期エンドソームはリソソームと融合することにより内容物を分解に導く。リサイクリ
ングエンドソームは、一度取り込んだ物質を再び細胞外へ戻す。
注3) 細胞内小器官
真核生物の細胞内に存在する小胞体、ゴルジ体、ミトコンドリアなどの生体膜で区画された構造。タンパク質の合成・修飾やエネルギー産生などの役割を担う。いずれも生体膜
で覆われており、おのおのの細胞内小器官で必要な物質の交換は小胞輸送により行われる。
注4) リソソーム
物質の分解を行う細胞内小器官。膜に包まれた構造で、内部に多数の加水分解酵素を持ち、タンパク質、糖、脂質などを分解し、再利用に供する。
注5) 小胞輸送
細胞内で小胞を介して物質を輸送する仕組み。真核細胞内には細胞内小器官があり、各細胞内小器官で必要な物質は、脂質二重膜から成る小さな袋(小胞)に梱包して輸送され
る。細胞内小器官の膜から小胞が出芽し、細胞内を移動して別の細胞内小器官に融合することを繰り返して、細胞は物質を輸送する。2013年、米国の研究者3名がこの制御機構
を発見し、ノーベル生理学・医学賞を受賞した。
注6) 卵黄嚢
発生初期に胚を包んでいる膜構造。胚の外側に位置し母体組織に接している臓側卵黄嚢は、2層の細胞層から成る。外側の層にある臓側内胚葉細胞は、胎盤が完成するまでの間
母胎から胚へ栄養を供給し、内側の層にある中胚葉細胞では、体の中で最初に血液細胞が作られる。
注7) 同型融合と異型融合
後期エンドソーム同士の融合のように、同じタイプの小胞が融合することを同型融合と呼び、後期エンドソームがリソソームに融合するように、異なるタイプの小胞が融合する
ことを異型融合と呼ぶ。
注8) モータータンパク質
ATP加水分解のエネルギーを用いて細胞内で小胞輸送、細胞内小器官の移動、細胞の収縮、染色体の分離などの運動を担うタンパク質の総称。
注9) ゆらぎの力
ここでは、膜の変形を引き起こす力に相当する数理モデルにおける変数を指す。
注10) アクチン
細胞骨格を形成するタンパク質の一つであり、単量体の球状アクチンがらせん状につながって線維状アクチンを形成する。筋肉細胞ではミオシンとともに筋肉の収縮を引き起こ
すが、筋肉以外の全ての細胞にも存在し、小胞輸送、形態形成、貪食など多様な細胞機能に関与している。アクチンを重合または脱重合する因子の働きにより機能が調節されて
いる。
注11) ミオシン
アクチン上を運動するモータータンパク質。多くの種類があり、筋収縮、細胞の運動、小胞輸送などの役割を担う。
注12) コフィリン
アクチン線維の切断、脱重合を引き起こすタンパク質。アクチン線維のターンオーバーを促進する。
細胞が細胞外から物質を取り込むこと。極性を持つ大きな分子は脂質二重層である細胞膜を通り抜けることができないため、細胞膜上の受容体に結合した形で細胞膜が細胞質内
に引き込まれたり、細胞外液ごと小胞内に取り込むことにより、物質が細胞内へ取り込まれる。
注2) エンドソーム
細胞内小胞の一つ。エンドサイトーシスによって細胞内へ取り込まれた物質の選別・輸送に関わる。形態的・機能的特徴から、初期エンドソーム、後期エンドソーム、リサイク
リングエンドソームに大別される。初期エンドソームは取り込んだ物質の仕分けを行い、後期エンドソームはリソソームと融合することにより内容物を分解に導く。リサイクリ
ングエンドソームは、一度取り込んだ物質を再び細胞外へ戻す。
注3) 細胞内小器官
真核生物の細胞内に存在する小胞体、ゴルジ体、ミトコンドリアなどの生体膜で区画された構造。タンパク質の合成・修飾やエネルギー産生などの役割を担う。いずれも生体膜
で覆われており、おのおのの細胞内小器官で必要な物質の交換は小胞輸送により行われる。
注4) リソソーム
物質の分解を行う細胞内小器官。膜に包まれた構造で、内部に多数の加水分解酵素を持ち、タンパク質、糖、脂質などを分解し、再利用に供する。
注5) 小胞輸送
細胞内で小胞を介して物質を輸送する仕組み。真核細胞内には細胞内小器官があり、各細胞内小器官で必要な物質は、脂質二重膜から成る小さな袋(小胞)に梱包して輸送され
る。細胞内小器官の膜から小胞が出芽し、細胞内を移動して別の細胞内小器官に融合することを繰り返して、細胞は物質を輸送する。2013年、米国の研究者3名がこの制御機構
を発見し、ノーベル生理学・医学賞を受賞した。
注6) 卵黄嚢
発生初期に胚を包んでいる膜構造。胚の外側に位置し母体組織に接している臓側卵黄嚢は、2層の細胞層から成る。外側の層にある臓側内胚葉細胞は、胎盤が完成するまでの間
母胎から胚へ栄養を供給し、内側の層にある中胚葉細胞では、体の中で最初に血液細胞が作られる。
注7) 同型融合と異型融合
後期エンドソーム同士の融合のように、同じタイプの小胞が融合することを同型融合と呼び、後期エンドソームがリソソームに融合するように、異なるタイプの小胞が融合する
ことを異型融合と呼ぶ。
注8) モータータンパク質
ATP加水分解のエネルギーを用いて細胞内で小胞輸送、細胞内小器官の移動、細胞の収縮、染色体の分離などの運動を担うタンパク質の総称。
注9) ゆらぎの力
ここでは、膜の変形を引き起こす力に相当する数理モデルにおける変数を指す。
注10) アクチン
細胞骨格を形成するタンパク質の一つであり、単量体の球状アクチンがらせん状につながって線維状アクチンを形成する。筋肉細胞ではミオシンとともに筋肉の収縮を引き起こ
すが、筋肉以外の全ての細胞にも存在し、小胞輸送、形態形成、貪食など多様な細胞機能に関与している。アクチンを重合または脱重合する因子の働きにより機能が調節されて
いる。
注11) ミオシン
アクチン上を運動するモータータンパク質。多くの種類があり、筋収縮、細胞の運動、小胞輸送などの役割を担う。
注12) コフィリン
アクチン線維の切断、脱重合を引き起こすタンパク質。アクチン線維のターンオーバーを促進する。
研究資金
本研究は、科研費による研究プロジェクト(17024006、JP22H04926)および武田科学振興財団研究助成の一環として実施されました。高解像度顕微鏡解析は、科研費「学術変革領域研究(学術研究支援基盤形成)」の「先端バイオイメージング支援プラットフォーム」の支援を受けて実施されました。
掲載論文
【題 名】 Actin dynamics switches two distinct modes of endosomal fusion in yolk sac visceral endoderm cells
(アクチンのダイナミクスが卵黄嚢臓側内胚葉細胞における2つの異なるエンドソーム融合様式を切り替える)
【著者名】 Seiichi Koike1,2,3, Masashi Tachikawa4,5, Motosuke Tsutsumi6,7, Takuya Okada1,2, Tomomi Nemoto6,7, Kazuko Keino-Masu1,2, Masayuki Masu1,2
1Graduate School of Comprehensive Human Sciences, University of Tsukuba
2Department of Molecular Neurobiology, Institute of Medicine, University of Tsukuba
3Laboratory of Molecular and Cellular Biology, Graduate School of Science and Engineering for Research, University of Toyama
4Graduate School of Nanobioscience, Yokohama City University
5PRESTO, Japan Science and Technology Agency
6Exploratory Research Center on Life and Living Systems (ExCELLS), National Institutes of Natural Sciences
7National Institute for Physiological Sciences, National Institutes of Natural Sciences
【掲載誌】 eLife
【掲載日】 2024年3月18日(オンライン先行公開)
【DOI】 10.7554/eLife.95999
(アクチンのダイナミクスが卵黄嚢臓側内胚葉細胞における2つの異なるエンドソーム融合様式を切り替える)
【著者名】 Seiichi Koike1,2,3, Masashi Tachikawa4,5, Motosuke Tsutsumi6,7, Takuya Okada1,2, Tomomi Nemoto6,7, Kazuko Keino-Masu1,2, Masayuki Masu1,2
1Graduate School of Comprehensive Human Sciences, University of Tsukuba
2Department of Molecular Neurobiology, Institute of Medicine, University of Tsukuba
3Laboratory of Molecular and Cellular Biology, Graduate School of Science and Engineering for Research, University of Toyama
4Graduate School of Nanobioscience, Yokohama City University
5PRESTO, Japan Science and Technology Agency
6Exploratory Research Center on Life and Living Systems (ExCELLS), National Institutes of Natural Sciences
7National Institute for Physiological Sciences, National Institutes of Natural Sciences
【掲載誌】 eLife
【掲載日】 2024年3月18日(オンライン先行公開)
【DOI】 10.7554/eLife.95999
お問い合わせ先
横浜市立大学広報担当
mail:koho@yokohama-cu.ac.jp
mail:koho@yokohama-cu.ac.jp

