がん細胞の遊走に関わるブレブの形成機構の解明
ーCaMKIIによる「浸透圧駆動型膜変形機構(CODE)」の発見
ポイント
- がん細胞が体内を移動する際に用いる膜突出構造「ブレブ」において、従来知られていなかった浸透圧を駆動力とする新しい拡大機構を明らかにしました。
- これまでもっぱら酵素として考えられてきた「Ca²⁺/カルモジュリン依存性プロテインキナーゼII(CaMKII)」が生み出す浸透圧によってブレブの拡大が起こることを見出しました。
- 研究グループが「CaMKII-based Osmotically-driven Deformation(CODE)」と命名した上記の仕組みは、がん浸潤・転移機構のみならず、発生や神経細胞の活動といった幅広い生命現象の理解への足がかりとなることが期待されます。
概要
私たちのからだを構成する細胞は、状況に応じて形を変えながら移動する能力を持っています。がん細胞が体内を移動・浸潤する際には、ブレブと呼ばれる球状の細胞膜突出を形成し、他の細胞などとの接着に依存しないアメーバ様の遊走を行います。しかし、ブレブがどのような仕組みで拡大するのか、その分子機構は未解明でした。
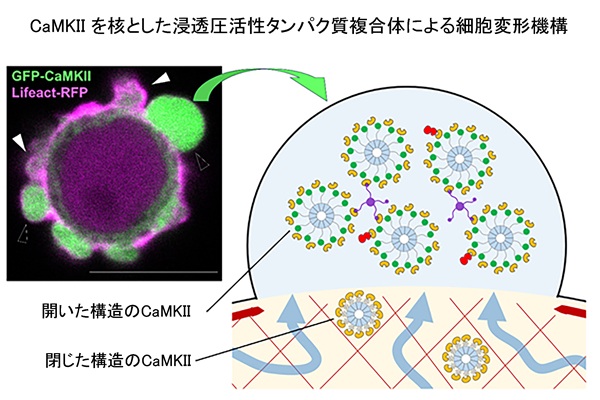
横浜市立大学大学院生命ナノシステム科学研究科の境祐二特任准教授、および九州大学大学院医学研究院生化学分野の池ノ内順一教授、同大学院システム生命科学府博士課程の藤井悠貴らの研究グループは、がん細胞の遊走に関わるブレブ拡大が、従来とは異なる原理によって制御されていることを明らかにしました。本研究では、拡大期のブレブ内部で細胞内カルシウム濃度が上昇し、それに応答して、「Ca²⁺/カルモジュリン依存性プロテインキナーゼII(CaMKII)」が集積することを見出しました。CaMKIIは従来キナーゼ(酵素)として機能すると考えられてきましたが、本研究により、キナーゼ活性に依存せず巨大なタンパク質複合体を形成し、その局所的な蓄積によって生じる浸透圧差がブレブ拡大を直接駆動することが示されました。
研究グループは、この新しい膜変形機構を「CaMKII-based Osmotically-driven Deformation(CODE)」と命名しました。本成果は、がん細胞の高速な移動や浸潤の分子基盤に新たな視点を与えるとともに、CaMKIIを細胞質の物性を制御する構造因子として再定義するものです。
本研究成果は、2026年2月3日付で科学論文誌『The EMBO Journal』に掲載されました。
横浜市立大学大学院生命ナノシステム科学研究科の境祐二特任准教授、および九州大学大学院医学研究院生化学分野の池ノ内順一教授、同大学院システム生命科学府博士課程の藤井悠貴らの研究グループは、がん細胞の遊走に関わるブレブ拡大が、従来とは異なる原理によって制御されていることを明らかにしました。本研究では、拡大期のブレブ内部で細胞内カルシウム濃度が上昇し、それに応答して、「Ca²⁺/カルモジュリン依存性プロテインキナーゼII(CaMKII)」が集積することを見出しました。CaMKIIは従来キナーゼ(酵素)として機能すると考えられてきましたが、本研究により、キナーゼ活性に依存せず巨大なタンパク質複合体を形成し、その局所的な蓄積によって生じる浸透圧差がブレブ拡大を直接駆動することが示されました。
研究グループは、この新しい膜変形機構を「CaMKII-based Osmotically-driven Deformation(CODE)」と命名しました。本成果は、がん細胞の高速な移動や浸潤の分子基盤に新たな視点を与えるとともに、CaMKIIを細胞質の物性を制御する構造因子として再定義するものです。
本研究成果は、2026年2月3日付で科学論文誌『The EMBO Journal』に掲載されました。
 研究者からひとこと:
研究者からひとこと:CaMKIIは細胞内に高濃度で存在するタンパク質ですが、これまで主に酵素として研究されてきました。本研究では、がん細胞のブレブ形成において、CaMKIIが酵素活性とは独立に浸透圧を生み出し、膜変形を直接駆動することを明らかにしました。本成果は、CaMKIIを細胞の物理的性質を制御する構造因子として捉え直す新しい視点を提示するものです。
(九州大学 池ノ内順一)
研究の背景と経緯
細胞は周囲の環境に応じて形を変えながら移動する能力を持っており、この性質は発生、免疫応答、組織修復など多くの生命現象に不可欠です。特にがん細胞は、周囲の細胞や細胞外基質との接着に依存せずに移動するアメーバ様遊走と呼ばれる運動様式を利用し、体内を浸潤・転移することが知られています。この運動様式の特徴の一つが、ブレブと呼ばれる球状の細胞膜突出構造の形成です。
ブレブは、細胞皮質を構成するアクトミオシン線維の収縮によって生じる細胞内圧により形成されると考えられてきました。しかし、ブレブ形成の中でも特に、短時間で急速に起こるブレブの拡大過程については、どのような分子機構によって制御されているのか、十分には理解されていませんでした。
池ノ内教授らの研究グループは以前の研究において、拡大期のブレブ内部が他の細胞質領域とは異なる特異な状態にあり、カルシウム濃度の上昇や、Menaをはじめとする特定の可溶性タンパク質が集積することを報告してきました(Aoki et al., Nature Communications, 2021)。しかし、これらの変化がブレブ拡大にどのように寄与しているのか、その因果関係は明らかではありませんでした。
研究グループは、拡大期ブレブ内部に特異的に集積する分子を探索する過程で、CaMKIIに着目しました。CaMKIIは神経細胞などで重要なシグナル分子として知られていますが、細胞内に構造タンパク質に匹敵する高い濃度で存在するという特徴も持っています。この点に注目し、CaMKIIが従来考えられてきた「酵素」としての役割以外の機能を担っている可能性を検証しました。
ブレブは、細胞皮質を構成するアクトミオシン線維の収縮によって生じる細胞内圧により形成されると考えられてきました。しかし、ブレブ形成の中でも特に、短時間で急速に起こるブレブの拡大過程については、どのような分子機構によって制御されているのか、十分には理解されていませんでした。
池ノ内教授らの研究グループは以前の研究において、拡大期のブレブ内部が他の細胞質領域とは異なる特異な状態にあり、カルシウム濃度の上昇や、Menaをはじめとする特定の可溶性タンパク質が集積することを報告してきました(Aoki et al., Nature Communications, 2021)。しかし、これらの変化がブレブ拡大にどのように寄与しているのか、その因果関係は明らかではありませんでした。
研究グループは、拡大期ブレブ内部に特異的に集積する分子を探索する過程で、CaMKIIに着目しました。CaMKIIは神経細胞などで重要なシグナル分子として知られていますが、細胞内に構造タンパク質に匹敵する高い濃度で存在するという特徴も持っています。この点に注目し、CaMKIIが従来考えられてきた「酵素」としての役割以外の機能を担っている可能性を検証しました。
研究の内容と成果
本研究では、がん細胞の遊走に関わるブレブ拡大の分子機構を明らかにするため、ブレブ形成中の細胞内で起こる分子動態と物理的変化を詳細に解析しました。その結果、ブレブが拡大している間、その内部で細胞内カルシウム濃度が一過的に上昇し、それに応答してCaMKIIが選択的に集積することを見出しました。CaMKIIはブレブ拡大期にのみ一過的に集積し、ブレブが退縮に転じると速やかに拡散することから、拡大過程と密接に関連していることが示されました。
機能解析の結果、CaMKIIはブレブ拡大に必須である一方、そのキナーゼ活性は必要でないことが明らかになりました。Ca²⁺上昇により構造変化を起こしたCaMKIIは、複数のタンパク質と結合して巨大なタンパク質複合体を形成します。この複合体は細胞質の網目構造を通過できないため、ブレブ内部に滞留します。この結果、ブレブ内部では局所的にタンパク質濃度が上昇し、浸透圧差が生じることで水分子の流入が促進され、ブレブの拡大が直接駆動されることが示されました。加えて研究グループは、定量イメージング解析および数理モデルを用いて、このタンパク質濃度差による浸透圧が、実際に観察されるブレブの大きさを説明できることを示しました。
さらに、このCaMKII依存的なブレブ拡大機構は、三次元環境下でアメーバ様に移動するがん細胞においても機能していることがわかりました。実際に移動する細胞に対してCaMKIIの構造活性化を阻害すると、ブレブ拡大および細胞遊走が著しく低下しました(参考図)。
研究グループは、このCaMKIIを核としたタンパク質複合体による浸透圧を駆動力とする膜変形機構を、「CaMKII-based Osmotically-driven Deformation(CODE)」と命名しました。本研究成果は、ブレブ形成を細胞内圧や皮質収縮のみで説明する従来のモデルを拡張し、細胞質の物理的性質が細胞運動を制御するという新たな概念を提示するものです。
機能解析の結果、CaMKIIはブレブ拡大に必須である一方、そのキナーゼ活性は必要でないことが明らかになりました。Ca²⁺上昇により構造変化を起こしたCaMKIIは、複数のタンパク質と結合して巨大なタンパク質複合体を形成します。この複合体は細胞質の網目構造を通過できないため、ブレブ内部に滞留します。この結果、ブレブ内部では局所的にタンパク質濃度が上昇し、浸透圧差が生じることで水分子の流入が促進され、ブレブの拡大が直接駆動されることが示されました。加えて研究グループは、定量イメージング解析および数理モデルを用いて、このタンパク質濃度差による浸透圧が、実際に観察されるブレブの大きさを説明できることを示しました。
さらに、このCaMKII依存的なブレブ拡大機構は、三次元環境下でアメーバ様に移動するがん細胞においても機能していることがわかりました。実際に移動する細胞に対してCaMKIIの構造活性化を阻害すると、ブレブ拡大および細胞遊走が著しく低下しました(参考図)。
研究グループは、このCaMKIIを核としたタンパク質複合体による浸透圧を駆動力とする膜変形機構を、「CaMKII-based Osmotically-driven Deformation(CODE)」と命名しました。本研究成果は、ブレブ形成を細胞内圧や皮質収縮のみで説明する従来のモデルを拡張し、細胞質の物理的性質が細胞運動を制御するという新たな概念を提示するものです。
今後の展開
本研究により、CaMKIIを核とするタンパク質複合体が、浸透圧を介して膜変形を直接駆動するという新しい細胞運動制御機構が明らかになりました。これは、細胞運動を主にシグナル伝達や細胞骨格制御として捉えてきた従来の理解に対し、細胞質の物理的性質そのものが運動を規定する重要な要素であることを示しています。
今後は、CODE機構ががん細胞に特有の現象なのか、あるいは他の細胞種や生体内のさまざまな組織環境においても普遍的に利用されているのかを明らかにすることが重要な課題となります。例えば、神経細胞においては、CaMKIIが樹状突起スパインの拡大やシナプス可塑性に重要な役割を果たすことが知られており、今回見出したCaMKIIによる構造変化や局所集積が、神経細胞における膜構造の形成・維持にも関与している可能性が考えられます。
また、CODE機構においてCaMKIIと協調して働く他のタンパク質の同定や、細胞質の物性変化をより精密に捉える解析を進めることで、細胞運動や形態変化を、シグナル伝達と物理的制御の両面から統合的に理解することができると期待されます。さらに、がん細胞の浸潤・転移において重要な役割を果たすアメーバ様遊走は、既存の抗がん治療では十分に抑制できない場合があることが知られていますが、本研究で示した細胞の力学的性質や物性制御に着目した視点が、従来とは異なる新たな治療戦略の基盤となる可能性があります。
以上のように、本成果を足がかりとして、細胞運動や形態変化を「力学」と「物性」の観点から統合的に理解する研究を進めることで、がん生物学のみならず、発生や再生といった幅広い生命現象の理解へと発展することが期待されます。
今後は、CODE機構ががん細胞に特有の現象なのか、あるいは他の細胞種や生体内のさまざまな組織環境においても普遍的に利用されているのかを明らかにすることが重要な課題となります。例えば、神経細胞においては、CaMKIIが樹状突起スパインの拡大やシナプス可塑性に重要な役割を果たすことが知られており、今回見出したCaMKIIによる構造変化や局所集積が、神経細胞における膜構造の形成・維持にも関与している可能性が考えられます。
また、CODE機構においてCaMKIIと協調して働く他のタンパク質の同定や、細胞質の物性変化をより精密に捉える解析を進めることで、細胞運動や形態変化を、シグナル伝達と物理的制御の両面から統合的に理解することができると期待されます。さらに、がん細胞の浸潤・転移において重要な役割を果たすアメーバ様遊走は、既存の抗がん治療では十分に抑制できない場合があることが知られていますが、本研究で示した細胞の力学的性質や物性制御に着目した視点が、従来とは異なる新たな治療戦略の基盤となる可能性があります。
以上のように、本成果を足がかりとして、細胞運動や形態変化を「力学」と「物性」の観点から統合的に理解する研究を進めることで、がん生物学のみならず、発生や再生といった幅広い生命現象の理解へと発展することが期待されます。
参考図
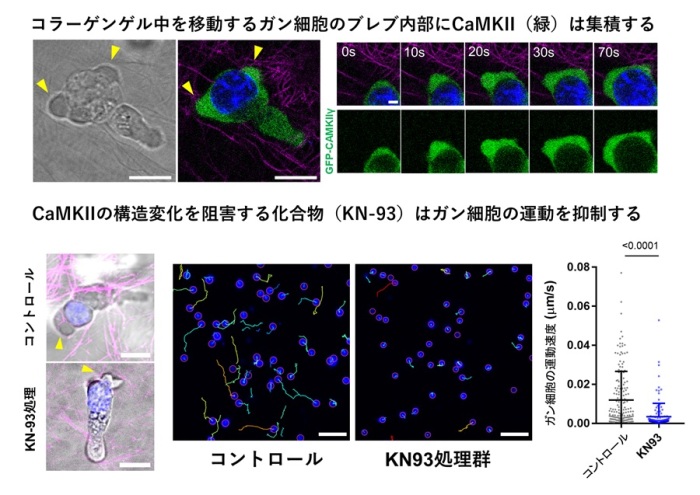

図 コラーゲンゲル中をアメーバ様に遊走するがん細胞におけるCaMKIIの局在と機能
ラット由来がん細胞であるWalker 256細胞をⅠ型コラーゲンゲル中で培養し、アメーバ様遊走を行っている細胞を観察しました。位相差像(左)および蛍光像(右)では、細胞前方に形成されたブレブ(黄色矢頭)の内部に、GFP標識CaMKIIγ(緑)が顕著に濃縮している様子が観察されます。核はNucBlue(青)、コラーゲン線維はマゼンタで示しています。右側のタイムラプス像(0–70秒)では、ブレブの拡大に伴ってCaMKIIがブレブ内部に集積し続ける様子が示されており、CaMKIIの局在がブレブ拡大過程と時間的に強く連動していることが分かります(上段)。Walker 256細胞を、CaMKIIの構造変化を阻害する阻害剤KN-93で処理すると、対照群と比較してブレブの形成および拡大が著しく抑制されました。(下段左)。核トラッキング解析により、コラーゲンゲル中を移動する細胞の運動軌跡を可視化しました。対照群では細胞が活発に移動しているのに対し、KN-93処理群では移動距離が短くなっており、遊走能が著しく低下していることが示されます(下段右)。これらの結果から、CaMKIIの構造活性化とブレブ内への集積が、三次元環境下におけるがん細胞のアメーバ様遊走に必須であることが示されました。
謝辞
本研究は、文部科学省 日本学術振興会 科学研究費(JP25H01325, JP25H00994, JP23K05715, JP24KJ1767)、科学技術振興機構 創発的研究若手挑戦事業(JPMJFR204L)等の支援を受けて行われました。
論文情報
掲載誌:The EMBO Journal.
タイトル:CaMKII nucleates an osmotic protein supercomplex to induce cellular bleb expansion
著者名:Yuki Fujii, Yuji Sakai, Kenji Matsuzawa, Junichi Ikenouchi
DOI:10.1038/s44318-026-00703-5
タイトル:CaMKII nucleates an osmotic protein supercomplex to induce cellular bleb expansion
著者名:Yuki Fujii, Yuji Sakai, Kenji Matsuzawa, Junichi Ikenouchi
DOI:10.1038/s44318-026-00703-5

