“スナップショット”解析によって核内構造体が形成されるメカニズムが明らかに抗体を用いたin situビオチン標識法による核内構造体のマルチオミクス解析
横浜市立大学大学院医学研究科 分子生物学の野口慶介さん(博士課程4年)、鈴木秀文講師、阿部 竜太共同研究員、高橋秀尚教授の研究グループは、東京工業大学生命理工学院生命理工学系の山口雄輝教授と共同して、抗体を用いたin situビオチン標識法*1を確立し、細胞の核内のさまざまな構造体について “スナップショットを撮る” ように構成因子を解析することを可能にしました。実際にこの技術を用いて、核内構造体の1つであるカハール体(Cajal body)*2について詳細な解析を行い、カハール体で転写された新生RNA鎖とRNA結合タンパク質との相互作用が、カハール体の形成に重要な役割を果たしている可能性を明らかにしました(図1) 。
本研究成果は、米科学誌「Cell Reports」に掲載されました(2024年9月15日オンライン公開)。
本研究成果は、米科学誌「Cell Reports」に掲載されました(2024年9月15日オンライン公開)。
研究成果のポイント
● 抗体を用いたin situビオチン標識法を確立し、核内構造体の構成因子を網羅的に同定することが可能になった。
● リン酸化のような翻訳後修飾を見分けて、近傍をビオチン化標識することが可能。
● カハール体の潜在的な構成因子が網羅的に同定され、カハール体形成の分子機構の一端が明らかになった。


研究背景
近年の研究により、液−液相分離(LLPS)*4によって形成される膜を持たない細胞内コンパートメントが、転写、RNAスプライシング*5、DNA修復など、多くの細胞内機能において重要な役割を果たしていることが明らかになってきました。LLPSによって作られる液滴には、天然変性領域と呼ばれる定まった構造をとらない領域を有するタンパク質が含まれており、これらのタンパク質や核酸(DNA、RNA)との間で弱い相互作用が生じることで、液滴が形成されると考えられています。核内構造体として知られる核小体やカハール体も液滴の性質を有することが知られています。核内構造体を含む液滴の機能を解明するためには、それを構成するタンパク質や核酸を網羅的に同定する必要があり、BioID(Proximity-dependent Biotin Identification)法やAPEX(Engineered Ascorbate Peroxidase)法*6など、これまでに核内構造体の構成因子をビオチン標識して質量分析計で同定する手法がいくつか開発されてきました。BioID法やAPEX法などの近傍ビオチン標識法を用いることで、従来の生化学的手法では解析が困難であった分子間の弱い相互作用を捉えることが可能となりました。しかしこれらの方法は、外来性の融合タンパク質を細胞に発現させる必要があることや、ビオチン標識に一定の時間を要するため、内在性のタンパク質の動的な相互作用の変化を捉えることを苦手としていました。第三の手法として、われわれや他の研究グループは抗体を用いたin situビオチン標識法を開発してきました。この方法では、パラホルムアルデヒドで固定した細胞を試料として、抗体を用いて目的タンパク質の近傍空間をビオチン標識するため、瞬間的な相互作用を捉えることが可能になると期待されていました。
研究内容
本研究グループでは、まず培養細胞をパラホルムアルデヒドで固定し、細胞膜の透過処理を施した後、免疫染色法と同様の方法で目的のタンパク質に対する1次抗体、そしてHRPを付加した2次抗体を反応させます。その後、細胞をビオチンチラミドおよびH2O2と培養することによって、目的タンパク質上に配置されたHRP周辺から半径約20 nmの近傍タンパク質を、細胞を崩すことなくin situでビオチン標識することができます(図2)。細胞を溶解してビオチン化タンパク質を精製し、質量分析計や次世代シーケンサーを用いてハイスループット解析することで、目的タンパク質と結合するゲノムDNA領域やノンコーディングRNAなどを網羅的に同定することが可能です。固定した細胞を用いることから、BioID法やAPEX法などの近傍ビオチン標識法と比べて、本手法では細胞内の分子間相互作用をスナップショットのように捉えること、細胞内の動的な相互作用の変化を解析することが可能となりました。また、特異的な抗体を用いることから、タンパク質の翻訳後修飾に特異的な空間ビオチン標識ができるという点も大きな強みです。われわれは抗体を用いたin situビオチン標識法を用いて、核内構造体である核小体やカハール体、さらに、DNA損傷刺激依存的なヒストンのリン酸化修飾によって形成されるγH2AX foci*7の構成因子の網羅的同定を行いました。
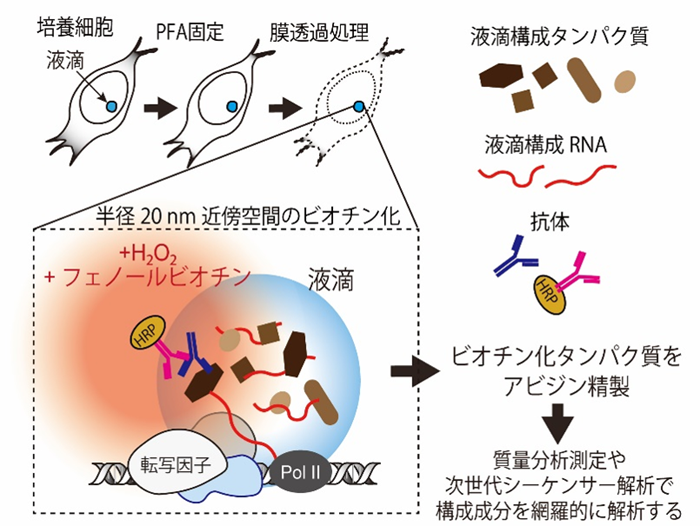

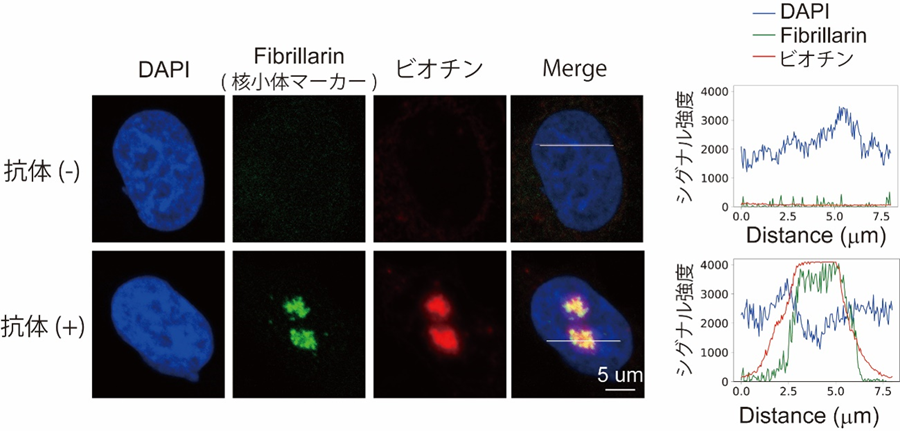

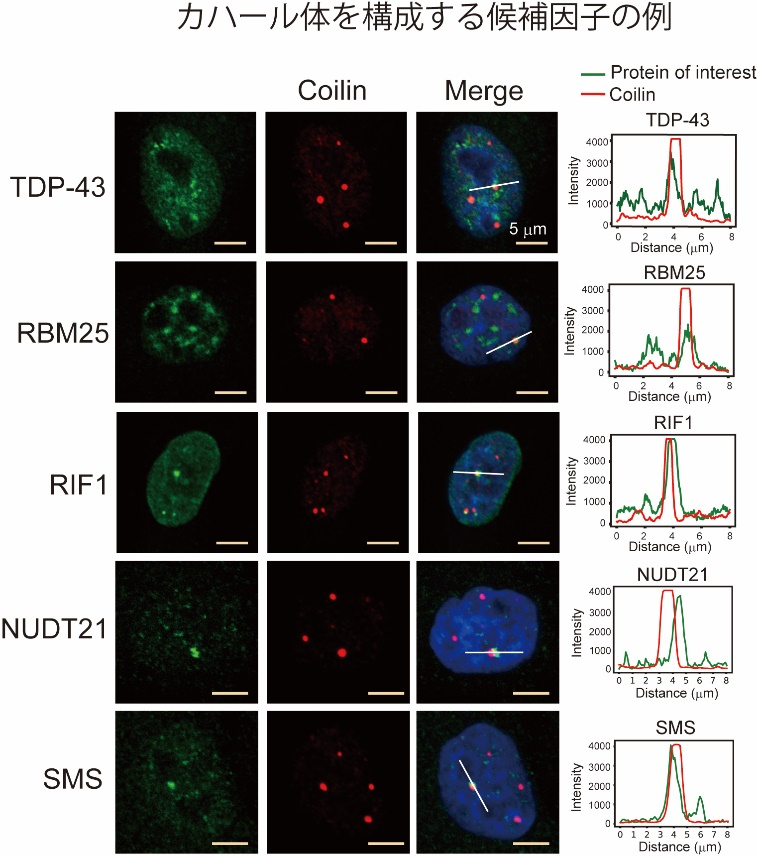
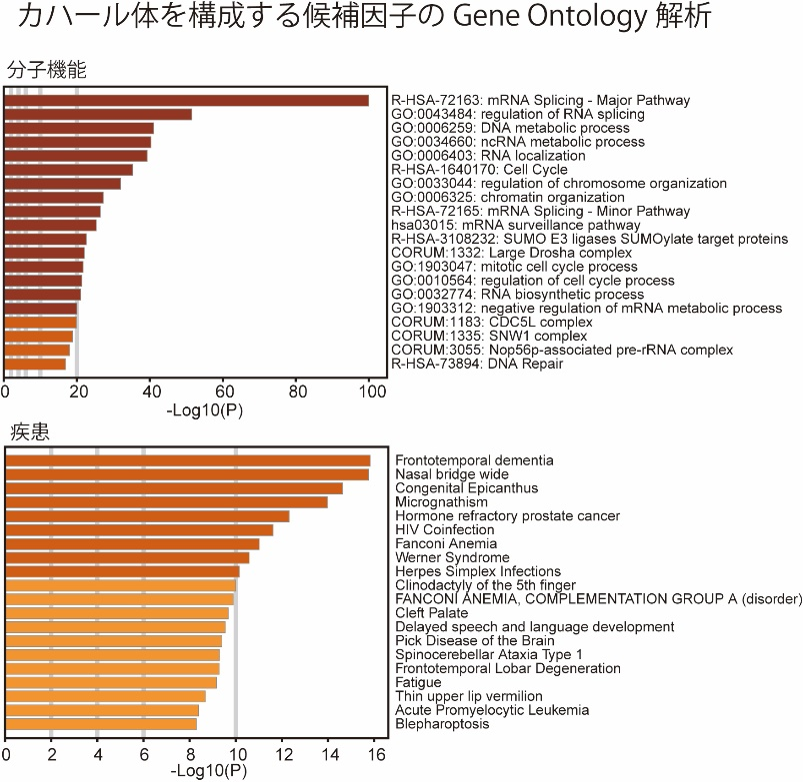
まず、本手法を用いて核小体、カハール体、γH2AX fociのin situビオチン標識を行なったところ、標的の核内構造体が特異的にビオチン標識できていることが確認できました(図2-1、 図2-2)。質量分析測定により、ビオチン標識された核内構造体の構成タンパク質を解析したところ、既知の構成因子に加え、多数の新規の候補因子が同定されました。例えば、カハール体のマーカータンパク質であるCoilinタンパク質に特異的な抗体を用いてカハール体のin situビオチン標識を行なったところ、既知の構成因子であるWD Repeat Containing Antisense to TP53(WRAP53)、Survival of Motor Neuron 1/2(SMN1/2)などに加えて、RNA結合モチーフタンパク質(RNA Binding Motif: RBM)やヘテロ核リボヌクレオタンパク質(Heterogeneous Nuclear Ribonucleoprotein: HNRNP)などの多くのRNA結合タンパク質が、カハール体を構成する候補因子として同定されました(図3)。さらに、同定されたRNA結合タンパク質の多くは、前頭側頭型認知症(Frontotemporal Dementia: FTD)または筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis: ALS)などの疾患に関連していることが明らかとなり、神経変性疾患とカハール体との関係性が示唆されるという興味深い結果が得られました


次に、in situビオチン標識されたタンパク質からゲノムDNAやRNAを精製して次世代シーケンサーによって解析することで、カハール体に存在するゲノムDNAとRNAを同定することを試みました。すると、カハール体が接しているゲノム領域として、多くの複製依存性ヒストン(Replication dependent histone: RDH)遺伝子や核内低分子RNA(small nuclear RNA: snRNA)遺伝子、そして一部のSmall Nucleolar RNA(snoRNA)遺伝子などが検出されました。カハール体に含まれるRNA分子としては、snRNAとSmall Cajal body-specific RNA (scaRNA) が検出された一方で、RDH遺伝子のmRNAやsnoRNAはほとんど検出されませんでした。これらの情報から、カハール体で転写されてボディ内に濃縮されるRNA、カハール体で転写されてボディ外に運び出されるRNA、そして、カハール体の外で転写されてボディ内に運び込まれるRNAなどに分類することができ、カハール体のRNAに関する機能的役割が明らかとなってきました(図4)。
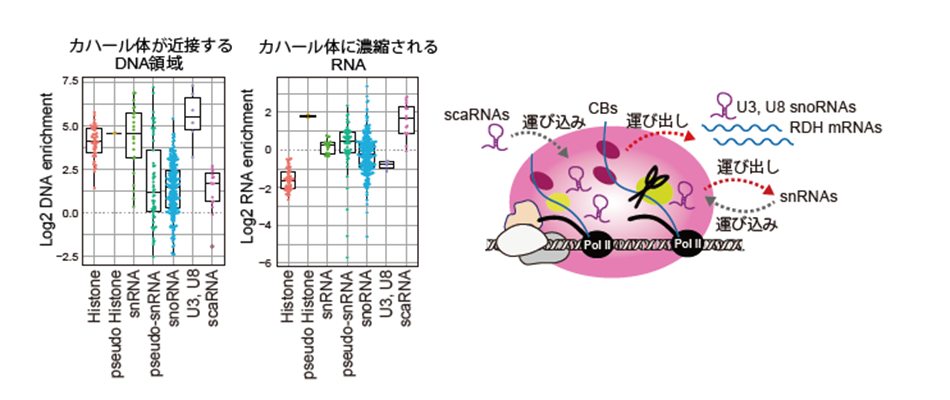

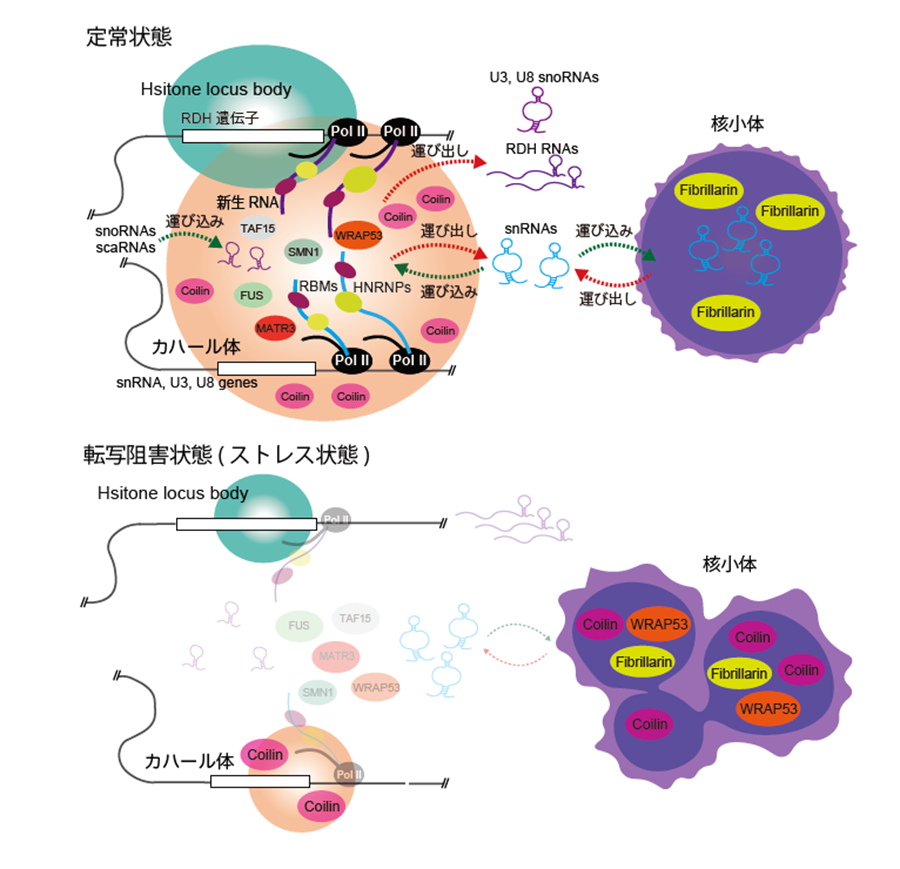
さらに、カハール体の形成と維持には、カハール体で転写されるsnRNAやRDH遺伝子の転写産物と、多くのRNA結合タンパク質との相互作用が重要であることも分かってきました。アクチノマイシンDなどの転写阻害剤で細胞を処理すると、短時間でカハール体が崩壊し、Coilinタンパク質が核小体に移行してしまう様子が観察されました。このときにCoilin抗体を用いたin situビオチン標識を行い、カハール体の構成因子の変化を調べました。
その結果、カハール体の構成因子が劇的に減少することが分かり、さらに、転写阻害時のストレス状況に特有のインタラクトームが検出されました。これらの結果から、カハール体の形成と維持には、カハール体における転写、すなわち新生RNA鎖の合成が必要であることが分かりました。以上のように、抗体を用いたin situビオチン標識手法を駆使したマルチオミクス解析を通して、転写産物とRNA結合タンパク質の相互作用によるカハール体の形成機構が明らかとなってきました(図5)。
その結果、カハール体の構成因子が劇的に減少することが分かり、さらに、転写阻害時のストレス状況に特有のインタラクトームが検出されました。これらの結果から、カハール体の形成と維持には、カハール体における転写、すなわち新生RNA鎖の合成が必要であることが分かりました。以上のように、抗体を用いたin situビオチン標識手法を駆使したマルチオミクス解析を通して、転写産物とRNA結合タンパク質の相互作用によるカハール体の形成機構が明らかとなってきました(図5)。

今後の展開
本研究グループでは、抗体を用いたin situビオチン標識法を確立し、核内のさまざまな構造体について“スナップショットを撮る”ように構成因子を解析する技術を開発しました。本手法は、特異性の高い良質な抗体があれば全ての内在性タンパク質に適用できるため、本手法を駆使することで未知の分子間相互作用が明らかにされると期待しています。また、既存の他の手法では、翻訳後修飾に特異的な空間ビオチン標識が不可能であったため、本手法によって翻訳後修飾特異的な新規のインタラクトーム(細胞内の分子間の相互作用)が明らかとなるはずです。さらに、本手法は理論上、組織切片試料のin situビオチン標識も可能です。病理検体のインタラクトーム解析に活用されることで、神経変性疾患の発症原因となる病的凝集体の構成因子や形成機構の解明にも役立てることができると期待しています。
用語説明
*1 in situビオチン標識法:in situビオチン標識法は、細胞や組織内で特定の分子(DNA、RNA、タンパク質など)を検出・可視化するための方法で、検出したい目的の分子にビオチン分子を化学的に結合させ標識する方法のことである。
*2 カハール体:1903年にSantiago Ramón y Cajalによって初めて報告された、膜をもたない核内構造体の1つ。snRNA遺伝子やRDH遺伝子領域近傍に頻繁に形成される。Coilinタンパク質はカハール体の足場タンパク質であると考えられており、カハール体のマーカータンパク質として用いられる。スプライシングに働くsnRNP(snRNAとタンパク質の複合体)の成熟の場である。
*3 HRP:Horseradish Peroxidaseの略語であり、西洋ワサビから抽出される酵素の1つである。この酵素は、酸化還元反応を触媒する活性を持っており、過酸化水素(H₂O₂)の分解を促進する。この性質を利用して、抗体にHRPを付加させると酵素反応によって発色や化学発光を引き起こすため、ウェスタンブロット法やELISA法などで特定のタンパク質や抗原を可視化するために用いられる。
*4 液−液相分離(LLPS):liquid-liquid phase separation。濃度の異なる2つの液相が分離する物理現象。分子間のファンデルワールス力によって特定の分子が集まることがLLPSの駆動力であると考えられている。分子内に天然変性領域をもつタンパク質は、LLPSによる凝集体を形成しやすい。
*5 RNAスプライシング:遺伝子から転写された未成熟なRNAから、不要なイントロンを取り除き、必要なエクソンをつなぎ合わせ、成熟したmRNA(メッセンジャーRNA)を合成する過程のことを指す。
*6 BioID法、APEX法:近傍ビオチン標識法の1種。BioID法では、大腸菌由来のビオチンリガーゼBirAに改変を加えた酵素(BirA*)を目的タンパク質に融合させることで、近傍をビオチン化する。APEX法では、大豆由来のアスコルビン酸ペルオシキダーゼを目的タンパク質に融合させ、ビオチンフェノールと H2O2存在化でビオチン化反応を起こす。
*7 γH2AX foci:γH2AX とは、139番目のセリンがリン酸化されたヒストンバリアントH2AXを指す。DNA損傷が起こると迅速にH2AXがリン酸化されてγH2AXとなり、核内ではγH2AXが凝集してDNA損傷修復のための場(γH2AX foci)が形成される。
*2 カハール体:1903年にSantiago Ramón y Cajalによって初めて報告された、膜をもたない核内構造体の1つ。snRNA遺伝子やRDH遺伝子領域近傍に頻繁に形成される。Coilinタンパク質はカハール体の足場タンパク質であると考えられており、カハール体のマーカータンパク質として用いられる。スプライシングに働くsnRNP(snRNAとタンパク質の複合体)の成熟の場である。
*3 HRP:Horseradish Peroxidaseの略語であり、西洋ワサビから抽出される酵素の1つである。この酵素は、酸化還元反応を触媒する活性を持っており、過酸化水素(H₂O₂)の分解を促進する。この性質を利用して、抗体にHRPを付加させると酵素反応によって発色や化学発光を引き起こすため、ウェスタンブロット法やELISA法などで特定のタンパク質や抗原を可視化するために用いられる。
*4 液−液相分離(LLPS):liquid-liquid phase separation。濃度の異なる2つの液相が分離する物理現象。分子間のファンデルワールス力によって特定の分子が集まることがLLPSの駆動力であると考えられている。分子内に天然変性領域をもつタンパク質は、LLPSによる凝集体を形成しやすい。
*5 RNAスプライシング:遺伝子から転写された未成熟なRNAから、不要なイントロンを取り除き、必要なエクソンをつなぎ合わせ、成熟したmRNA(メッセンジャーRNA)を合成する過程のことを指す。
*6 BioID法、APEX法:近傍ビオチン標識法の1種。BioID法では、大腸菌由来のビオチンリガーゼBirAに改変を加えた酵素(BirA*)を目的タンパク質に融合させることで、近傍をビオチン化する。APEX法では、大豆由来のアスコルビン酸ペルオシキダーゼを目的タンパク質に融合させ、ビオチンフェノールと H2O2存在化でビオチン化反応を起こす。
*7 γH2AX foci:γH2AX とは、139番目のセリンがリン酸化されたヒストンバリアントH2AXを指す。DNA損傷が起こると迅速にH2AXがリン酸化されてγH2AXとなり、核内ではγH2AXが凝集してDNA損傷修復のための場(γH2AX foci)が形成される。
研究費等
本研究は、AMED-PRIME(高橋秀尚:23gm6910006h0001)、JSPS科研費(高橋秀尚:17K19578、18H02378、19K22401、 21H05159、21H02405、21K19356、鈴木秀文: 20K15718、山口雄輝:20H03182)、ゲノム支援(221S0002)、先進ゲノム支援(16H06279)、武田科学振興財団、高松宮妃癌研究基金、中外創薬科学財団、金原一郎記念医学医療振興財団、日本白血病研究基金、小野がん研究助成基金、小林がん学術振興会、MSD生命科学財団、内藤記念科学振興財団、東京生化学研究会、上原記念生命科学財団、横浜総合医学振興財団、中谷医工計測技術振興財団、第一三共生命科学研究振興財団、先進医薬研究振興財団による研究助成、そしてJST科学技術イノベーション創出に向けた大学フェローシップ事業(野口慶介:JPMJFS2140)による支援を受けて実施されました。
また本研究は、横浜市立大学大学院医学研究科 分子生物学の堀内 恵子助教、秋山 智彦助教、池 陽子さん、小川 真太郎さん、東京大学アイソトープ総合センターの小野口(水谷)玲菜特任助教、秋光 信佳教授、横浜市立大学先端医科学研究センターの木村 弥生教授、井野 洋子助教、同大学院医学研究科 神経内科学の土井 宏准教授、田中 章景教授、国立感染症研究所 ウイルス第三部の梁明秀部長、国立遺伝学研究所 比較ゲノム解析研究室の豊田 敦特任教授、東京大学大学院新領域創成科学研究科 メディカル情報生命専攻生命システム観測分野の鈴木 穣教授のご協力を得て行われました。
また本研究は、横浜市立大学大学院医学研究科 分子生物学の堀内 恵子助教、秋山 智彦助教、池 陽子さん、小川 真太郎さん、東京大学アイソトープ総合センターの小野口(水谷)玲菜特任助教、秋光 信佳教授、横浜市立大学先端医科学研究センターの木村 弥生教授、井野 洋子助教、同大学院医学研究科 神経内科学の土井 宏准教授、田中 章景教授、国立感染症研究所 ウイルス第三部の梁明秀部長、国立遺伝学研究所 比較ゲノム解析研究室の豊田 敦特任教授、東京大学大学院新領域創成科学研究科 メディカル情報生命専攻生命システム観測分野の鈴木 穣教授のご協力を得て行われました。
論文情報
タイトル: Multi-omics analysis using antibody-based in situ biotinylation technique suggests the mechanism of Cajal body formation
著者: Keisuke Noguchi†, Hidefumi Suzuki†, Ryota Abe†, Keiko Horiuchi, Rena Onoguchi-Mizutani, Nobuyoshi Akimitsu, Shintaro Ogawa, Tomohiko Akiyama, Yoko Ike, Yoko Ino, Yayoi Kimura, Akihide Ryo, Hiroshi Doi, Fumiaki Tanaka, Yutaka Suzuki, Atsushi Toyoda, Yuki Yamaguchi*, and Hidehisa Takahashi*
† Equal contribution, * Corresponding authors
掲載雑誌: Cell Reports
DOI:10.1016/j.celrep.2024.114734
著者: Keisuke Noguchi†, Hidefumi Suzuki†, Ryota Abe†, Keiko Horiuchi, Rena Onoguchi-Mizutani, Nobuyoshi Akimitsu, Shintaro Ogawa, Tomohiko Akiyama, Yoko Ike, Yoko Ino, Yayoi Kimura, Akihide Ryo, Hiroshi Doi, Fumiaki Tanaka, Yutaka Suzuki, Atsushi Toyoda, Yuki Yamaguchi*, and Hidehisa Takahashi*
† Equal contribution, * Corresponding authors
掲載雑誌: Cell Reports
DOI:10.1016/j.celrep.2024.114734
お問合せ先
横浜市立大学 広報担当
mail: koho@yokohama-cu.ac.jp
mail: koho@yokohama-cu.ac.jp

