中枢神経系悪性腫瘍に対する 術中統合診断システム“i-ID”の開発に成功
横浜市立大学 大学院医学研究科 脳神経外科学教室 立石健祐准教授(主任研究員)、林貴啓大学院生、山本哲哉教授、同大学生命医科学研究科 創薬再生科学研究室、同大学附属病院病理部を中心とした研究グループは、中枢神経系悪性腫瘍が疑われた患者さんの腫瘍病変に対して手術中に病理診断と分子診断を行い、結果を迅速に統合化することで、検体採取からわずか90分で正確な診断が可能となるシステム“i-ID”(intraoperative-Integrated Diagnosis)を開発しました。
本システムは、術中の手術法の選択のみならず、術後の化学療法、放射線治療の早期導入につながるとともに、次世代の個別化医療に向けた基盤的検査ツールとなることが期待されます。本研究成果は、米国癌学会学術誌「Clinical Cancer Research」に掲載されました。(2023年10月18日オンライン)
本システムは、術中の手術法の選択のみならず、術後の化学療法、放射線治療の早期導入につながるとともに、次世代の個別化医療に向けた基盤的検査ツールとなることが期待されます。本研究成果は、米国癌学会学術誌「Clinical Cancer Research」に掲載されました。(2023年10月18日オンライン)

研究背景
成人の中枢神経系悪性腫瘍には様々な病気がありますが、中でもびまん性神経膠腫(グリオーマ)と原発性中枢神経系リンパ腫(PCNSL)は特に発生頻度が高いことが知られています。臨床的特徴および予後は様々ですが、グリオーマの中で最も悪性度の高い膠芽腫(グリオブラストーマ)とPCNSLの予後は不良であり、診断の遅れが治療成績と関連していることが報告されています。このことは、中枢神経系悪性腫瘍に対する迅速かつ正確な診断と、詳細な診断に基づく早期治療の重要性を意味します。
中枢神経系悪性腫瘍の診断として重要なのは、病気を評価するための手術による組織採取であり、加えてグリオーマでは神経学的機能を損なわない範囲での広範な腫瘍切除が推奨されます。これとは対照的に、PCNSLでは診断化に必要な最小限の生検術*1が推奨されます。このことは、術中レベルでの腫瘍の鑑別が、外科的戦略を含む迅速な治療方針の決定に重要であることを示すものです。術中の病理診断は、従来の組織形態学に基づく分類の時代には妥当な精度を示していました。しかし現在では、腫瘍のサブタイプの正確な鑑別には、組織学的診断と遺伝子変異等の分子診断を統合した診断が必要とされており、従来の中枢神経系腫瘍の術中病理診断法では診断精度に限界がありました。
分子診断は、手術や化学療法を含む個別化された治療戦略を検討するうえで重要な情報であり、世界保健機関により定められた最新の中枢神経系腫瘍分類(WHO CNS5)においても分子診断に基づく分類化が取り入れられています。遺伝子異常を標的とした分子標的治療法*2による病態制御も、特定の腫瘍に対する現実的な治療アプローチとなっています。また、術後の化学療法や放射線療法の効果が期待できるタイプの腫瘍では、病変が重要な脳機能領域に存在する場合は、大きな神経学的損傷を回避する外科的戦略も選択肢の一つとなります。従って、腫瘍の特徴を術中に即座に明確にすることは、オーダーメイドの治療戦略上、非常に重要な指標となり得ると考えました。しかしながら、手術中の迅速病理診断だけで遺伝子異常を予測することは極めて困難であるのが現状です。一方で分子診断は限られた施設でのみ施行可能であり、また解析に通常数日から数週間を要するため、早期からのオーダーメイド医療を進める上での課題となっていました。このことからも、迅速病理診断と迅速分子診断を組み合わせたシステムの開発が望まれていました。
本研究グループはこれまでに中枢神経系悪性腫瘍に対して、定量PCR(qPCR)ベースの遺伝子型判定システムを開発してきました。今回の研究では、迅速免疫組織化学検査(R-IHC)を含む迅速病理診断と遺伝子解析による分子診断を組み合わせることで、現在の腫瘍分類における腫瘍の特徴を明らかにできると仮説を立てました。この仮説検証のために、WHO CNS5基準下で成人悪性中枢神経系腫瘍の分類化の可能性を大規模な後方視的研究*3によって検証し、前方視的研究*4により確証化を図りました。そして本研究の結果をもとに、迅速病理診断と迅速分子診断を統合した画期的な術中統合診断システム“i-ID”を開発しました。
中枢神経系悪性腫瘍の診断として重要なのは、病気を評価するための手術による組織採取であり、加えてグリオーマでは神経学的機能を損なわない範囲での広範な腫瘍切除が推奨されます。これとは対照的に、PCNSLでは診断化に必要な最小限の生検術*1が推奨されます。このことは、術中レベルでの腫瘍の鑑別が、外科的戦略を含む迅速な治療方針の決定に重要であることを示すものです。術中の病理診断は、従来の組織形態学に基づく分類の時代には妥当な精度を示していました。しかし現在では、腫瘍のサブタイプの正確な鑑別には、組織学的診断と遺伝子変異等の分子診断を統合した診断が必要とされており、従来の中枢神経系腫瘍の術中病理診断法では診断精度に限界がありました。
分子診断は、手術や化学療法を含む個別化された治療戦略を検討するうえで重要な情報であり、世界保健機関により定められた最新の中枢神経系腫瘍分類(WHO CNS5)においても分子診断に基づく分類化が取り入れられています。遺伝子異常を標的とした分子標的治療法*2による病態制御も、特定の腫瘍に対する現実的な治療アプローチとなっています。また、術後の化学療法や放射線療法の効果が期待できるタイプの腫瘍では、病変が重要な脳機能領域に存在する場合は、大きな神経学的損傷を回避する外科的戦略も選択肢の一つとなります。従って、腫瘍の特徴を術中に即座に明確にすることは、オーダーメイドの治療戦略上、非常に重要な指標となり得ると考えました。しかしながら、手術中の迅速病理診断だけで遺伝子異常を予測することは極めて困難であるのが現状です。一方で分子診断は限られた施設でのみ施行可能であり、また解析に通常数日から数週間を要するため、早期からのオーダーメイド医療を進める上での課題となっていました。このことからも、迅速病理診断と迅速分子診断を組み合わせたシステムの開発が望まれていました。
本研究グループはこれまでに中枢神経系悪性腫瘍に対して、定量PCR(qPCR)ベースの遺伝子型判定システムを開発してきました。今回の研究では、迅速免疫組織化学検査(R-IHC)を含む迅速病理診断と遺伝子解析による分子診断を組み合わせることで、現在の腫瘍分類における腫瘍の特徴を明らかにできると仮説を立てました。この仮説検証のために、WHO CNS5基準下で成人悪性中枢神経系腫瘍の分類化の可能性を大規模な後方視的研究*3によって検証し、前方視的研究*4により確証化を図りました。そして本研究の結果をもとに、迅速病理診断と迅速分子診断を統合した画期的な術中統合診断システム“i-ID”を開発しました。
研究内容
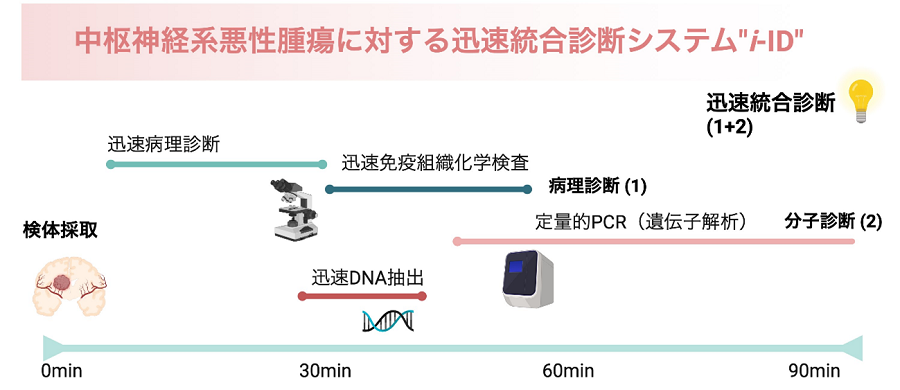
成人の中枢神経系悪性腫瘍が疑われた患者さんに対して手術にて病変を採取後、迅速病理診断による形態学的評価を行いました。加えて、症例に応じてGFAP抗体、CD20抗体を用いた迅速免疫組織化学検査を行いました。PCNSLは腫瘍細胞のCD20陽性かつGFAP陰性所見をもとに診断化を図りました。迅速病理診断にてグリオーマが疑われる症例については、迅速手法でDNAを抽出後、qPCRを用いたPNA-LNA法*5によるIDH1/2、TERT変異有無の判定、CDKN2Aコピー数変化を解析し、H3F3AとBRAF変異についても症例に応じて検討しました。“i-ID”はWHO CNS5基準に基づいて決定され、その信頼性を評価するために術後の統合診断結果(p-ID)と比較しました。
予備実験にて遺伝子解析手法の精度を検証した結果、検体内に1%以上の遺伝子変異が存在することで変異ありと判定可能であること、また高い精度をもってCDKN2A欠失を判定し得ることを見出しました。そこで153症例を対象として後方視的に検討を行いました。CD20陽性、GFAP陰性の免疫染色結果をもとに“i-ID”にてPCNSLと判定した症例は、p-IDとの完全一致が確認されました。グリオーマが疑われた症例では迅速病理所見とIDH1/2、TERT変異、CDKN2A欠失の評価により星細胞腫(アストロサイトーマ)、乏突起膠腫(オリゴデンドログリオーマ)、グリオブラストーマを高率に区分できることを見出しました。後方視的検討では145/153例 (94.8%)で“i-ID”とp-IDの一致が確認されました。
この結果をもとに診断アルゴリズムを作成し、本システムが実臨床でも運用可能であるか、前方視的に検証しました (図1)。病変採取から診断に要した時間は平均98分(標準誤差3分)でした。前方視的研究では101名の患者さんを対象にしました。PCNSL症例は“i-ID”において18/19 (94.7%)の高い精度で判定可能であり、グリオーマにおいては“i-ID”でのIDH1/2, TERT, BRAF, H3F3A, CDKN2A遺伝子異常の判定正診率はそれぞれ100%, 100%, 100%, 100%, 96.4%でした。後方視的検討と同様に、IDH1/2、TERT変異、CDKN2A欠失の評価の結果、アストロサイトーマ、オリゴデンドログリオーマ、グリオブラストーマの正診率はそれぞれ100%、100%、93%でした。グリオーマにおける診断精度は、迅速病理組織検討と迅速分子診断を組み合わせることでより高まることが判明し、80/82例 (97.6%)のグリオーマ症例で“i-ID”とp-IDが一致しました。前方視的検討では、全101症例中98例 (97.0%)で“i-ID”による正確な迅速統合診断が果たされました。
予備実験にて遺伝子解析手法の精度を検証した結果、検体内に1%以上の遺伝子変異が存在することで変異ありと判定可能であること、また高い精度をもってCDKN2A欠失を判定し得ることを見出しました。そこで153症例を対象として後方視的に検討を行いました。CD20陽性、GFAP陰性の免疫染色結果をもとに“i-ID”にてPCNSLと判定した症例は、p-IDとの完全一致が確認されました。グリオーマが疑われた症例では迅速病理所見とIDH1/2、TERT変異、CDKN2A欠失の評価により星細胞腫(アストロサイトーマ)、乏突起膠腫(オリゴデンドログリオーマ)、グリオブラストーマを高率に区分できることを見出しました。後方視的検討では145/153例 (94.8%)で“i-ID”とp-IDの一致が確認されました。
この結果をもとに診断アルゴリズムを作成し、本システムが実臨床でも運用可能であるか、前方視的に検証しました (図1)。病変採取から診断に要した時間は平均98分(標準誤差3分)でした。前方視的研究では101名の患者さんを対象にしました。PCNSL症例は“i-ID”において18/19 (94.7%)の高い精度で判定可能であり、グリオーマにおいては“i-ID”でのIDH1/2, TERT, BRAF, H3F3A, CDKN2A遺伝子異常の判定正診率はそれぞれ100%, 100%, 100%, 100%, 96.4%でした。後方視的検討と同様に、IDH1/2、TERT変異、CDKN2A欠失の評価の結果、アストロサイトーマ、オリゴデンドログリオーマ、グリオブラストーマの正診率はそれぞれ100%、100%、93%でした。グリオーマにおける診断精度は、迅速病理組織検討と迅速分子診断を組み合わせることでより高まることが判明し、80/82例 (97.6%)のグリオーマ症例で“i-ID”とp-IDが一致しました。前方視的検討では、全101症例中98例 (97.0%)で“i-ID”による正確な迅速統合診断が果たされました。
今後の展開
本研究では、WHO CNS5基準に従って悪性中枢神経系腫瘍を分類するために、迅速病理診断と迅速分子診断を統合した新しいシステム“i-ID”を確立しました。本システムは、腫瘍の病理組織像と遺伝子異常の特徴の迅速な提供が可能となり、術中病理組織学的診断のブレイクスルーにつながるものです。疫学的な点からも、本システムは日常臨床における成人悪性中枢神経系腫瘍の大部分をカバーできると考えられます。また、研究結果から、本システムが、最新の分類基準下での中枢神経系悪性腫瘍の統合診断を提供する実用的なツールであることが示されました。本システムの活用により、早期診断のみならず、集学的治療*6の早期立案をサポートすることが期待されます。例えば本システム導入で、手術中の個別的な外科治療方針の立案や、化学療法や放射線療法に対する早期治療介入が可能になることが予想されます。また、本システムは将来の個別化医療を実行するための基盤的な検査法への発展が期待されます。
研究費
本研究は、科学研究費助成事業 (基盤研究C 19K09488, 22K09210)、横浜市立大学第5期戦略的研究推進事業「研究開発プロジェクト」、横浜市立大学第4期学術的研究推進事業「YCU未来共創プロジェクト」、横浜市立大学学内先進支援事業 (29-110, 29-111)の支援を受けて実施されました。
論文情報
タイトル: Intraoperative integrated diagnostic system for malignant central nervous system tumors
著者:Takahiro Hayashi(筆頭著者), Kensuke Tateishi(責任著者), Shinichiro Matsuyama, Hiromichi Iwashita, Yohei Miyake, Akito Oshima, Hirokuni Honma, Jo Sasame, Katsuhiro Takabayashi, Kyoka Sugino, Emi Hirata, Naoko Udaka, Yuko Matsushita, Ikuma Kato, Hiroaki Hayashi, Taishi Nakamura, Naoki Ikegaya, Yutaro Takayama, Masaki Sonoda, Chihiro Oka, Mitsuru Sato, Masataka Isoda, Miyui Kato, Kaho Uchiyama, Tamon Tanaka, Toshiki Muramatsu, Shigeta Miyake, Ryosuke Suzuki, Mutsumi Takadera, Junya Tatezuki, Junichi Ayabe, Jun Suenaga, Shigeo Matsunaga, Kosuke Miyahara, Hiroshi Manaka, Hidetoshi Murata, Takaakira Yokoyama, Yoshihide Tanaka, Takashi Shuto, Koichi Ichimura, Shingo Kato, Shoji Yamanaka, Daniel P. Cahill, Satoshi Fujii, Ganesh M. Shankar, Tetsuya Yamamoto
掲載雑誌: Clinical Cancer Research
DOI:10.1158/1078-0432.CCR-23-1660
著者:Takahiro Hayashi(筆頭著者), Kensuke Tateishi(責任著者), Shinichiro Matsuyama, Hiromichi Iwashita, Yohei Miyake, Akito Oshima, Hirokuni Honma, Jo Sasame, Katsuhiro Takabayashi, Kyoka Sugino, Emi Hirata, Naoko Udaka, Yuko Matsushita, Ikuma Kato, Hiroaki Hayashi, Taishi Nakamura, Naoki Ikegaya, Yutaro Takayama, Masaki Sonoda, Chihiro Oka, Mitsuru Sato, Masataka Isoda, Miyui Kato, Kaho Uchiyama, Tamon Tanaka, Toshiki Muramatsu, Shigeta Miyake, Ryosuke Suzuki, Mutsumi Takadera, Junya Tatezuki, Junichi Ayabe, Jun Suenaga, Shigeo Matsunaga, Kosuke Miyahara, Hiroshi Manaka, Hidetoshi Murata, Takaakira Yokoyama, Yoshihide Tanaka, Takashi Shuto, Koichi Ichimura, Shingo Kato, Shoji Yamanaka, Daniel P. Cahill, Satoshi Fujii, Ganesh M. Shankar, Tetsuya Yamamoto
掲載雑誌: Clinical Cancer Research
DOI:10.1158/1078-0432.CCR-23-1660
用語説明
*1 生検術:病変の一部を採取し、顕微鏡などで詳しく調べる検査方法
*2 分子標的治療法:病気の原因となっている特定の分子のみ制御する治療法
*3 後方視的研究:既に行われた診療データを収集する研究
*4 前方視的研究:患者さんを登録の上、未来に向かって診療データを収集する研究
*5 PNA-LNA法:遺伝子変異を高感度に検出可能な解析方法
*6 集学的治療:外科療法(手術)、化学療法(抗がん剤)、放射線療法において、2つ以上の治療方法を組み合せて行う治療
*2 分子標的治療法:病気の原因となっている特定の分子のみ制御する治療法
*3 後方視的研究:既に行われた診療データを収集する研究
*4 前方視的研究:患者さんを登録の上、未来に向かって診療データを収集する研究
*5 PNA-LNA法:遺伝子変異を高感度に検出可能な解析方法
*6 集学的治療:外科療法(手術)、化学療法(抗がん剤)、放射線療法において、2つ以上の治療方法を組み合せて行う治療
お問合せ先
横浜市立大学 広報課
mail: koho@yokohama-cu.ac.jp
mail: koho@yokohama-cu.ac.jp

