UHRF1によるヌクレオソーム認識とヒストンH3ユビキチン化の構造基盤を解明
横浜市立大学大学院生命医科学研究科 構造生物学研究室(エピジェネティクス構造生命科学)有田恭平教授、敷町怜愛さん(2023年度修士課程修了)らの研究グループは、DNAメチル化*1維持に必須なE3ユビキチンリガーゼUHRF1*2が、ヌクレオソーム(DNAとヒストンの複合体)に結合し、ヌクレオソーム中のヒストンH3*3をユビキチン化*4する構造的しくみをクライオ電子顕微鏡*5(cryo-EM)により解明しました。本成果は、DNAメチル化の安定維持機構を分子レベルで理解するうえで重要な知見であり、がんをはじめとするエピジェネティック異常疾患の治療標的探索にも貢献することが期待されます。
本研究成果は、米国生化学・分子生物学会誌 Journal of Biological Chemistry 掲載されました(2025年11月4日オンライン公開 )。
研究成果のポイント
● DNAメチル化の維持にかかわるE3ユビキチンリガーゼUHRF1のTTDドメイン*6がヌクレオソームのacidic patchと相互作用することを発見した。● TTDとacidic patch相互作用はUHRF1による、効率的なヒストンH3のユビキチン化に寄与することが明らかとなった。

研究背景
哺乳類ゲノムの約70〜80%のCpGサイト中のシトシン塩基に起こる代表的なエピジェネティック修飾であるDNAメチル化は、遺伝子発現の抑制、転移因子のサイレンシング、X染色体不活性化、ゲノム安定性の維持に寄与します。DNA複製後には一過的に、新生鎖がメチル化されないヘミメチル化サイトが生じますが、その後、E3ユビキチンリガーゼUHRF1とDNAメチルトランスフェラーゼDNMT1が協働してメチル化パターンを再構築します。このDNA維持メチル化により、細胞は個体の生涯を通してその形質を維持し、正常に細胞増殖ができます。DNAメチル化の異常は、がん抑制遺伝子のサイレンシングやトランスポゾンの脱抑制によるゲノムの不安定化を起こし、がんなどの様々な疾患の発症に関与します。
UHRF1は、UBL, TTD, PHD, SRA, RINGの5つのドメインから構成され、SRAドメインがヘミメチル化DNAを認識する一方で、TTDおよびPHDはヒストンH3のN末端や9番目のリジンのメチル化状態(H3K9me3)を読み取ります。特に、UHRF1はH3K9me3を有するヌクレオソーム上でヒストンH3の複数のリジン残基をモノユビキチン化し(マルチプルモノユビキチン化)、その結果生じるユビキチン修飾がDNMT1のRFTSドメインに読み取られ、DNMT1はクロマチンに局在します。これまでの研究では「UHRF1がどのようにヌクレオソーム上のヒストンおよびDNAを同時に認識し、マルチプルモノユビキチン化を実行しているのか」という立体構造的機構は未解明でした。
UHRF1は、UBL, TTD, PHD, SRA, RINGの5つのドメインから構成され、SRAドメインがヘミメチル化DNAを認識する一方で、TTDおよびPHDはヒストンH3のN末端や9番目のリジンのメチル化状態(H3K9me3)を読み取ります。特に、UHRF1はH3K9me3を有するヌクレオソーム上でヒストンH3の複数のリジン残基をモノユビキチン化し(マルチプルモノユビキチン化)、その結果生じるユビキチン修飾がDNMT1のRFTSドメインに読み取られ、DNMT1はクロマチンに局在します。これまでの研究では「UHRF1がどのようにヌクレオソーム上のヒストンおよびDNAを同時に認識し、マルチプルモノユビキチン化を実行しているのか」という立体構造的機構は未解明でした。
研究内容
研究グループは、ヒストンH3 tailのメチル化修飾(H3K9me3)と、異なるDNA上の部位に片鎖のみがメチル化されたヘミメチル化CpGサイトを1か所持つヌクレオソームを3種類作成しました。これらのヌクレオソームとUHRF1複合体をクライオ電子顕微鏡(cryo-EM)を用いた単粒子解析(single-particle analysis)により、2.7~2.9 Åの分解能で再構成しました。
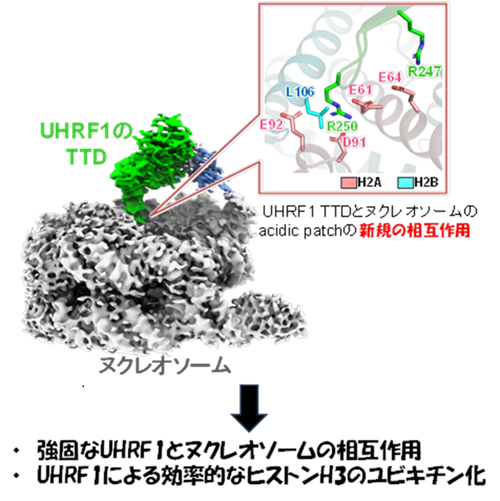
その結果、ヌクレオソーム表面にあるacidic patchに対し、UHRF1のTTD中のArg247およびArg250が入り込むアルギニンアンカーとして機能し、相互作用が形成されていることを見出しました。TTDドメインはこれまでH3K9me3修飾と結合することが知られていたが、UHRF1のTTDとヌクレオソームのacidic patchとの相互作用は、ヌクレオソームスケールでの複合体を観察したことによって初めて示された相互作用でした。また、UHRF1のアルギニンアンカーをアラニンに置換したTTD変異体では、UHRF1のヒストンH3 に対するユビキチン化活性が減少しました。これにより、acidic patchとの相互作用は、UHRF1による効率的なユビキチン化に寄与していることが明らかになりました。さらには、TTDのH3K9me3 結合領域とacidic patch相互作用領域は重複しないことから、TTDはH3 tailと結合した状態でacidic patchと相互作用していると考えられます。これによりH3 tailのflexibilityが低下し、UHRF1のH3 tailへのユビキチン化効率が上昇するというDNAメチル化部位とヒストン修飾情報を統合的に認識するUHRF1の全体的な空間配置モデルが提示されました。
その結果、ヌクレオソーム表面にあるacidic patchに対し、UHRF1のTTD中のArg247およびArg250が入り込むアルギニンアンカーとして機能し、相互作用が形成されていることを見出しました。TTDドメインはこれまでH3K9me3修飾と結合することが知られていたが、UHRF1のTTDとヌクレオソームのacidic patchとの相互作用は、ヌクレオソームスケールでの複合体を観察したことによって初めて示された相互作用でした。また、UHRF1のアルギニンアンカーをアラニンに置換したTTD変異体では、UHRF1のヒストンH3 に対するユビキチン化活性が減少しました。これにより、acidic patchとの相互作用は、UHRF1による効率的なユビキチン化に寄与していることが明らかになりました。さらには、TTDのH3K9me3 結合領域とacidic patch相互作用領域は重複しないことから、TTDはH3 tailと結合した状態でacidic patchと相互作用していると考えられます。これによりH3 tailのflexibilityが低下し、UHRF1のH3 tailへのユビキチン化効率が上昇するというDNAメチル化部位とヒストン修飾情報を統合的に認識するUHRF1の全体的な空間配置モデルが提示されました。
今後の展開
今回の研究により、UHRF1がヒストン修飾とDNAメチル化の橋渡しを行う際の立体構造的基盤が明らかになりました。特に、TTDとacidic patchの相互作用は、これまで想定されていなかったUHRF1の第4の結合モードであり、DNAメチル化の「維持シグナル」を効率よく生成するための新しい仕組みであると考えられます。
UHRF1やDNMT1の異常は、多くのがん細胞で観察されるDNAメチル化パターンの乱れと密接に関連しています。そのため、今回の構造情報は、UHRF1を標的とする新規エピジェネティック治療薬の設計においても重要な足がかりになると期待されます。
UHRF1やDNMT1の異常は、多くのがん細胞で観察されるDNAメチル化パターンの乱れと密接に関連しています。そのため、今回の構造情報は、UHRF1を標的とする新規エピジェネティック治療薬の設計においても重要な足がかりになると期待されます。
用語説明
*1 DNAメチル化:DNA中のシトシン塩基の5位の炭素にメチル基(CH3-)が付加されるα-ヘリックス反応。ヒトでは主にCG配列中のシトシン塩基がメチル化される。DNAメチル化により、遺伝子の発現が抑制されると考えられている。生物の体(多細胞の形質)を形成するために必須であり、DNAメチル化異常はがん化の原因の一つである。
*2 UHRF1:DNAメチル化維持に必須の役割をするユビキチン化酵素。片鎖メチル化DNAへの結合や、9番目のリジンがメチル化されたヒストンH3への結合、ヒストンH3や複製因子PAF15のユビキチン化など様々な機能を発揮することで、DNAメチル化パターンの複製を誘導する。がん細胞では過剰発現しており、異常な細胞増殖に関与する。
*3 ヒストンH3:ヌクレオソームを構成する5種類のヒストンタンパク質のうちの一つであり、ゲノムDNAを巻き付かせて核内に収納させる役割をもつ。ヒストンH3のN末端はメチル化やアセチル化などの化学修飾を受け、遺伝子発現の制御に関与する。
*4 ユビキチン化:基質となるタンパク質内の特定のリジン残基に、球状タンパク質であるユビキチンが共有結合で付加される翻訳後修飾。基質に付加されたユビキチンのリジン残基には、さらにユビキチンが数珠状に付加されることがあり、タンパク質分解をはじめシグナル伝達やDNA損傷修復などのタンパク質の機能を制御する。
*5 クライオ電子顕微鏡(クライオ電顕)単粒子解析法:タンパク質などの生体分子の立体構造を明らかにする手法の一つ。生体分子を急速に凍結させ、その状態を電子顕微鏡で観測する。単粒子解析法により、異なる向きから撮影された多数の粒子像をもとに3次元に再構成することで、生体分子の立体構造を明らかにする。2017年にノーベル化学賞を受賞した技術である。
*6 ドメイン:タンパク質の中に存在する構造単位で、その部分だけで安定した立体構造をとり、独立した機能を持つ。複数のドメインが組み合わさることで、タンパク質全体の多様な構造と機能が決まる。
*2 UHRF1:DNAメチル化維持に必須の役割をするユビキチン化酵素。片鎖メチル化DNAへの結合や、9番目のリジンがメチル化されたヒストンH3への結合、ヒストンH3や複製因子PAF15のユビキチン化など様々な機能を発揮することで、DNAメチル化パターンの複製を誘導する。がん細胞では過剰発現しており、異常な細胞増殖に関与する。
*3 ヒストンH3:ヌクレオソームを構成する5種類のヒストンタンパク質のうちの一つであり、ゲノムDNAを巻き付かせて核内に収納させる役割をもつ。ヒストンH3のN末端はメチル化やアセチル化などの化学修飾を受け、遺伝子発現の制御に関与する。
*4 ユビキチン化:基質となるタンパク質内の特定のリジン残基に、球状タンパク質であるユビキチンが共有結合で付加される翻訳後修飾。基質に付加されたユビキチンのリジン残基には、さらにユビキチンが数珠状に付加されることがあり、タンパク質分解をはじめシグナル伝達やDNA損傷修復などのタンパク質の機能を制御する。
*5 クライオ電子顕微鏡(クライオ電顕)単粒子解析法:タンパク質などの生体分子の立体構造を明らかにする手法の一つ。生体分子を急速に凍結させ、その状態を電子顕微鏡で観測する。単粒子解析法により、異なる向きから撮影された多数の粒子像をもとに3次元に再構成することで、生体分子の立体構造を明らかにする。2017年にノーベル化学賞を受賞した技術である。
*6 ドメイン:タンパク質の中に存在する構造単位で、その部分だけで安定した立体構造をとり、独立した機能を持つ。複数のドメインが組み合わさることで、タンパク質全体の多様な構造と機能が決まる。
研究費
本研究は、JSPS科研費(18H02392, 19H05294, 19H05741, 24K21950, 24K01967, 25H01301)をはじめ、横浜市立大学学長裁量事業 戦略的研究推進事業(SK201904)の助成、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)(JP23ama121009)の支援を受けて行われました。
論文情報
タイトル:Structural basis for E3 ubiquitin ligase UHRF1 binding to nucleosome core particle and histone H3 ubiquitination
著者:Reia Shikimachi, Shun Matsuzawa, Hiroki Onoda, Tsuyoshi Konuma, Atsushi Yamagata, Mikako Shirouzu, Kosuke Yamaguchi, Kyohei Arita
掲載雑誌:JBC
DOI:https://doi.org/10.1016/j.jbc.2025.110894
著者:Reia Shikimachi, Shun Matsuzawa, Hiroki Onoda, Tsuyoshi Konuma, Atsushi Yamagata, Mikako Shirouzu, Kosuke Yamaguchi, Kyohei Arita
掲載雑誌:JBC
DOI:https://doi.org/10.1016/j.jbc.2025.110894
お問合わせ先
横浜市立大学 広報担当
mail: koho@yokohama-cu.ac.jp
mail: koho@yokohama-cu.ac.jp

