多剤耐性細菌の出現に関わる性繊毛の構造を解明
(世界で初めて性繊毛の環状構造を原子レベルで解明)
横浜市立大学大学院生命医科学研究科 構造創薬科学研究室の石本直偉士助教(研究当時:Imperial College London所属)、Imperial College London, Konstantinos Beis教授、Gad Frankel教授、University of Virginia, Edward H. Egelmane教授らの共同研究グループは、細菌間で遺伝物質の伝達に関わるタンパク質Pilus(ピルス)の立体構造解析に成功しました。
本研究成果は、多剤耐性菌の出現や拡散のメカニズムの理解につながるとともに、これまで提唱されてきた環状Pilusの構造を近原子レベルで明らかにした最初の報告として、今後研究領域において環状化の議論を活性化させることが期待されています。
本研究成果は、「Proceedings of the National Academy of Sciences(PNAS)」誌に掲載されました(2025年4月17日)。
本研究成果は、多剤耐性菌の出現や拡散のメカニズムの理解につながるとともに、これまで提唱されてきた環状Pilusの構造を近原子レベルで明らかにした最初の報告として、今後研究領域において環状化の議論を活性化させることが期待されています。
本研究成果は、「Proceedings of the National Academy of Sciences(PNAS)」誌に掲載されました(2025年4月17日)。
研究成果のポイント
● 細胞間の接合に関わるタンパク質Pilusの立体構造を高分解能で解明。
● Pilusの環状構造を世界で初めて構造生物学的観点から解明、議論を行った。
● 多剤耐性菌の耐性獲得のメカニズムの理解を深める。
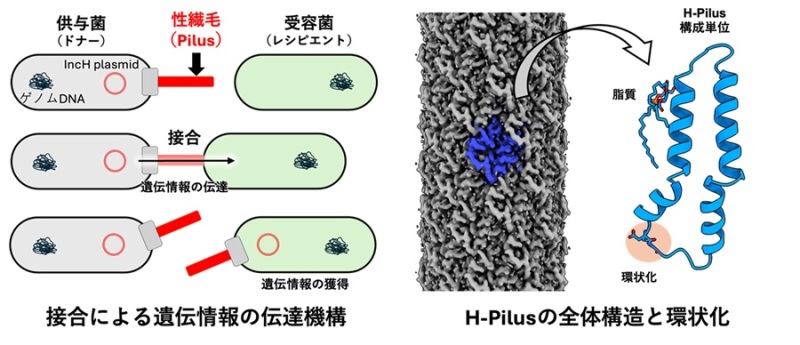

研究背景
細菌は「接合」と呼ばれる過程を通じて、抗生物質耐性遺伝子などの遺伝物質を直接別の細菌に伝達することができます。この過程で、細菌表面の「性繊毛」(または接合管)が細長い管状構造を形成します(図1)。この性繊毛を通じて耐性遺伝子を持たない細菌に遺伝物質を送り込みます。本研究の対象であるIncHプラスミド*1は、サルモネラ菌や大腸菌などの病原菌の間で広範囲の抗生物質耐性を伝播する重要な因子として知られています。特に近年、多剤耐性に関わるニューデリー・メタロ-βラクタマーゼ-1(NDM-1)遺伝子*2の拡散においてIncHプラスミドが重要な役割を果たしていることが報告されています[1]。IncHプラスミドの特徴として、22〜30℃の比較的低温で最も効率的に接合が行われ、ヒトの体温程では接合効率が大幅に低下することが知られていました。これは環境水や土壌中での耐性遺伝子の拡散が促進されることを示唆しています。
研究内容
本研究グループは、クライオ電子顕微鏡*3により、IncHプラスミド由来のH-Pilusの高分解能での構造解析に成功しました(図1, 2)。H-Pilusはこれまで報告されてきたPilusと同様のα-Helixとループから構成されていた一方で、構成単位のピリン(H-pilusの構成タンパク質:TrhA)はN末端とC末端が結合し環状化していることを明らかにしました(図1, 2b, c)。ピリンの環状化は質量分析を中心にこれまでも報告[2]されてきましたが、構造学的情報はありませんでした。本研究では、この環状化したピリンを世界ではじめて構造学的に明らかとし、質量分析、変異体実験からIncHプラスミドの伝搬においてピリンの環状化が重要であることを明らかとしました。
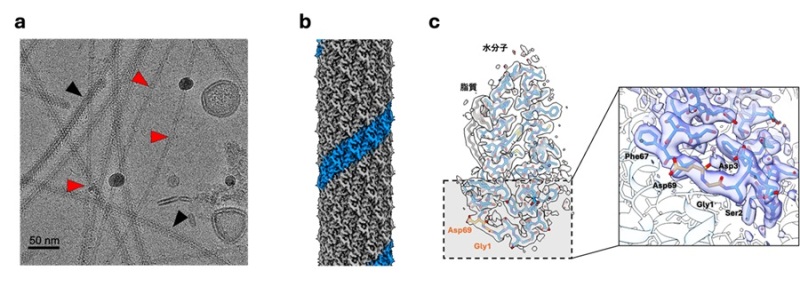

・H-Pilus TrhAの環状化とサブユニット間の相互作用
H-Pilusはピリンが螺旋状に配列した構造をとっており、各タンパク質分子に対しリン脂質が1つ結合した構造をとり、構造が安定化していることが明らかになりました。本研究における最も重要な発見は、H-Pilusの構成単位(TrhA)が「環状構造」を形成していることです。TrhAではN末端のグリシン(Gly1)とC末端のアスパラギン酸(Asp69)がペプチド結合を形成した環状構造になっており、質量分析からも環状構造が確認されました。さらに、TrhAは隣接するTrhAと複雑な相互作用を形成しており、アミノ酸の側鎖同士の相互作用やリン脂質を介した疎水的な相互作用、水分子を介した相互作用など様々な相互作用が明らかとなりました。環状部分に着目すると、24番目のリジン(Lys24)は隣接するTrhAの環状構造部分と相互作用することでPilusの構造を安定化させていました(図3)。
H-Pilusはピリンが螺旋状に配列した構造をとっており、各タンパク質分子に対しリン脂質が1つ結合した構造をとり、構造が安定化していることが明らかになりました。本研究における最も重要な発見は、H-Pilusの構成単位(TrhA)が「環状構造」を形成していることです。TrhAではN末端のグリシン(Gly1)とC末端のアスパラギン酸(Asp69)がペプチド結合を形成した環状構造になっており、質量分析からも環状構造が確認されました。さらに、TrhAは隣接するTrhAと複雑な相互作用を形成しており、アミノ酸の側鎖同士の相互作用やリン脂質を介した疎水的な相互作用、水分子を介した相互作用など様々な相互作用が明らかとなりました。環状部分に着目すると、24番目のリジン(Lys24)は隣接するTrhAの環状構造部分と相互作用することでPilusの構造を安定化させていました(図3)。
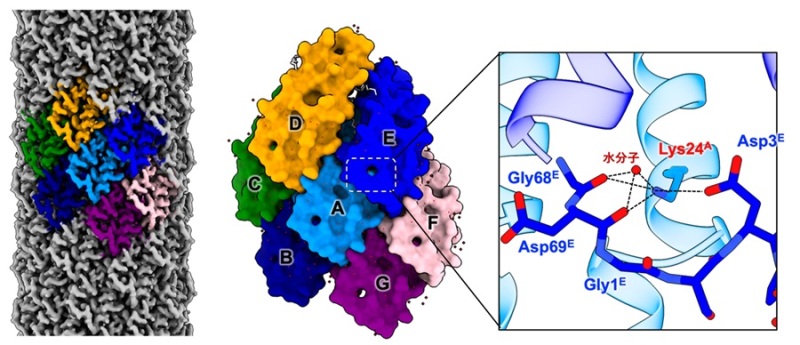

TrhAのLys24は隣接するTrhAの環状構造部分と水分子を含む相互作用ネットワークを形成していた。その他の領域でもTrhA間の相互作用やリン脂質含む相互作用があり、Pilusの構造安定化に寄与していた。
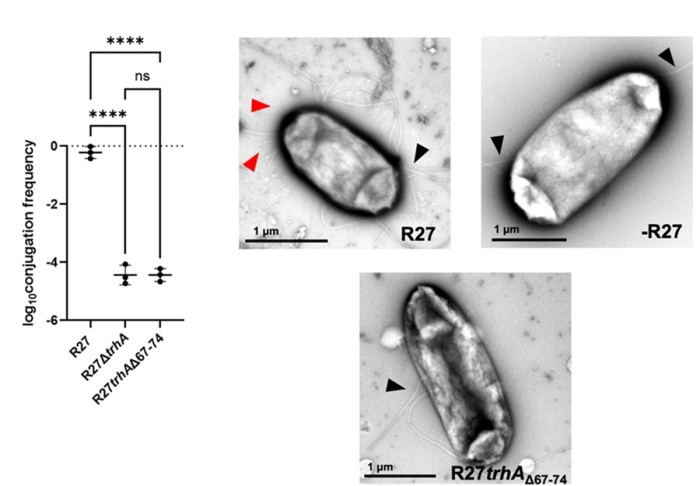
・H-Pilusの変異体を用いた接合効率の評価
変異体を用いてPilusの環状構造が性繊毛形成と接合効率にどのような影響を及ぼすか調べました。環状化に関わるH-pilusの末端部分を欠失させた変異体とH-pilusを欠損させた変異体では、性繊毛の形成が見られず、接合効率も大幅に低下しました(図4)。
変異体を用いてPilusの環状構造が性繊毛形成と接合効率にどのような影響を及ぼすか調べました。環状化に関わるH-pilusの末端部分を欠失させた変異体とH-pilusを欠損させた変異体では、性繊毛の形成が見られず、接合効率も大幅に低下しました(図4)。

今後の展開
本研究成果は、抗菌薬耐性遺伝子の拡散メカニズムの理解を深め、将来的には新しい抗菌戦略の開発に寄与することが期待されます。今後、環状構造を持つPilusの構造的な安定性が耐性遺伝子の効率的な拡散にどのように寄与するのか、議論を深めることにつながります。
研究費
本研究は内藤記念科学振興財団海外留学助成等の助成を受けて行われました。
論文情報
タイトル:Cryo-EM structure of the conjugation H-pilus reveals the cyclic nature of the TrhA pilin
著者:Naito Ishimoto, Joshua L. C. Wong, Shan Heb, Sally Shirranc, Olivia Wright-Paramio, Chloe Seddon, Nanki Singha, Carlos Balsalobred, Ravi R. Sonanie, Abigail Clements, Edward H. Egelmanee, Gad Frankel, and Konstantinos Beis
掲載雑誌:Proceedings of the National Academy of Sciences(PNAS)
DOI:10.1073/pnas.2427228122
著者:Naito Ishimoto, Joshua L. C. Wong, Shan Heb, Sally Shirranc, Olivia Wright-Paramio, Chloe Seddon, Nanki Singha, Carlos Balsalobred, Ravi R. Sonanie, Abigail Clements, Edward H. Egelmanee, Gad Frankel, and Konstantinos Beis
掲載雑誌:Proceedings of the National Academy of Sciences(PNAS)
DOI:10.1073/pnas.2427228122
用語説明
*1 プラスミド:大腸菌などの細菌や古細菌などの中に染色体DNAとは別に存在するDNA分子の総称。環状の二本鎖DNAで構成されており独立して複製が可能。宿主細胞の生存に関わる基本的な遺伝情報は含まないが、抗生物質耐性や接合に関わるタンパク質の遺伝情報を含むことで宿主に特性を与えることがある。
*2 ニューデリー・メタロ-βラクタマーゼ-1(NDM-1)遺伝子:2009年にインド旅行者から分離されたβラクタム剤を分解する酵素。βラクタム剤(ペニシリン系をはじめとした抗菌薬)は細菌の細胞壁の合成を阻害するが、βラクタマーゼを持つ細菌はこのβラクタム剤を分解することができる。中でもNDM-1は全てのβラクタム剤を分解することができることから、NDM-1の伝搬が抗菌薬の効かない細菌の出現につながるため、社会的脅威として注目されている。
*3 クライオ電子顕微鏡:タンパク質の構造解析に用いられる手法の1つ。調製した生体分子を急速凍結により極低温状態の氷の中に包埋した後、電子顕微鏡で観察する。得られた電子顕微鏡像から目的の生体分子の粒子像を切り出し、3次元に再構成することで立体構造を明らかにすることができる。
*2 ニューデリー・メタロ-βラクタマーゼ-1(NDM-1)遺伝子:2009年にインド旅行者から分離されたβラクタム剤を分解する酵素。βラクタム剤(ペニシリン系をはじめとした抗菌薬)は細菌の細胞壁の合成を阻害するが、βラクタマーゼを持つ細菌はこのβラクタム剤を分解することができる。中でもNDM-1は全てのβラクタム剤を分解することができることから、NDM-1の伝搬が抗菌薬の効かない細菌の出現につながるため、社会的脅威として注目されている。
*3 クライオ電子顕微鏡:タンパク質の構造解析に用いられる手法の1つ。調製した生体分子を急速凍結により極低温状態の氷の中に包埋した後、電子顕微鏡で観察する。得られた電子顕微鏡像から目的の生体分子の粒子像を切り出し、3次元に再構成することで立体構造を明らかにすることができる。
参考文献など
[1] M. Rozwandowicz et al., Plasmids carrying antimicrobial resistance genes in Enterobacteriaceae. J. Antimicrob. Chemother. 73, 1121–1137 (2018).
[2] R. Eisenbrandt et al., Conjugative pili of IncP plasmids, and the Ti plasmid T pilus are composed of cyclic subunits. J. Biol. Chem. 274, 22548–22555 (1999).
[2] R. Eisenbrandt et al., Conjugative pili of IncP plasmids, and the Ti plasmid T pilus are composed of cyclic subunits. J. Biol. Chem. 274, 22548–22555 (1999).
お問い合わせ先

