B型肝炎ウイルスが感染受容体に結合するしくみを解明
発表のポイント
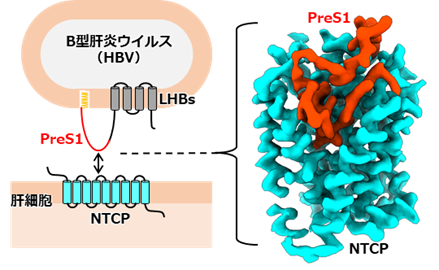
● B型肝炎ウイルスは肝細胞膜に存在する胆汁酸輸送体NTCPを受容体として利用し、肝細胞に感染することが知られています。本研究では、B型肝炎ウイルスのエンベロープタンパク質LHBsとNTCPの複合体のクライオ電子顕微鏡構造を解明しました。
● 構造解析、ウイルス感染試験、胆汁酸輸送試験により、LHBsのN末端preS1ドメインがNTCPの胆汁酸輸送経路を形成する膜貫通トンネルを塞ぐように複雑に折りたたまれて結合することを明らかにし、この結合がウイルス感染に重要であることを見出しました。
● NTCPを介したB型肝炎ウイルスの感染機構解明およびB型肝炎に対する新規治療薬の合理的設計に役立つと期待されました。

概要
横浜市立大学大学院生命医科学研究科の朴在鉉(パクジェヒョン)研究員、石本直偉士 大学院生、朴三用(パクサンヨン)教授、東京大学大学院薬学系研究科の浅見仁太 大学院生(研究当時)、清水敏之 教授、大戸梅治 准教授、京都大学大学院医学研究科の野村弥生 研究員、岩田想 教授、野村紀通 准教授、国立感染症研究所治療薬・ワクチン開発研究センターの小林ちさ 研究生(東京理科大学大学院創域理工学研究科 大学院生)、渡士幸一 治療薬開発総括研究官らの共同研究チームは、B型肝炎ウイルス感染初期にウイルスタンパク質が、肝細胞表面に存在する感染受容体である膜タンパク質NTCPに結合する様子をクライオ電子顕微鏡分析により可視化しました。
本研究成果は2024年1月17日付(英国時間:17日午前10時、日本時間:17日19時)でNature Structural & Molecular Biology ウェブサイトに掲載されました。
本研究成果は2024年1月17日付(英国時間:17日午前10時、日本時間:17日19時)でNature Structural & Molecular Biology ウェブサイトに掲載されました。
発表内容
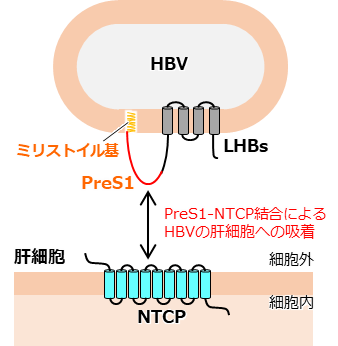
B型肝炎ウイルス(HBV)の感染は、世界の約2.9億人を苦しめる主要な公衆衛生問題です。慢性B型肝炎(注1)は肝硬変や肝細胞がんを引き起こし、年間約80万人が死亡しています。しかし、慢性B型肝炎を完治する効果的な治療法は未だ確立されていません。LHBsはHBVのウイルス表面に発現する膜タンパク質であり、そのN末端に存在するミリストイル化preS1ドメインが肝細胞の基底膜に発現し門脈血流から肝細胞への胆汁酸(注2)の取り込みを担う輸送体膜タンパク質Sodium-taurocholate co-transporting polypeptide(NTCP)と直接結合することで、HBVの肝細胞への吸着およびその後の感染が進行すると考えられています(図1)。PreS1が結合したNTCPの立体構造はこれまで解明されておらず、HBVによる肝細胞認識機構に関する構造学的知見は不十分でした。

本研究チームは、培養細胞で発現したヒトNTCPとミリストイル化preS1(2-48)ペプチドを混合し、NTCP-preS1複合体を精製することに成功しました。得られたNTCP-preS1複合体について、構造認識抗体Fab(注3)との複合体を調製し、東京大学のクライオ電子顕微鏡(注4)Titan Kriosを用いて立体構造を解明しました。構造解析の結果、NTCPとpreS1は1:1の比率で結合し、preS1が結合したNTCPは結合していない状態と類似した外開き構造をとっていました(図2)。NTCPへのpreS1の結合は広範な疎水性相互作用および水素結合により形成されていました。PreS1(2-48)のN末端側の約30残基はNTCPのトンネル領域にはまり込むように、一方C末端側の約20残基は細胞外側表面を這うように結合していました。PreS1は特定の立体構造をとっていないと考えられていましたが、NTCPトンネル内部で複雑に折りたたまれており、既知のウイルス-受容体結合とは異なる誘導適合モデル(注5)に従った結合様式をとることが明らかになりました。また、preS1のN末端には、ミリストイル基と思われる密度がNTCPの再構成された界面活性剤ミセル中に観測されました(図3)。このことから、ミリストイル基は宿主細胞膜に繋留されることで、preS1の結合を補強することが示唆されました。
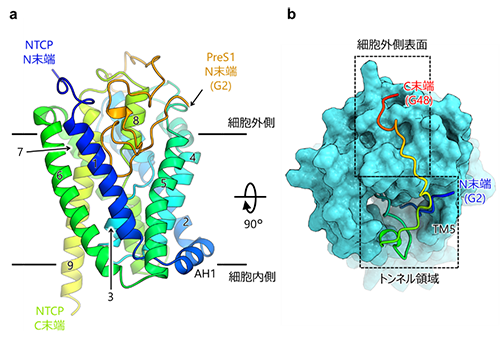

a. クライオ電子顕微鏡により決定されたNTCP-preS1複合体の立体構造。膜タンパク質であるNTCPの細胞外側にpreS1ペプチド(オレンジ)が結合する様子が可視化された。NTCPは外開き構造をとっていた。
b. NTCP-preS1複合体の立体構造を細胞外側から見た図。NTCPは表面図、preS1はカートゥーン図(N末端(青)-C末端(赤))で表示されている。PreS1のN末端側はNTCPのトンネル領域と主要な結合を形成し、C末端側は細胞外側表面を這うように結合していた。
b. NTCP-preS1複合体の立体構造を細胞外側から見た図。NTCPは表面図、preS1はカートゥーン図(N末端(青)-C末端(赤))で表示されている。PreS1のN末端側はNTCPのトンネル領域と主要な結合を形成し、C末端側は細胞外側表面を這うように結合していた。
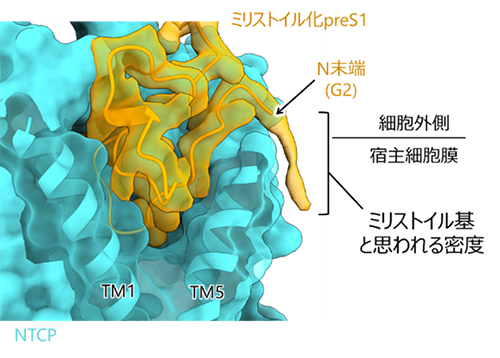

PreS1のN末端に修飾されたミリストイル基と思われる密度が観測された。この密度はNTCP近傍のミセル中に観測された。
構造解析および胆汁酸輸送試験の結果、preS1はNTCPの胆汁酸輸送経路を構成するトンネル領域を占有することで、胆汁酸の結合および輸送を競合的に阻害することが明らかになりました(図4)。NTCPのpreS1結合部位と胆汁酸結合部位の多くは共通していましたが、NTCPの細胞外側表面のループ領域や膜貫通ヘリックスTM8bの一部はpreS1との結合に関わるものの、胆汁酸の輸送経路には重ならないことが示唆されました(図5)。したがって、これらの領域を標的とした薬剤は、NTCPの胆汁酸輸送機能を維持しながら、preS1の結合のみを抑制できる可能性があり、今後の開発が期待されます。
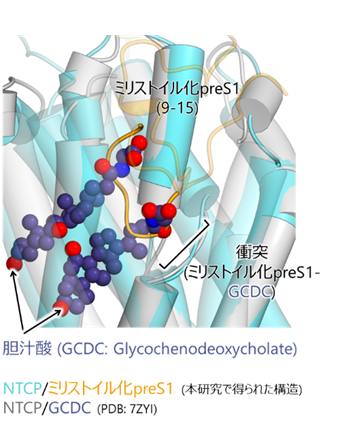

本研究で得られたNTCP-preS1複合体の構造と既報のNTCP-胆汁酸複合体の構造(PDB:7ZYI)の重ね合わせ。PreS1はNTCPの胆汁酸輸送経路を構成するトンネル領域を占有していた。
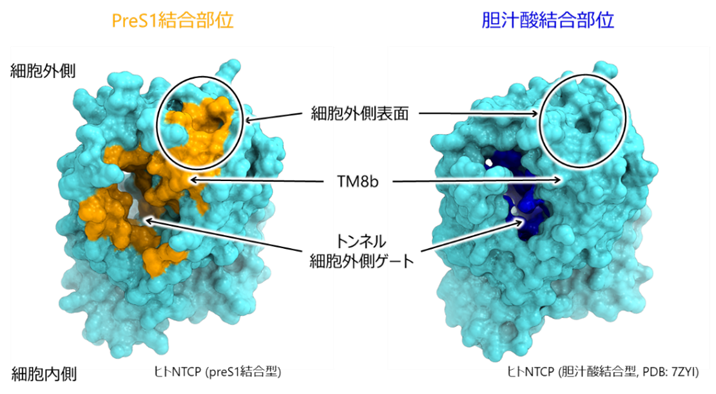

NTCPに対するpreS1結合部位(左)と胆汁酸結合部位(右、PDB:7ZYI)の比較。両者の結合部位はトンネル細胞外側ゲートで重なるが、細胞外側表面領域や膜貫通ヘリックスTM8bの一部はpreS1との結合のみに関与することが示唆された。PreS1結合のみに関わる領域は、副作用の少ない抗HBV薬の標的候補として有望である。
以上の結果より、HBVが外開き構造をとっているNTCPを標的とし、preS1をトンネル領域と強固に結合させることで、ウイルス粒子を肝細胞膜に近接させるというモデルが考えられます(図6)。
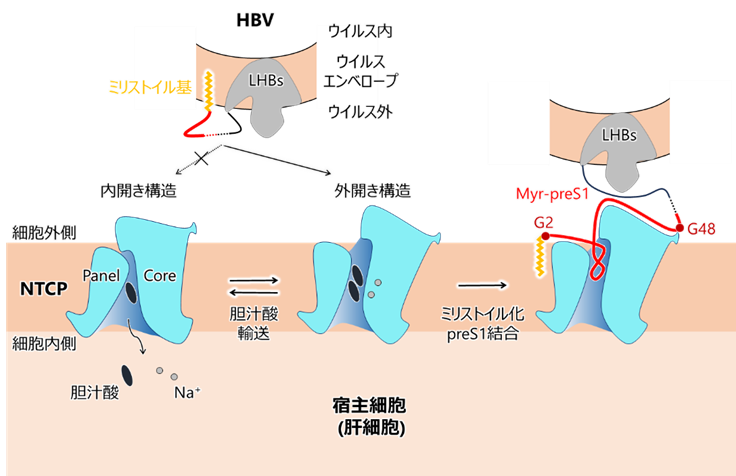

HBVは外開き構造をとっているNTCPを標的とし、ミリストイル化preS1をトンネル領域と強固に結合させることで、ウイルス粒子を宿主細胞膜に近接させる。この際、エンベロープに挿入されているミリストイル基は宿主細胞膜へと転移し、preS1の結合を補強すると考えられる。
本研究の成果は、HBVが肝細胞を認識するステップの詳細な構造基盤を提供するものです。また、今回明らかになったNTCPとpreS1の相互作用様式は他のウイルスでは報告のない誘導適合モデルに従うことから、ウイルスと宿主の多様な相互作用様式の一端を明らかにするものです。今後は、細胞表面に吸着したHBVがどのような分子機構で細胞内に侵入するのかについて、詳細に明らかにすることが求められます。
現在用いられている治療法では、慢性B型肝炎の患者に持続感染しているHBVを身体から完全に排除することは難しく、新規メカニズムに基づく抗HBV薬の開発が求められます。NTCPへの結合はHBV感染成立に必須のステップであることから、このステップはHBV感染を抑制する上で魅力的な創薬標的だと考えられます。本研究でHBVのpreS1と感染受容体NTCPの詳細な相互作用が可視化されたことで、preS1結合阻害薬を立体構造に基づいて合理的に設計することが期待されます。
現在用いられている治療法では、慢性B型肝炎の患者に持続感染しているHBVを身体から完全に排除することは難しく、新規メカニズムに基づく抗HBV薬の開発が求められます。NTCPへの結合はHBV感染成立に必須のステップであることから、このステップはHBV感染を抑制する上で魅力的な創薬標的だと考えられます。本研究でHBVのpreS1と感染受容体NTCPの詳細な相互作用が可視化されたことで、preS1結合阻害薬を立体構造に基づいて合理的に設計することが期待されます。
関連情報
「プレスリリース①B型肝炎ウイルス感染受容体であるヒト膜タンパク質の構造を解明」(2022/5/18)
https://www.u-tokyo.ac.jp/focus/ja/press/z0111_90020.html
https://www.u-tokyo.ac.jp/focus/ja/press/z0111_90020.html
発表者・研究者等情報
東京大学大学院薬学系研究科
大戸 梅治 准教授
清水 敏之 教授
浅見 仁太 研究当時:博士課程
京都大学大学院医学研究科
野村 紀通 准教授
岩田 想 教授
野村 弥生 研究員
横浜市立大学大学院生命医科学研究科
朴 三用(パク サンヨン) 教授
朴 在鉉(パク ジェヒョン) 研究員
石本 直偉士 博士課程
国立感染症研究所治療薬・ワクチン開発研究センター
渡士 幸一 治療薬開発総括研究官
小林 ちさ 研究生(東京理科大学大学院創域理工学研究科 大学院生)
大戸 梅治 准教授
清水 敏之 教授
浅見 仁太 研究当時:博士課程
京都大学大学院医学研究科
野村 紀通 准教授
岩田 想 教授
野村 弥生 研究員
横浜市立大学大学院生命医科学研究科
朴 三用(パク サンヨン) 教授
朴 在鉉(パク ジェヒョン) 研究員
石本 直偉士 博士課程
国立感染症研究所治療薬・ワクチン開発研究センター
渡士 幸一 治療薬開発総括研究官
小林 ちさ 研究生(東京理科大学大学院創域理工学研究科 大学院生)
論文情報
雑誌名:Nature Structural & Molecular Biology
題 名:Structural basis of hepatitis B virus receptor binding
著者名:Jinta Asami*, Jae-Hyun Park*, Yayoi Nomura*, Chisa Kobayashi*, Junki Mifune, Naito Ishimoto, Tomoko Uemura, Kehong Liu, Yumi Sato, Zhang Zhikuan, Masamichi Muramatsu, Takaji Wakita, David Drew, So Iwata, Toshiyuki Shimizu, Koichi Watashi†, Sam-Yong Park†, Norimichi Nomura†, Umeharu Ohto†
(*共同筆頭著者, †共同責任著者)
DOI: 10.1038/s41594-023-01191-5
URL: https://www.nature.com/articles/s41594-023-01191-5
題 名:Structural basis of hepatitis B virus receptor binding
著者名:Jinta Asami*, Jae-Hyun Park*, Yayoi Nomura*, Chisa Kobayashi*, Junki Mifune, Naito Ishimoto, Tomoko Uemura, Kehong Liu, Yumi Sato, Zhang Zhikuan, Masamichi Muramatsu, Takaji Wakita, David Drew, So Iwata, Toshiyuki Shimizu, Koichi Watashi†, Sam-Yong Park†, Norimichi Nomura†, Umeharu Ohto†
(*共同筆頭著者, †共同責任著者)
DOI: 10.1038/s41594-023-01191-5
URL: https://www.nature.com/articles/s41594-023-01191-5
研究助成
本研究は、文部科学省 科学研究費補助金(課題番号19H00976、20H03499、19H05779、21H02449、18K05334、19H00923、22H02556、23H02724)、AMED 肝炎等克服実用化研究事業(課題番号JP22fk0310517、JP23fk0310504)、創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号JP19am0101115(支援番号1570、1846、1848)、JP21am0101079)などの外部資金支援を受けて行われたものです。
用語解説
(注1)慢性B型肝炎
B型肝炎は、B型肝炎ウイルスが血液や体液等を介して感染して起きる肝臓の病気である。そのうち、6カ月以上持続している肝臓の炎症が慢性B型肝炎である。慢性B型肝炎患者の一部は肝硬変や肝細胞がんを発症する。
(注2)胆汁酸
肝臓でコレステロールから生合成されるステロイド化合物で、小腸からの脂肪の消化・吸収など脂質代謝に重要な役割を果たしている。回腸まで到達した胆汁酸の多くは腸管や肝臓に発現する胆汁酸トランスポーターの作用により再吸収され、腸肝循環を繰り返す。
(注3)Fab
抗体の重鎖のN末端領域と軽鎖からなる断片。タンパク質の構造解析においては、標的タンパク質の構造安定性の向上や解析時の目印となることを目的として利用されることがある。
(注4)クライオ電子顕微鏡
液体窒素で冷却された超低温条件下でタンパク質などの生体分子に対して電子線を照射し、試料の観察を行うための装置。X線結晶構造解析法やNMR法に並ぶタンパク質の立体構造解析手法の基盤技術として、近年急速な技術革新を遂げている。2017年には、その開発に貢献した研究者三名にノーベル化学賞が授与されている。
(注5)誘導適合モデル
タンパク質とそのリガンドを動的な存在と見なし、両者が相互作用しながら立体構造を変化させ、高親和性のタンパク質–リガンド複合体を形成するというモデル。
B型肝炎は、B型肝炎ウイルスが血液や体液等を介して感染して起きる肝臓の病気である。そのうち、6カ月以上持続している肝臓の炎症が慢性B型肝炎である。慢性B型肝炎患者の一部は肝硬変や肝細胞がんを発症する。
(注2)胆汁酸
肝臓でコレステロールから生合成されるステロイド化合物で、小腸からの脂肪の消化・吸収など脂質代謝に重要な役割を果たしている。回腸まで到達した胆汁酸の多くは腸管や肝臓に発現する胆汁酸トランスポーターの作用により再吸収され、腸肝循環を繰り返す。
(注3)Fab
抗体の重鎖のN末端領域と軽鎖からなる断片。タンパク質の構造解析においては、標的タンパク質の構造安定性の向上や解析時の目印となることを目的として利用されることがある。
(注4)クライオ電子顕微鏡
液体窒素で冷却された超低温条件下でタンパク質などの生体分子に対して電子線を照射し、試料の観察を行うための装置。X線結晶構造解析法やNMR法に並ぶタンパク質の立体構造解析手法の基盤技術として、近年急速な技術革新を遂げている。2017年には、その開発に貢献した研究者三名にノーベル化学賞が授与されている。
(注5)誘導適合モデル
タンパク質とそのリガンドを動的な存在と見なし、両者が相互作用しながら立体構造を変化させ、高親和性のタンパク質–リガンド複合体を形成するというモデル。
問い合わせ先
横浜市立大学 広報課
E-mail: koho@yokohama-cu.ac.jp
E-mail: koho@yokohama-cu.ac.jp

