公立大学法人横浜市立大学臨床研究審査委員会について
お知らせ
臨床研究法・臨床研究法施行規則の改正に伴う書式の変更について
臨床研究法・臨床研究法施行規則が改正されました(令和7年5月31日施行)。
それに伴い統一書式及び特研書式を改訂しました。
本ホームページにおける各種ご案内の一部は施行前の内容となっております。
準備が整い次第、順次施行後の内容へ更新予定です。
また、改正点については、以下をご確認ください。
それに伴い統一書式及び特研書式を改訂しました。
本ホームページにおける各種ご案内の一部は施行前の内容となっております。
準備が整い次第、順次施行後の内容へ更新予定です。
また、改正点については、以下をご確認ください。
概要
(1)設置者 : 公立大学法人 横浜市立大学
(2)名称 : 公立大学法人横浜市立大学臨床研究審査委員会
(英語表記:Yokohama City University Certified Institutional Review Board)
(3)所在地 : 神奈川県横浜市金沢区福浦3‐9
(4)認定日 : 平成30年3月30日
(5)認定番号 : CRB3180007
(6)担当地方厚生局 : 関東信越厚生局
(2)名称 : 公立大学法人横浜市立大学臨床研究審査委員会
(英語表記:Yokohama City University Certified Institutional Review Board)
(3)所在地 : 神奈川県横浜市金沢区福浦3‐9
(4)認定日 : 平成30年3月30日
(5)認定番号 : CRB3180007
(6)担当地方厚生局 : 関東信越厚生局
開催日程
※提出締切日は、委員会事務局による内容確認(COIの事実確認を含む)を受け、固定された申請書類を提出する期限となりますのでご注意ください。委員会事務局による内容確認を受ける場合は、各締切日の月初を目途にご提出願います。
※変更申請、定期報告、その他の審査書類の提出締切日は各新規申請書類提出締切日の概ね1週間後となります。
※申請の混み具合により、申請書類の提出締切日前であっても申請を受け付けられない場合があります。
2025年度・2026年度
| 開催日 | 申請書類(新規) 提出締切日 |
申請書類(変更等) 提出締切日 |
| 2026年4月2日(木) | 2026年2月12日(木) | 2026年2月18日(水) |
| 2026年5月7日(木) | 2026年3月11日(水) | 2026年3月18日(水) |
| 2026年6月4日(木) | 2026年4月1日(水) | 2026年4月8日(水) |
| 2026年7月2日(木) | 2026年4月30日(木) | 2026年5月7日(木) |
| 2026年8月6日(木) | 2026年6月3日(水) | 2026年6月10日(水) |
| 2026年9月3日(木) | 2026年7月1日(水) | 2026年7月8日(水) |
| 2026年10月1日(木) | 2026年7月29日(水) | 2026年8月5日(水) |
| 2026年11月5日(木) | 2026年9月2日(水) | 2026年9月9日(水) |
| 2026年12月3日(木) | 2026年9月30日(水) | 2026年10月7日(水) |
| 2027年1月7日(木) | 2026年11月4日(水) | 2026年11月11日(水) |
| 2027年2月4日(木) | 2026年12月2日(水) | 2026年12月9日(水) |
| 2027年3月4日(木) | 2027年1月4日(月) | 2027年1月6日(水) |
| 2027年4月1日(木) | 2027年1月27日(水) | 2027年2月3日(水) |
| 2027年5月6日(木) | 2027年3月3日(水) | 2027年3月10日(水) |
YCU CRB審査申請管理システム(臨床研究法)について
【利用対象者】
・横浜市立大学臨床研究審査委員会(CRB)に申請される方
・横浜市立大学にて特定臨床研究、非特定臨床研究を実施される方のうち、他施設が主施設として実施する研究に参加される方
・横浜市立大学臨床研究審査委員会(CRB)に申請される方
・横浜市立大学にて特定臨床研究、非特定臨床研究を実施される方のうち、他施設が主施設として実施する研究に参加される方
新規審査申請に必要な書類
新規審査を申請する場合は、以下の書類を作成の上、下記までご提出ください。
(1) 新規審査申請書(YCU CRBシステム入力により作成(統一書式 2)(参考))
(2) 統括管理者・研究責任医師の履歴書(参考書式4)
(3) 研究責任・分担医師リスト(統一書式 1(YCU書式))
(4) 実施計画(施行規則 様式第一) ※実施計画はjRCTに入力し一時保存したものを提出
(5) 研究計画書(ひな型はCRB事務局にお問い合わせください。)
(6) 説明文書・同意文書・同意撤回書(ひな型はCRB事務局にお問い合わせください。)
(7) 医薬品等の概要を記載した書類
(8) 疾病等が発生した場合の手順書
(9) モニタリング手順書
(10) 監査手順書(作成した場合)
(11) 統計解析計画書(作成した場合)
(12) 利益相反管理基準(様式A)・利益相反管理計画(様式E)(作成様式)
(13) 未承認又は適応外使用の医薬品等※を用いる特定臨床研究の 研究対象者負担の費用に関するチェックシート(作成様式)
※様式Eを作成するにあたって、利益相反自己申告書(様式C)記載内容の事実確認が必要となります。
横浜市立大学の場合、事実確認には概ね7日~10日を要しますので下記「利益相反管理計画」の項をご参照の上、お早めにご依頼ください。
【提出方法】
YCU CRB審査申請管理システムによりご提出ください。
(提出に関するお問合せ)
臨床研究審査委員会事務局
MAIL:ycu_crb"at"yokohama-cu.ac.jp (※「"at"」を「@」に変換してください。)
(1) 新規審査申請書(YCU CRBシステム入力により作成(統一書式 2)(参考))
(2) 統括管理者・研究責任医師の履歴書(参考書式4)
(3) 研究責任・分担医師リスト(統一書式 1(YCU書式))
(4) 実施計画(施行規則 様式第一) ※実施計画はjRCTに入力し一時保存したものを提出
(5) 研究計画書(ひな型はCRB事務局にお問い合わせください。)
(6) 説明文書・同意文書・同意撤回書(ひな型はCRB事務局にお問い合わせください。)
(7) 医薬品等の概要を記載した書類
(8) 疾病等が発生した場合の手順書
(9) モニタリング手順書
(10) 監査手順書(作成した場合)
(11) 統計解析計画書(作成した場合)
(12) 利益相反管理基準(様式A)・利益相反管理計画(様式E)(作成様式)
(13) 未承認又は適応外使用の医薬品等※を用いる特定臨床研究の 研究対象者負担の費用に関するチェックシート(作成様式)
※様式Eを作成するにあたって、利益相反自己申告書(様式C)記載内容の事実確認が必要となります。
横浜市立大学の場合、事実確認には概ね7日~10日を要しますので下記「利益相反管理計画」の項をご参照の上、お早めにご依頼ください。
【提出方法】
YCU CRB審査申請管理システムによりご提出ください。
(提出に関するお問合せ)
臨床研究審査委員会事務局
MAIL:ycu_crb"at"yokohama-cu.ac.jp (※「"at"」を「@」に変換してください。)
書式
審査意見業務を依頼する際は、下記の書式を利用して、申請等を行ってください。
統一書式(2025年5月31日改訂)
横浜市立大学 学内様式(特研書式)(2025年5月31日改訂)
- 定期報告書の提出に関する通知(特研書式6-2)※欠番

研究計画書その他ひな型
- 研究計画書(ひな型はCRB事務局へお問い合わせください。)
- 説明文書・同意文書・同意撤回書(ひな型はCRB事務局へお問い合わせください。)
厚生労働省医政局研究開発政策課「未承認又は適応外の医薬品等を用いる特定臨床研究における保険診療について」 (新規申請、定期報告は要提出)
利益相反管理計画
下記の様式(厚生労働省推奨様式) を利用して作成の上、「様式E」を申請書類と併せて委員会事務局へご提出下さい。
作成・申請までの流れは、下記の図のとおりです。
作成に当たっては、記入例を参照してください。
【流れ図】
作成・申請までの流れは、下記の図のとおりです。
作成に当たっては、記入例を参照してください。
【流れ図】
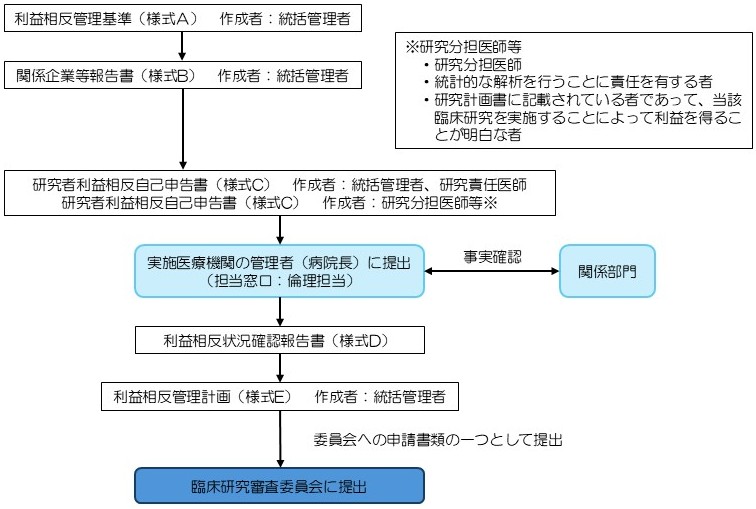
利益相反管理基準等作成様式
研究者利益相反自己申告書(様式C)の事実確認依頼先
研究者利益相反自己申告書(様式C)を作成した場合は、作成者の所属機関にて利益相反の事実確認を受けてください。
横浜市立大学の場合は、下記アドレスへ送信し、利益相反の事実確認をご依頼ください。
横浜市立大学の場合、利益相反の事実確認には概ね7日~10日を要します。事実確認完了後に利益相反管理計画(様式E)を作成することができるようになりますので、臨床研究審査委員会(CRB)への審査書類提出期限にご注意いただき、お早めに事実確認をご依頼ください。
【提出先】
臨床研究推進課 倫理担当
MAIL:ycu_coi"at"yokohama-cu.ac.jp (※「"at"」を「@」に変換してください。)
横浜市立大学の場合は、下記アドレスへ送信し、利益相反の事実確認をご依頼ください。
横浜市立大学の場合、利益相反の事実確認には概ね7日~10日を要します。事実確認完了後に利益相反管理計画(様式E)を作成することができるようになりますので、臨床研究審査委員会(CRB)への審査書類提出期限にご注意いただき、お早めに事実確認をご依頼ください。
【提出先】
臨床研究推進課 倫理担当
MAIL:ycu_coi"at"yokohama-cu.ac.jp (※「"at"」を「@」に変換してください。)
審査申請に伴う教育・研修について
現在、横浜市立大学では研究責任者、分担者、協力者等の臨床研究に携わる(予定を含む)全職員を対象に、臨床研究セミナーを実施しています。
横浜市立大学所属の研究者による臨床研究の申請(新規・変更申請)にあたっては、申請時点でAPRIN eラーニング(旧CITI)「医学研究者コース15単元」を修了し、かつ前年度分の臨床研究セミナーを180分以上受講していることを申請条件としています。
詳しくは「横浜市立大学人を対象とする生命科学・医学系研究倫理委員会」WEBサイト(学内専用)をご参照ください。
横浜市立大学所属の研究者による臨床研究の申請(新規・変更申請)にあたっては、申請時点でAPRIN eラーニング(旧CITI)「医学研究者コース15単元」を修了し、かつ前年度分の臨床研究セミナーを180分以上受講していることを申請条件としています。
詳しくは「横浜市立大学人を対象とする生命科学・医学系研究倫理委員会」WEBサイト(学内専用)をご参照ください。
審査手数料
当委員会に審査意見業務を依頼する場合、下記の表のとおり、審査料を徴収します。
臨床研究法施行前から継続している特定臨床研究の再審査に係る審査手数料についても、同様とします。
臨床研究法施行前から継続している特定臨床研究の再審査に係る審査手数料についても、同様とします。
| 区分 | 料金 (1件あたりにつき、消費税別) |
||
| 本学外の依頼者 | 本学内の依頼者 | ||
| 新規申請にかかる審査※1 | 実施計画に対する意見(委員会規程第21条) | 208,000円 | 41,000円 |
| 変更申請、疾病等の報告、定期報告、研究の中止及び終了の報告、その他の報告にかかる審査※2 | ・変更審査(委員会規程第21条) ・疾病等の報告に対する意見(委員会規程第22条) ・定期報告に対する意見(委員会規程第23条) ・新規・変更申請、定期報告、疾病等報告以外の報告に対す る意見 (委員会規程第24条) ・研究の中止及び終了の報告に対する意見(委員会規程第25条) |
50,000円 | 10,000円 |
| 簡便審査※3(委員会26条) | 35,000円 | 7,000円 | |
※1 多施設共同研究の場合、追加される施設数に12,000円(消費税別)を乗じた金額が加算される。但し、追加される施設に横浜市立大学が含まれる場合には横浜市立大学分は加算されない。
※2 変更申請において、施設の追加を伴う変更の場合、追加される施設数に12,000円(消費税別)を乗じた金額が加算される。但し、追加される施設に横浜市立大学が含まれる場合には横浜市立大学分は加算されない。また、1件の研究課題についての定期報告の審査を行う際に、当該研究課題の変更申請の審査も同時に行う場合においては、合わせて1件分の審査手数料を請求する。
※3 簡便審査のうち、事前確認不要事項に該当する申請については審査料は不要。
委員名簿
議事概要
規程等
お問い合わせ先
臨床研究審査委員会事務局
TEL:045-370-7627
MAIL:ycu_crb"at"yokohama-cu.ac.jp (※「"at"」を「@」に変換してください。)
TEL:045-370-7627
MAIL:ycu_crb"at"yokohama-cu.ac.jp (※「"at"」を「@」に変換してください。)