免疫学 田村智彦教授らの研究グループが、アレルギー疾患を引き起こす免疫細胞である好塩基球やマスト細胞の産生・分化の仕組みを解明!
2014.11.20
- TOPICS
- 研究
免疫学 田村智彦教授らの研究グループが、アレルギー疾患を引き起こす免疫細胞である好塩基球やマスト細胞の産生・分化の仕組みを解明!
~『Blood 』に掲載~
横浜市立大学大学院医学研究科 免疫学 佐々木 悠(大学院生)、黒滝大翼助教や田村智彦教授らの研究グループは米国国立衛生研究所・東京大学・大阪大学と共同で、転写因子IRF8が、アレルギー疾患を引き起こす免疫細胞である好塩基球・マスト細胞の分化において、重要な役割を果たすことを明らかにしました。本研究成果は米国の科学雑誌『Blood』(平成26年11月14日オンライン版)に掲載されました。
| ☆研究成果のポイント |
|---|
|
研究の背景
日本人のおよそ二人に一人は何らかのアレルギー疾患に罹患しており、それにより生活の質の著しい低下と多大な経済的損失がもたらされています。現在の治療法はほとんどが抗ヒスタミン薬やステロイドの投与など対症療法であり、より効果的な治療法が求められています。
アレルギーを引き起こす免疫細胞としてマスト細胞と好塩基球が知られています。マスト細胞(肥満細胞とも呼ばれる)は主に花粉症や食品アレルギーなどの即時型アレルギー反応を引き起こすことが良く知られています。もう一方の好塩基球は顆粒球の1つで、血中白血球の1%以下と少数ながら、最近の研究から気管支ぜんそくやアトピー性皮膚炎などに見られる慢性アレルギー炎症の発症に重要な役割があることがわかってきています。本研究グループでは、アレルギーを引き起こすこの二種類の細胞が体の中でどのように産生されるのかを明らかにすれば、これらの細胞の数を制御してアレルギー疾患を治療できる可能性があると考えて研究を進めてきました。
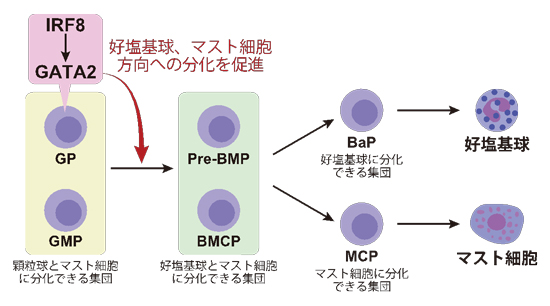
マスト細胞や好塩基球が骨髄で産生されるためには、造血幹細胞から顆粒球・単球やマスト細胞に分化できる顆粒球−単球前駆細胞(GMP)、顆粒球やマスト細胞に分化できる顆粒球前駆細胞(GP)、さらには好塩基球やマスト細胞にしか分化しない好塩基球−マスト細胞共通前駆細胞(Pre-BMPとBMCPが知られる)を経る必要があると考えられています(図1)。
Pre-BMPやBMCPの下流には好塩基球前駆細胞(BaP)とマスト細胞前駆細胞(MCP)が存在し、それぞれ好塩基球とマスト細胞を産生します。このように多段階の変化を伴う細胞の分化においては、転写因子と呼ばれるたんぱく質が遺伝子の発現を調節することが重要と考えられていますが、好塩基球やマスト細胞の分化・産生を調節する転写因子に関する理解はまだ不十分なのが現状です。
アレルギーを引き起こす免疫細胞としてマスト細胞と好塩基球が知られています。マスト細胞(肥満細胞とも呼ばれる)は主に花粉症や食品アレルギーなどの即時型アレルギー反応を引き起こすことが良く知られています。もう一方の好塩基球は顆粒球の1つで、血中白血球の1%以下と少数ながら、最近の研究から気管支ぜんそくやアトピー性皮膚炎などに見られる慢性アレルギー炎症の発症に重要な役割があることがわかってきています。本研究グループでは、アレルギーを引き起こすこの二種類の細胞が体の中でどのように産生されるのかを明らかにすれば、これらの細胞の数を制御してアレルギー疾患を治療できる可能性があると考えて研究を進めてきました。
マスト細胞や好塩基球が骨髄で産生されるためには、造血幹細胞から顆粒球・単球やマスト細胞に分化できる顆粒球−単球前駆細胞(GMP)、顆粒球やマスト細胞に分化できる顆粒球前駆細胞(GP)、さらには好塩基球やマスト細胞にしか分化しない好塩基球−マスト細胞共通前駆細胞(Pre-BMPとBMCPが知られる)を経る必要があると考えられています(図1)。
Pre-BMPやBMCPの下流には好塩基球前駆細胞(BaP)とマスト細胞前駆細胞(MCP)が存在し、それぞれ好塩基球とマスト細胞を産生します。このように多段階の変化を伴う細胞の分化においては、転写因子と呼ばれるたんぱく質が遺伝子の発現を調節することが重要と考えられていますが、好塩基球やマスト細胞の分化・産生を調節する転写因子に関する理解はまだ不十分なのが現状です。
研究の内容と成果
本研究グループはまず様々な転写因子の欠損マウスを用いて好塩基球とマスト細胞を解析しました。その結果、インターフェロン調節因子ファミリーの一つであるIRF8を欠損するマウスでは好塩基球が著しく減少することがわかりました。IRF8欠損マウスにおける好塩基球分化抑制がどの段階の前駆細胞で起こるのか調べると、BaPやPre-BMPはやはり著しく減少する一方で、GPの数は野生型マウスと比較して変化しないことがわかりました。次にIRF8タンパク質の発現を調べたところ、意外なことに好塩基球やマスト細胞自身、そしてBaP, MCP, Pre-BMP, BMCPはIRF8を発現せず、GPのみでIRF8の発現が認められました。以上の結果はIRF8はGPで発現することで好塩基球分化を促進する可能性を示しています。実際、IRF8欠損マウスからGPを単離して、生体内及び試験管内における好塩基球産生能を解析すると野生型GPと比較して著しく好塩基球産生能が減少していることがわかりました。
<図1.研究内容の概略>
<図1.研究内容の概略>
IRF8はGPより下流の細胞では発現しないため、GPにおいて好塩基球分化に必要な因子を誘導することが考えられます。そして本研究グループではその因子は転写因子なのではないかと推測しました。そこで野生型マウスとIRF8欠損マウスからGPを単離し、マイクロアレイ(*2)による網羅的遺伝子発現解析を行った結果、300以上の遺伝子の発現がIRF8欠損GPにおいて低下しており、その中に転写因子をコードするものが20個含まれていました。この転写因子の中でGPにおいてIRF8の下流で好塩基球分化を制御する可能性が高い転写因子をバイオインフォマティクス(*3)によって予測しました。具体的には、IRF8の欠損によって発現の低下している300個の遺伝子の発現を制御しているゲノム領域(近位エンハンサー・プロモーター領域)における転写因子結合モチーフ解析を行いました。その結果、GATA2がIRF8の下流で機能する最も重要な転写因子であるという予測結果が得られました。GATA2は好塩基球やマスト細胞の分化に必要であることが知られる数少ない転写因子のひとつです。そこでIRF8欠損前駆細胞にGATA2を強制的に発現させたところ、好塩基球の産生能が野生型と同程度に回復したことから、予測は正しかったことがわかりました。
IRF8欠損マウスではマスト細胞の数自体は変化がありませんでしたが、骨髄におけるMCPの数は著しく減少していました。またIRF8欠損マウスから単離したGPなど前駆細胞におけるマスト細胞産生能も低下していました。しかしIRF8欠損前駆細胞にGATA2を導入すると、好塩基球のみならずマスト細胞産生能もやはり回復することがわかりました。マスト細胞は好塩基球と異なり生体内において増殖してその数を維持でき、その際に免疫グロブリンの一種でアレルギーに重要なIgEが促進的な役割を持つことが知られています。IRF8欠損マウスでは産生された少数のマスト細胞が、IRF8欠損マウスで高値を呈することが知られているIgEの影響もあって増殖することで、最終的には野生型と同程度の数を維持しているのではないかと考えています。
今後の展開
今回研究グループはIRF8がGPにおいて別の転写因子であるGATA2の発現を誘導することで好塩基球やマスト細胞の産生を促進することを初めて明らかにしました。重要なことに、ヒトのIRF8遺伝子変異においても、解析症例数は少ないものの血中の好塩基球が検出できないことが最近報告されており、IRF8による好塩基球分化制御はヒトとマウスで共通の仕組みであることが考えられます。IRF8は樹状細胞や単球等他の免疫細胞の分化にも必須なので、IRF8の発現そのものや機能すべてを抑制してしまうことは治療法として必ずしも適さない可能性がありますが、今回の発見をさらに発展させ好塩基球やマスト細胞の分化・産生の仕組みをより深く理解することで、新しいアレルギー疾患の治療法開発の糸口にしていきたいと考えています。
用語解説
(*1)転写因子
ゲノム上のDNA配列を認識・結合して遺伝子の発現を制御するタンパク質。
(*2)マイクロアレイ
2万以上ある遺伝子の発現量を全て調べることができる技術です。遺伝子はメッセンジャーRNAが発現し(転写)、そこからタンパク質ができる(翻訳)ことで機能します。マイクロアレイではメッセンジャーRNAの量を調べることができます。
(*3)バイオインフォマティクス
応用数学、統計学、計算機科学などを応用して生物・医学の問題を解こうとする手法。
※ 本研究は、文部科学省科学研究費や横浜市立大学先端医科学研究センター研究開発プロジェクトなどの助成を受け、また文部科学省「イノベーションシステム整備事業 先端融合領域イノベーション創出拠点形成プログラム」の一環として行なわれました。
※ 論文著者ならびにタイトルなど
Haruka Sasaki*, Daisuke Kurotaki*, Naoki Osato, Hideaki Sato, Izumi Sasaki, Shin-ichi Koizumi, Hongsheng Wang, Chika Kaneda, Akira Nishiyama, Tsuneyasu Kaisho, Hiroyuki Aburatani, Herbert C. Morse III, Keiko Ozato, and Tomohiko Tamura: "Transcription factor IRF8 plays a critical role in the development of murine basophils and mast cells” Blood. Nov 14, 2014 [Epub ahead of print] , doi: 10.1182/blood-2014-02-557983. (*Co-1st authors)
用語解説
(*1)転写因子
ゲノム上のDNA配列を認識・結合して遺伝子の発現を制御するタンパク質。
(*2)マイクロアレイ
2万以上ある遺伝子の発現量を全て調べることができる技術です。遺伝子はメッセンジャーRNAが発現し(転写)、そこからタンパク質ができる(翻訳)ことで機能します。マイクロアレイではメッセンジャーRNAの量を調べることができます。
(*3)バイオインフォマティクス
応用数学、統計学、計算機科学などを応用して生物・医学の問題を解こうとする手法。
※ 本研究は、文部科学省科学研究費や横浜市立大学先端医科学研究センター研究開発プロジェクトなどの助成を受け、また文部科学省「イノベーションシステム整備事業 先端融合領域イノベーション創出拠点形成プログラム」の一環として行なわれました。
※ 論文著者ならびにタイトルなど
Haruka Sasaki*, Daisuke Kurotaki*, Naoki Osato, Hideaki Sato, Izumi Sasaki, Shin-ichi Koizumi, Hongsheng Wang, Chika Kaneda, Akira Nishiyama, Tsuneyasu Kaisho, Hiroyuki Aburatani, Herbert C. Morse III, Keiko Ozato, and Tomohiko Tamura: "Transcription factor IRF8 plays a critical role in the development of murine basophils and mast cells” Blood. Nov 14, 2014 [Epub ahead of print] , doi: 10.1182/blood-2014-02-557983. (*Co-1st authors)
(本資料の内容に関するお問い合わせ) 公立大学法人横浜市立大学大学院医学研究科免疫学教授田村 智彦
![]() 045-787-2614
045-787-2614
(取材対応窓口、資料請求など) 公立大学法人横浜市立大学先端医科学研究課長立石建
![]() 045-787-2527
045-787-2527