薬理学 中村史雄准教授、五嶋良郎教授らの研究グループが神経ガイド分子セマフォリン3Aの新たな作用メカニズムを解明~アルツハイマー病や中枢神経再生の理解に向けて
2014.11.01
- TOPICS
- 研究
薬理学 中村史雄准教授、五嶋良郎教授らの研究グループが神経ガイド分子セマフォリン3Aの新たな作用メカニズムを解明~アルツハイマー病や中枢神経再生の理解に向けて
~『Nature communications』に掲載~
横浜市立大学大学院医学研究科分子薬理神経生物学中村史雄准教授、五嶋良郎教授らの研究グループは、東京女子医大、横浜国立大学との共同研究により神経ガイド分子セマフォリン3Aがアクチン骨格を制御する分子機構を解明しました。セマフォリン3Aの作用が原因の一つと考えられるアルツハイマー病や、神経軸索再生阻害のメカニズムの解明に繋がる成果として、新たな治療法の開発が期待されます。
本研究は英国の科学雑誌「Nature Communications」(平成26年10月31日オンライン版)に掲載されました。
※本研究は、日本学術振興会・科学研究費基盤研究(C)の助成および、文部科学省「イノベーションシステム整備事業先端融合領域イノベーション創出拠点形成プログラム」の一環として行われ、横浜市立大学 先端医科学研究センターが推進している研究開発プロジェクトの成果の一つです。
本研究は英国の科学雑誌「Nature Communications」(平成26年10月31日オンライン版)に掲載されました。
※本研究は、日本学術振興会・科学研究費基盤研究(C)の助成および、文部科学省「イノベーションシステム整備事業先端融合領域イノベーション創出拠点形成プログラム」の一環として行われ、横浜市立大学 先端医科学研究センターが推進している研究開発プロジェクトの成果の一つです。
研究の背景
神経回路が形成される時に、神経ガイド分子とよばれるタンパク質が神経突起の伸長をコントロールします。神経ガイド分子は神経突起を導く誘引因子と遠ざける反発因子の2つに大きく分類されます。反発因子の一つであるセマフォリン3A(Sema3A)は、神経の伸びを阻止します。 神経突起の先端には、成長円錐と呼ばれる動きに富む構造があります。成長円錐は神経ガイド分子を感知して神経突起が伸びる方向や速度を決めます。この運動には成長円錐内のアクチンなどの細胞骨格とよばれるタンパク質の急速な骨組みの変化が伴います。Sema3Aは成長円錐のアクチン骨格の崩壊を引きおこして、神経突起の伸長を反発・阻害します。 私たちは今までにSema3Aの反発作用にCRMP1と呼ばれる細胞内蛋白質が関わることを報告してきました。しかしCRMP1からアクチン骨格のコントロールに至る仕組みが不明でした。我々はその間をつなぐ分子を検索してアクチン結合蛋白質の一つであるフィラミンA(Filamin-A)が、CRMP1と結合してこれらのタンパク質の構造を大きく変えてアクチン骨格をコントロールしている事実を発見しました。
研究の内容と成果
まず私たちはモデル生物の線虫を用いてCRMP1(線虫ではUNC-33)と相互作用する分子を検索し、アクチン結合蛋白質Filamin-1(脊椎動物ではFilamin-A)を見いだしました。Filamin-1はUNC-33と一緒に働いて線虫の神経回路形成に関わることを見いだしました。次に脊椎動物を用いた検討を行い、Filamin-AはCRMP1と結合することや、この相互作用がSema3A情報伝達に関わることを明らかにしました。
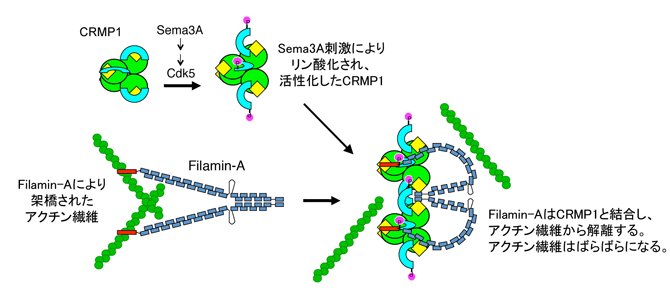
ではCRMP1とFilaminの相互作用が、どのようにSema3Aによる成長円錐のアクチン骨格の崩壊に結びつくのでしょうか?Filamin-Aはアクチン繊維を架橋して強い網状構造を作ることが知られています。私たちは原子間力顕微鏡というナノサイズの分子を見ることのできる顕微鏡を用いてFilamin-Aの分子形態を観察し、CRMP1が結合すると形が大きく変わることを見いだしました。さらにSema3A刺激に伴いFilamin-AはCRMP1と複合体を形成してアクチン骨格から解離することを明らかにしました(図)。このためFilamin-Aによる架橋を失ったアクチン骨格は脆弱化し、崩壊すると推測されました。今回の研究によりSema3A反発作用の分子機構に、CRMP1とFilamin-Aを介したアクチン骨格制御が存在することが明らかになりました。
ではCRMP1とFilaminの相互作用が、どのようにSema3Aによる成長円錐のアクチン骨格の崩壊に結びつくのでしょうか?Filamin-Aはアクチン繊維を架橋して強い網状構造を作ることが知られています。私たちは原子間力顕微鏡というナノサイズの分子を見ることのできる顕微鏡を用いてFilamin-Aの分子形態を観察し、CRMP1が結合すると形が大きく変わることを見いだしました。さらにSema3A刺激に伴いFilamin-AはCRMP1と複合体を形成してアクチン骨格から解離することを明らかにしました(図)。このためFilamin-Aによる架橋を失ったアクチン骨格は脆弱化し、崩壊すると推測されました。今回の研究によりSema3A反発作用の分子機構に、CRMP1とFilamin-Aを介したアクチン骨格制御が存在することが明らかになりました。
今後の展望
Sema3AやCRMP1は神経回路形成に関わるだけでなく、アルツハイマー病や神経損傷後の軸索再生を阻害する因子としても知られています。今回の研究においてCRMP1とFilamin-Aの相互作用部位を詳しく調べています。今後は2者の相互作用を抑制する薬物を見いだし、Sema3Aの反発や軸索阻害作用を打ち消して新たな治療薬の開発へと発展させていきたいと考えています。
論文著者・タイトル
Fumio Nakamura, Kosuke Kumeta, Tomonobu Hida, Toshinari Isono, Yuichi Nakayama, Emiko Kuramata-Matsuoka, Naoya Yamashita, Yutaka Uchida, Ken-ichi Ogura, Keiko Gengyo-Ando, Shohei Mitani, Toshio Ogino and Yoshio Goshima: “Amino and carboxyl terminal domains of Filamin‐A interact with CRMP1 to mediate Sema3A‐signaling” Nature Communications on 31st Oct 2014 doi 10.1038/ncomms6325.
論文著者・タイトル
Fumio Nakamura, Kosuke Kumeta, Tomonobu Hida, Toshinari Isono, Yuichi Nakayama, Emiko Kuramata-Matsuoka, Naoya Yamashita, Yutaka Uchida, Ken-ichi Ogura, Keiko Gengyo-Ando, Shohei Mitani, Toshio Ogino and Yoshio Goshima: “Amino and carboxyl terminal domains of Filamin‐A interact with CRMP1 to mediate Sema3A‐signaling” Nature Communications on 31st Oct 2014 doi 10.1038/ncomms6325.
お問い合わせ先
(本資料の内容に関するお問い合わせ)
公立大学法人横浜市立大学大学院医学研究科分子薬理神経生物学
准教授中村 史雄、教授五嶋 良郎
TEL:045-787-2595
E-mail:(中村)
(五嶋)
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学先端医科学研究課長立石建
TEL:045-787-2527E-Mail
公立大学法人横浜市立大学大学院医学研究科分子薬理神経生物学
准教授中村 史雄、教授五嶋 良郎
TEL:045-787-2595
E-mail:(中村)
(五嶋)
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学先端医科学研究課長立石建
TEL:045-787-2527E-Mail