2017.10.20
- プレスリリース
- 研究
細胞固有の性質が遺伝する仕組みを解明〜DNAメチル化酵素の正確な配置と活性化を制御する仕組み〜
~『Molecular Cell』に掲載~
横浜市立大学 大学院生命医科学研究科 構造生物学研究室 有田恭平准教授、石山 怜(博士前期課程)、東京大学医科学研究所 中西 真教授、西山敦哉講師らの研究グループは、DNAメチル化*1の維持に関与するDNAメチル化酵素DNMT1*2が、ユビキチン化*3されたヒストン*4 H3を認識する機構を解明しました。
| 研究成果のポイント 〇DNAメチル化酵素DNMT1と、DNAメチル化部位へDNMT1を呼び込む目印となるユビキチン化されたヒストンH3との複合体の立体構造を解明し、その制御の仕組みを明らかにしました。
〇DNMT1とユビキチン化されたヒストンH3との結合が、DNMT1のDNAメチル化酵素活性を上昇させることを発見しました。
〇この成果により、細胞の性質を遺伝する分子メカニズムの一端が明らかとなったのに加え、新たなDNMT1活性化阻害剤の開発にもつながることが期待されます。
|
研究の背景
生体内に存在する200種類以上の細胞は、一部の例外を除いてすべて同じゲノム情報を持ちながらそれぞれ固有の性質を持ちます。これは細胞分化の過程で確立されるDNAメチル化によって、細胞の種類固有の遺伝子発現パターンが決まっているからです。
ゲノムDNAは細胞分裂の前に正確に複製されますが、DNAメチル化も親細胞から娘細胞に正確に受け継がれていきます。これをDNA維持メチル化といいます。DNA維持メチル化が破綻すると、細胞のがん化など様々な不具合が生じるので、DNAメチル化のパターンは厳密に制御され受け継がれるようになっています。
DNA維持メチル化には2つのタンパク質、UHRF1*5とDNMT1が必須です。UHRF1はDNA複製後に生じた片鎖メチル化DNAを認識して、近傍のヒストンH3をユビキチン化します。DNMT1はユビキチン化ヒストンH3を認識することで作用の場である片鎖メチル化DNAへと呼び込まれます。しかし、DNMT1が、ユビキチン化されたヒストンH3をどのような分子機構で認識するのかはよくわかっていませんでした。
ゲノムDNAは細胞分裂の前に正確に複製されますが、DNAメチル化も親細胞から娘細胞に正確に受け継がれていきます。これをDNA維持メチル化といいます。DNA維持メチル化が破綻すると、細胞のがん化など様々な不具合が生じるので、DNAメチル化のパターンは厳密に制御され受け継がれるようになっています。
DNA維持メチル化には2つのタンパク質、UHRF1*5とDNMT1が必須です。UHRF1はDNA複製後に生じた片鎖メチル化DNAを認識して、近傍のヒストンH3をユビキチン化します。DNMT1はユビキチン化ヒストンH3を認識することで作用の場である片鎖メチル化DNAへと呼び込まれます。しかし、DNMT1が、ユビキチン化されたヒストンH3をどのような分子機構で認識するのかはよくわかっていませんでした。
研究の内容
今回研究グループは、DNA維持メチル化の過程を再現する試験管内染色体複製系と質量分析解析を組み合わせることで、DNMT1がN末尾部の2か所にモノユビキチン化を受けたヒストンH3と特異的に結合することを発見しました。また、このヒストンH3の複数個所のモノユビキチン化はUHRF1に依存的であり、H3のリジン14, 18, 23を標的とするものであることもわかりました。
一般的にタンパク質のユビキチン化は、付加されたユビキチンがつながってポリマー化(=ポリユビキチン化)されることで様々な生命現象のシグナルとして働くことが知られていました。しかし、今回の研究成果から、DNA維持メチル化の過程では、ポリユビキチン化ではなく複数個所のモノユビキチン化がシグナルとして働き、これらをDNMT1のRFTSドメイン*6が同時に認識することを明らかにしました。(図1)
一般的にタンパク質のユビキチン化は、付加されたユビキチンがつながってポリマー化(=ポリユビキチン化)されることで様々な生命現象のシグナルとして働くことが知られていました。しかし、今回の研究成果から、DNA維持メチル化の過程では、ポリユビキチン化ではなく複数個所のモノユビキチン化がシグナルとして働き、これらをDNMT1のRFTSドメイン*6が同時に認識することを明らかにしました。(図1)
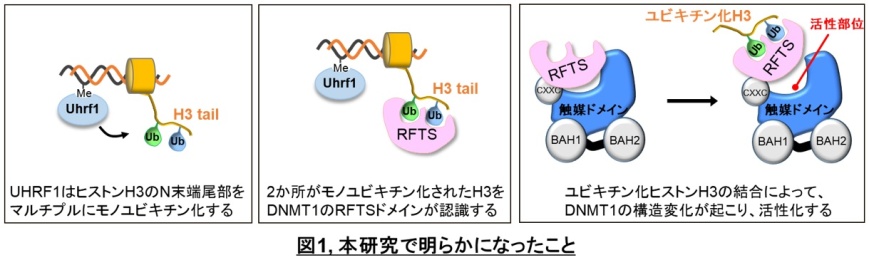
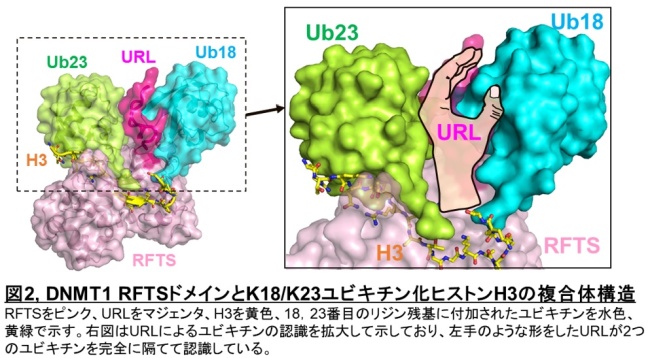
この珍しいユビキチン化修飾の認識機構の詳細を明らかにするために、リジン18とリジン23がモノユビキチン化されたヒストンH3とDNMT1のRFTSドメインの複合体の立体構造をX線結晶構造解析法で決定しました。その結果、ヒストンH3上の2つのモノユビキチンは、RFTSドメインによって同時に認識されることがわかりました。ユビキチンは他のタンパク質と結合するときにI44パッチという分子表面を例外なく使います。今回決定した立体構造によると、RFTSドメインは、これに加えて、ユビキチン認識ループ(ubiquitin recognition loop:URL)によってユビキチンの他の分子表面も認識しており、非常に広範囲に渡って相互作用していることがわかりました。このRFTSドメインのURLは ‘左手’ のような特徴的な形をしており、‘手のひら’ でリジン18に付加されたユビキチンを、‘手の甲’ でリジン23に付加されたユビキチンを認識するという特徴を持っていました。さらに、ユビキチン化されたヒストンH3は2-20番目までのアミノ酸がRFTSドメインと相互作用しており、今まで見られないような非常に広範囲に渡ってRFTSドメインと相互作用していることが分かりました。(図2)
DNMT1は、通常の状態ではRFTSドメインとDNAメチル化活性を持つ触媒ドメインが相互作用しており、活性阻害型の立体構造をとることが知られていました。しかし、今回の研究でさらに大阪大学蛋白質研究所 末武准教授らの生化学的な実験により、DNMT1はユビキチン化ヒストンH3に結合するとDNAメチル化活性が大幅に亢進されることが分かりました。さらに、横浜市立大学大学院 生命医科学研究科 木寺教授らの分子動力学計算によって、ユビキチン化ヒストンH3が結合するとDNMT1のRFTSドメインと触媒ドメインの相互作用が弱くなる過程をシミュレーションでき、ユビキチン化ヒストンH3によるDNMT1の新規の酵素活性化機構を解明しました(図1)。
今後の展開
この研究成果は、DNAメチル化維持機構の仕組みの一端を詳細に解明するとともに、細胞のがん化や脱分化などの生命現象の理解と、その制御に重要な知見を与えます。例えば、DNMT1の触媒ドメインを標的にした抗がん剤はありますが、その使用は限定的であり副作用が生じる問題があります。しかし、DNMT1に特徴的であるRFTSドメインを標的に高選択的な薬剤を開発できれば、がん細胞や神経変性疾患で見られる異常なDNAメチル化を制御できる可能性があります。今回の研究成果はDNA維持メチル化という重要な生命現象の解明に加えて、この分野の応用に寄与するものと期待されます。
用語説明
*1, DNAメチル化
DNAに含まれるシトシン塩基にメチル基(CH3-)が付加される反応。DNAメチル化により、遺伝子の発現が抑制されると考えられている。生物の体を形成するために必須である。
*2, DNMT1
DNAにメチル基を転移する反応を触媒する酵素。DNMT1はDNA2重らせんの片方の鎖のみがメチル化された片鎖メチル化DNAを反応の基質として好む。
*3, ユビキチン(化)
76アミノ酸からなるタンパク質で、基質となるタンパク質のリジン残基に共有結合を介して付加される。基質に付加されたユビキチンはさらにユビキチンが付加されていくことによってポリマー化し、タンパク質分解やDNA損傷修復、炎症などの様々な生命現象を制御する。
*4,ヒストン
ヒストンH1、H2A、H2B、H3、H4の5種類からなる。ゲノムDNAはヒストンタンパク質に巻き付き、ヌクレオソームという構造体を形成することで、核の中で折りたたまって収納される。ヒストンはアセチル化、メチル化などの様々な化学修飾を受け、遺伝子発現を調節すると考えられている。
*5, UHRF1
DNAメチル化維持に必須の役割をするタンパク質。片鎖メチル化DNAへの結合や、ヒストンH3のユビキチン化など様々に機能することで、DNAメチル化パターンの複製を誘導する。
*6, ドメイン
タンパク質中に存在する独立に立体構造を持ち機能する領域。
DNAに含まれるシトシン塩基にメチル基(CH3-)が付加される反応。DNAメチル化により、遺伝子の発現が抑制されると考えられている。生物の体を形成するために必須である。
*2, DNMT1
DNAにメチル基を転移する反応を触媒する酵素。DNMT1はDNA2重らせんの片方の鎖のみがメチル化された片鎖メチル化DNAを反応の基質として好む。
*3, ユビキチン(化)
76アミノ酸からなるタンパク質で、基質となるタンパク質のリジン残基に共有結合を介して付加される。基質に付加されたユビキチンはさらにユビキチンが付加されていくことによってポリマー化し、タンパク質分解やDNA損傷修復、炎症などの様々な生命現象を制御する。
*4,ヒストン
ヒストンH1、H2A、H2B、H3、H4の5種類からなる。ゲノムDNAはヒストンタンパク質に巻き付き、ヌクレオソームという構造体を形成することで、核の中で折りたたまって収納される。ヒストンはアセチル化、メチル化などの様々な化学修飾を受け、遺伝子発現を調節すると考えられている。
*5, UHRF1
DNAメチル化維持に必須の役割をするタンパク質。片鎖メチル化DNAへの結合や、ヒストンH3のユビキチン化など様々に機能することで、DNAメチル化パターンの複製を誘導する。
*6, ドメイン
タンパク質中に存在する独立に立体構造を持ち機能する領域。
掲載論文
Structure of the Dnmt1 reader module complexed with a unique two-mono-ubiquitin mark on histone H3 reveals the basis for DNA methylation maintenance
Satoshi Ishiyama*, Atsuya Nishiyama*, Yasushi Saeki, Kei Moritsugu, Daichi Morimoto,Luna Yamaguchi, Naoko Arai, Rumie Matsumura, Toru Kawakami, Yuichi Mishima, Hironobu Hojo, Shintaro Shimamura, Fuyuki Ishikawa,
Shoji Tajima, Keiji Tanaka, Mariko Ariyoshi, Masahiro Shirakawa, Mitsunori Ikeguchi, Akinori Kidera, Isao Suetake*, Kyohei Arita*, and Makoto Nakanishi*
*These authors contributed equally
Molecular Cell, October 19, 2017, https://doi.org/10.1016/j.molcel.2017.09.037
※本研究は、『Molecular Cell』に掲載されます。(米国東部時間10月19日正午付:日本時間10月20日午前1時付オンライン)
※本研究は、国立研究開発法人科学技術振興機構(JST) 戦略的創造研究推進事業 個人型研究(さきがけ) 「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域の一環で行われました。
Satoshi Ishiyama*, Atsuya Nishiyama*, Yasushi Saeki, Kei Moritsugu, Daichi Morimoto,Luna Yamaguchi, Naoko Arai, Rumie Matsumura, Toru Kawakami, Yuichi Mishima, Hironobu Hojo, Shintaro Shimamura, Fuyuki Ishikawa,
Shoji Tajima, Keiji Tanaka, Mariko Ariyoshi, Masahiro Shirakawa, Mitsunori Ikeguchi, Akinori Kidera, Isao Suetake*, Kyohei Arita*, and Makoto Nakanishi*
*These authors contributed equally
Molecular Cell, October 19, 2017, https://doi.org/10.1016/j.molcel.2017.09.037
※本研究は、『Molecular Cell』に掲載されます。(米国東部時間10月19日正午付:日本時間10月20日午前1時付オンライン)
※本研究は、国立研究開発法人科学技術振興機構(JST) 戦略的創造研究推進事業 個人型研究(さきがけ) 「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域の一環で行われました。
(本資料の内容に関するお問い合わせ)
横浜市立大学 大学院生命医科学研究科 構造生物学 准教授 有田恭平
TEL:045-508-7227
E-mail:aritak@tsurumi.yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
横浜市立大学 研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510
E-mail:kenki@yokohama-cu.ac.jp
横浜市立大学 大学院生命医科学研究科 構造生物学 准教授 有田恭平
TEL:045-508-7227
E-mail:aritak@tsurumi.yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
横浜市立大学 研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510
E-mail:kenki@yokohama-cu.ac.jp