進行性ミオクローヌスてんかんの原因遺伝子を明らかに!~『American Journal of Human Genetics』に掲載~
2020.03.13
- TOPICS
- 研究
- 医療
進行性ミオクローヌスてんかんの原因遺伝子を明らかに!
~『American Journal of Human Genetics』に掲載~
横浜市立大学大学院医学研究科 遺伝学の濵中耕平研究員、今川英里研究員、輿水江里子研究員、松本直通教授らの研究グループは、進行性ミオクローヌスてんかんの原因となるSEMA6B遺伝子の変異を同定しました。この研究成果は、国立病院機構西新潟中央病院の遠山潤医師、自治医科大学小児科学講座の山形崇倫教授、宮内彰彦医師、The Genetics Institute Rambam Health Care CampusのNina Ekhilevitch医師、Kuala Lumpur病院のAhmad Rithauddin Mohamed医師、Gaik-Siew Ch'ng医師との共同研究によるものです。
研究成果のポイント
|
研究の背景
発達性およびてんかん性脳症(developmental and epileptic encephalopathy)は、てんかん、脳波の異常、発達の遅れや退行などの神経発達の障害を示す疾患群です。疾患に関連する変異を有する遺伝子群が多岐にわたり、診断率は約40-50%程度です。症例ごとの病態メカニズムに合わせた医学的管理や治療には、変異遺伝子の特定が重要です。また、半数を占める原因が未解明の症例について、変異遺伝子の特定も極めて重要です。
研究の内容
本研究グループは、発達性およびてんかん性脳症を呈する患者346例の全エクソームシーケンシングの解析データを用いて、遺伝子変異を探索しました。その結果、2例からSEMA6B遺伝子にタンパク質短縮型の新生突然変異*8を検出しました(図1)。同一の遺伝子に複数の患者で新生突然変異が検出されたのはSEMA6B遺伝子のみでした。そこで、SEMA6B遺伝子に着目して、同疾患やその類縁疾患を呈する別の患者5,699例の全エクソームシーケンシングの解析データで変異を探索したところ、3例でSEMA6B遺伝子にタンパク質短縮型の新生突然変異を検出しました(図1)。SEMA6B遺伝子は細胞間の情報伝達に関わるタンパク質である膜貫通型セマフォリンの1つをコードしており、中枢神経系の発達に関与していると考えられています。
この型の新生突然変異がSEMA6B遺伝子に起きる理論的な確率から考えると、6,045例(346例+5699例)のうち5例は統計的に有意に多いと考えられます(p=1.9×10-13、有意水準2.5×10-6)。興味深いことに、これらの遺伝子変異は、全てナンセンス変異依存性メッセンジャーRNA分解(nonsense-mediated mRNA decay、NMD)*9を受けない最終エクソンに存在しました(図1)。これらの遺伝子変異はSEMA6Bタンパク質の細胞内領域を翻訳する領域の途中で未成熟終始コドン*10を作るため、細胞内領域が欠損したSEMA6Bタンパク質が産生されると考えられました(図1)。一方で、一般集団の遺伝子変異データベースに登録されているタンパク質短縮型変異は、NMDを受ける領域に存在しました(図1)。そのため、NMDによりRNAの分解が起こり翻訳されるSEMA6Bタンパク質量が減ることでは、疾患を引き起こさないと考えられました。これらのことから、SEMA6Bタンパク質の細胞内領域をコードするC末端が欠損した短縮型のSEMA6Bタンパク質が産生されることが、疾患の原因である可能性が示唆されました。これらの遺伝子変異を有する症例は、発達の退行、てんかん、ミオクローヌス*11、錐体路徴候*12、小脳失調などを呈し、発達性およびてんかん性脳症の中でも特に進行性ミオクローヌスてんかんに分類されます。
更にモデル実験動物のゼブラフィッシュを用いて、CRISPR/Cas9システム*13を利用したsema6b遺伝子の変異体を作製しました。その結果、sema6b遺伝子の細胞内領域が欠損したモザイク変異体*14の中枢神経において、神経細胞の減少が観察されました。定量のために中脳の視蓋領域を計測したところ、その差は統計的に有意であることが明らかになりました(図2, A)。また、ペンチレンテトラゾール(PTZ)というけいれんを誘発する化合物を使用した実験を行い、行動をモニタリングしました。NMDを受けずタンパク質が壊されないsema6bモザイク変異体では、行動量の増加、体を横倒しにした異常遊泳、不随意運動のようなヒトのミオクローヌスてんかんに類似した行動が顕著に現れることが明らかになり、ヒトの病態が再現されました(図2, B, C, D)。
以上より、SEMA6Bの最終エクソンにおけるタンパク質短縮型変異が、NMDを受けずに短縮型タンパク質を産生し、この異常タンパク質が優性阻害もしくは機能獲得のメカニズムにより進行性ミオクローヌスてんかんを起こすことが示唆されました。
この型の新生突然変異がSEMA6B遺伝子に起きる理論的な確率から考えると、6,045例(346例+5699例)のうち5例は統計的に有意に多いと考えられます(p=1.9×10-13、有意水準2.5×10-6)。興味深いことに、これらの遺伝子変異は、全てナンセンス変異依存性メッセンジャーRNA分解(nonsense-mediated mRNA decay、NMD)*9を受けない最終エクソンに存在しました(図1)。これらの遺伝子変異はSEMA6Bタンパク質の細胞内領域を翻訳する領域の途中で未成熟終始コドン*10を作るため、細胞内領域が欠損したSEMA6Bタンパク質が産生されると考えられました(図1)。一方で、一般集団の遺伝子変異データベースに登録されているタンパク質短縮型変異は、NMDを受ける領域に存在しました(図1)。そのため、NMDによりRNAの分解が起こり翻訳されるSEMA6Bタンパク質量が減ることでは、疾患を引き起こさないと考えられました。これらのことから、SEMA6Bタンパク質の細胞内領域をコードするC末端が欠損した短縮型のSEMA6Bタンパク質が産生されることが、疾患の原因である可能性が示唆されました。これらの遺伝子変異を有する症例は、発達の退行、てんかん、ミオクローヌス*11、錐体路徴候*12、小脳失調などを呈し、発達性およびてんかん性脳症の中でも特に進行性ミオクローヌスてんかんに分類されます。
更にモデル実験動物のゼブラフィッシュを用いて、CRISPR/Cas9システム*13を利用したsema6b遺伝子の変異体を作製しました。その結果、sema6b遺伝子の細胞内領域が欠損したモザイク変異体*14の中枢神経において、神経細胞の減少が観察されました。定量のために中脳の視蓋領域を計測したところ、その差は統計的に有意であることが明らかになりました(図2, A)。また、ペンチレンテトラゾール(PTZ)というけいれんを誘発する化合物を使用した実験を行い、行動をモニタリングしました。NMDを受けずタンパク質が壊されないsema6bモザイク変異体では、行動量の増加、体を横倒しにした異常遊泳、不随意運動のようなヒトのミオクローヌスてんかんに類似した行動が顕著に現れることが明らかになり、ヒトの病態が再現されました(図2, B, C, D)。
以上より、SEMA6Bの最終エクソンにおけるタンパク質短縮型変異が、NMDを受けずに短縮型タンパク質を産生し、この異常タンパク質が優性阻害もしくは機能獲得のメカニズムにより進行性ミオクローヌスてんかんを起こすことが示唆されました。
今後の展開
今回、進行性ミオクローヌスてんかんの原因となる新たな遺伝子変異が同定されたことで、本疾患の分子診断や病態メカニズムの解明、医学的管理法や治療法の開発に寄与できることが期待されます。
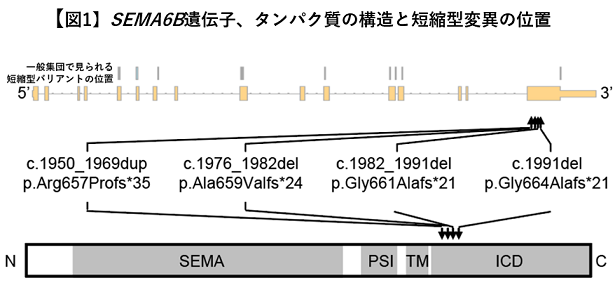
5家系で同定された4つのタンパク質短縮型変異の遺伝子上での位置とタンパク質上での位置を矢印で示す。対照として一般集団で見られたタンパク質短縮型変異の位置を灰色の縦線で示す(一番上)。患者に同定された変異は細胞内領域に位置する(3’側の)最終エクソンに集中している。最下部にタンパク質の全長と4つの機能的ドメインを示す。SEMA: セマドメイン、PSI:プレキシンセマフォリンインテグリンドメイン、TM:膜貫通領域、ICD:細胞内領域。
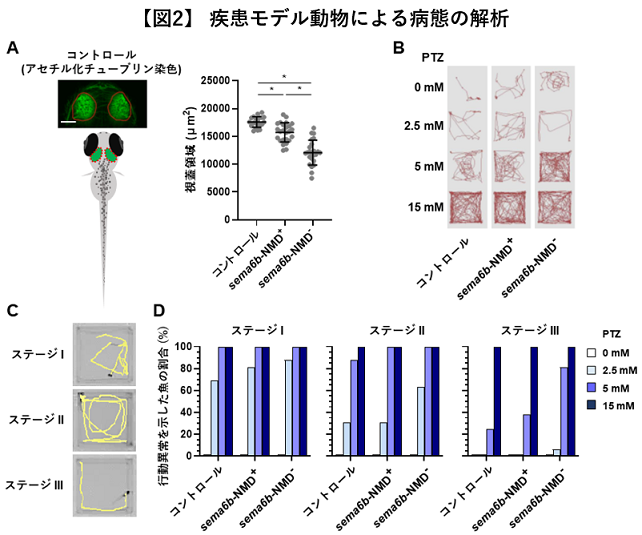
A) ゼブラフィッシュの神経細胞をアセチル化チューブリン抗体により染色・可視化した後、中脳視蓋領域を定量した(赤い破線領域)。sema6bがNMDを受けずタンパク質が壊されない変異体(sema6b-NMD-)では神経細胞がNMDを受ける(sema6b-NMD+)変異体に対し有意に減少した。* P < 0.0001
B) ペンチレンテトラゾール(PTZ)けいれん実験により、魚の行動をモニタリングした(赤い線は魚の移動軌跡)。NMD-(変異がNMDを受けずタンパク質が壊されない)変異体はPTZを5 mMの濃度で処理した区において、けいれん様行動が増強した(赤い線が増加)。
C) PTZけいれん実験による行動異常を3段階のステージで分類した。黄色い線は魚の移動軌跡を表す。ステージ I: 遊泳速度の上昇(症状の出現)、ステージ II: 旋回行動(発作の展開)、ステージ III: ミオクローヌス様行動。
D) sema6b-NMD- 変異体はPTZを2.5 mM、5 mMの濃度で処理した区において、けいれん様行動がsema6b-NMD+ 変異体よりも顕著に表れた。ステージIIIの行動を示す魚はPTZ 5 mM処理区において、コントロールでは25%、sema6b-NMD+ 変異体では38%、sema6b-NMD- 変異体では81%と増加した。PTZ処理区における解析個体数はそれぞれ16尾。
B) ペンチレンテトラゾール(PTZ)けいれん実験により、魚の行動をモニタリングした(赤い線は魚の移動軌跡)。NMD-(変異がNMDを受けずタンパク質が壊されない)変異体はPTZを5 mMの濃度で処理した区において、けいれん様行動が増強した(赤い線が増加)。
C) PTZけいれん実験による行動異常を3段階のステージで分類した。黄色い線は魚の移動軌跡を表す。ステージ I: 遊泳速度の上昇(症状の出現)、ステージ II: 旋回行動(発作の展開)、ステージ III: ミオクローヌス様行動。
D) sema6b-NMD- 変異体はPTZを2.5 mM、5 mMの濃度で処理した区において、けいれん様行動がsema6b-NMD+ 変異体よりも顕著に表れた。ステージIIIの行動を示す魚はPTZ 5 mM処理区において、コントロールでは25%、sema6b-NMD+ 変異体では38%、sema6b-NMD- 変異体では81%と増加した。PTZ処理区における解析個体数はそれぞれ16尾。
用語説明
*1 全エクソームシーケンシング解析:ゲノム上のエクソン領域(遺伝子がタンパク質の配列を決定するゲノム中の領域)を網羅的に分画後、次世代シーケンサー(高速にゲノムの配列を読むことができる機械)を用いて塩基配列を決定する方法。
*2 神経軸索ガイダンス:神経の軸索が、周囲の細胞との情報伝達を介して、目的とする部位に伸長するように導かれる現象。
*3 進行性ミオクローヌスてんかん:ミオクローヌス、てんかん発作、小脳症状、認知機能障害などを特徴として、進行性の経過を辿る疾患群。
*4 タンパク質短縮型変異:未成熟終始コドンが形成され、タンパク質の翻訳を途中で終わらせる変異。
*5 ハプロ不全:一対の相同染色体のうち、一方の遺伝子から翻訳されるタンパク質の量的不足で表現型を起こす現象。
*6 優性阻害:変異型タンパク質が野生型タンパク質に対して優性に働いて、野生型タンパク質の働きを阻害する現象。
*7 機能獲得:変異型タンパク質において、野生型タンパク質の機能が亢進する、もしくは野生型タンパク質にはない機能を持つ現象。
*8 新生突然変異:両親には見られず子供にのみ見られる変異。
*9 ナンセンス変異依存性メッセンジャーRNA分解:最終のスプライス部位の50-55塩基以上の上流に、中途型終始コドン(本来の位置よりも5’寄りの位置でタンパク質合成を終わらせる終始コドン)が含まれるメッセンジャーRNA分子を、特異的に分解する機構。
*10 未成熟終始コドン:野生型の終始コドンより5’末端側に現れた終始コドン。NMDを受けない場合は、この終始コドンより3’末端側の領域が翻訳されない短縮型のタンパク質が産生される。
*11 ミオクローヌス:自分の意志とは無関係に筋肉が素早く収縮する不随意運動。
*12 錐体路徴候:痙性麻痺(手足が突っ張り動かせない)、腱反射の亢進、病的反射の出現などを指す。大脳皮質の運動野から筋までの神経の回路のうち、中枢神経内の部位(錐体路)の障害による。
*13 CRISPR/Cas9システム:獲得免疫の機構を利用した標的となる遺伝子を改変する技術であり、DNA二本鎖を切断してゲノム配列の任意の場所を削除、置換、挿入することができる。
*14 モザイク変異体:一つの個体において遺伝的に異なる複数種類の細胞を持つ状態。
*2 神経軸索ガイダンス:神経の軸索が、周囲の細胞との情報伝達を介して、目的とする部位に伸長するように導かれる現象。
*3 進行性ミオクローヌスてんかん:ミオクローヌス、てんかん発作、小脳症状、認知機能障害などを特徴として、進行性の経過を辿る疾患群。
*4 タンパク質短縮型変異:未成熟終始コドンが形成され、タンパク質の翻訳を途中で終わらせる変異。
*5 ハプロ不全:一対の相同染色体のうち、一方の遺伝子から翻訳されるタンパク質の量的不足で表現型を起こす現象。
*6 優性阻害:変異型タンパク質が野生型タンパク質に対して優性に働いて、野生型タンパク質の働きを阻害する現象。
*7 機能獲得:変異型タンパク質において、野生型タンパク質の機能が亢進する、もしくは野生型タンパク質にはない機能を持つ現象。
*8 新生突然変異:両親には見られず子供にのみ見られる変異。
*9 ナンセンス変異依存性メッセンジャーRNA分解:最終のスプライス部位の50-55塩基以上の上流に、中途型終始コドン(本来の位置よりも5’寄りの位置でタンパク質合成を終わらせる終始コドン)が含まれるメッセンジャーRNA分子を、特異的に分解する機構。
*10 未成熟終始コドン:野生型の終始コドンより5’末端側に現れた終始コドン。NMDを受けない場合は、この終始コドンより3’末端側の領域が翻訳されない短縮型のタンパク質が産生される。
*11 ミオクローヌス:自分の意志とは無関係に筋肉が素早く収縮する不随意運動。
*12 錐体路徴候:痙性麻痺(手足が突っ張り動かせない)、腱反射の亢進、病的反射の出現などを指す。大脳皮質の運動野から筋までの神経の回路のうち、中枢神経内の部位(錐体路)の障害による。
*13 CRISPR/Cas9システム:獲得免疫の機構を利用した標的となる遺伝子を改変する技術であり、DNA二本鎖を切断してゲノム配列の任意の場所を削除、置換、挿入することができる。
*14 モザイク変異体:一つの個体において遺伝的に異なる複数種類の細胞を持つ状態。
※本研究は、米国の科学雑誌『American Journal of Human Genetics』に掲載されました。
掲載論文
De novo truncating variants in the last exon of SEMA6B cause progressive myoclonic epilepsy
Kohei Hamanaka,* Eri Imagawa,* Eriko Koshimizu,* Satoko Miyatake, Jun Tohyama,
Takanori Yamagata, Akihiko Miyauchi, Nina Ekhilevitch, Fumio Nakamura, Takeshi Kawashima,
Yoshio Goshima, Ahmad Rithauddin Mohamed, Gaik-Siew Ch'ng, Atsushi Fujita, Yoshiteru Azuma, Ken Yasuda, Shintaro Imamura, Mitsuko Nakashima, Hirotomo Saitsu, Satomi Mitsuhashi,
Takeshi Mizuguchi, Atsushi Takata, Noriko Miyake, and Naomichi Matsumoto
*These authors equally contributed to this work.
The American Journal of Human Genetics(2020), https://doi.org/10.1016/j.ajhg.2020.02.011
Kohei Hamanaka,* Eri Imagawa,* Eriko Koshimizu,* Satoko Miyatake, Jun Tohyama,
Takanori Yamagata, Akihiko Miyauchi, Nina Ekhilevitch, Fumio Nakamura, Takeshi Kawashima,
Yoshio Goshima, Ahmad Rithauddin Mohamed, Gaik-Siew Ch'ng, Atsushi Fujita, Yoshiteru Azuma, Ken Yasuda, Shintaro Imamura, Mitsuko Nakashima, Hirotomo Saitsu, Satomi Mitsuhashi,
Takeshi Mizuguchi, Atsushi Takata, Noriko Miyake, and Naomichi Matsumoto
*These authors equally contributed to this work.
The American Journal of Human Genetics(2020), https://doi.org/10.1016/j.ajhg.2020.02.011
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)の難治性疾患実用化研究事業「希少難病の高精度診断と病態解明のためのオミックス拠点の構築」(研究代表者:松本直通)、厚生労働省、文部科学省、科学技術振興機構、日本学術振興会、武田科学振興財団の研究補助金により行われました。
※本研究は、東京女子医科大学 生化学 中村史雄教授、横浜市立大学大学院医学研究科 薬理学 五嶋良郎教授、河嶌岳研究員、京都大学大学院医学研究科 臨床神経学 安田謙医師、国立研究開発法人水産研究・教育機構 中央水産研究所 今村伸太朗主任研究員、浜松医科大学 生化学 才津浩智教授、中島光子准教授、横浜市立大学附属病院 遺伝子診療部 宮武聡子講師、遺伝学 藤田京志研究員、東慶輝研究員、三橋里美助教、水口剛講師、高田篤講師、三宅紀子准教授の協力を得て行われました。
※本研究は、東京女子医科大学 生化学 中村史雄教授、横浜市立大学大学院医学研究科 薬理学 五嶋良郎教授、河嶌岳研究員、京都大学大学院医学研究科 臨床神経学 安田謙医師、国立研究開発法人水産研究・教育機構 中央水産研究所 今村伸太朗主任研究員、浜松医科大学 生化学 才津浩智教授、中島光子准教授、横浜市立大学附属病院 遺伝子診療部 宮武聡子講師、遺伝学 藤田京志研究員、東慶輝研究員、三橋里美助教、水口剛講師、高田篤講師、三宅紀子准教授の協力を得て行われました。
お問合わせ先
(本資料の内容に関するお問い合わせ)
(取材対応窓口、資料請求など)
研究企画・産学連携推進課
課長 渡邊 誠 E-Mail:kenkyupr@yokohama-cu.ac.jp
TEL:045-787-2510