やせ型インスリン抵抗性と骨格筋との関わりを解明 ~糖尿病発症抑制の新たな可能性~
2018.02.15
- TOPICS
- 研究
- 病院
- 医療
やせ型インスリン抵抗性と骨格筋との関わりを解明 ~糖尿病発症抑制のための新たな治療の可能性~
~『Scientific Reports』に掲載~
横浜市立大学医学部 循環器・腎臓・高血圧内科学の大城光二医師、田村功一主任教授、涌井広道講師、小豆島謙護博士、医学部医学科5年生の岸尾望氏らは、やせ型インスリン抵抗性の発症・進展に関わるメカニズムの一部を解明しました。
糖尿病や脳心血管病の発症のリスクとして重要なメタボリック症候群は、内臓脂肪型肥満や高血圧、糖脂質代謝の異常を特徴とします。研究グループは以前、受容体結合蛋白ATRAP/Agtrap*1を内臓脂肪組織で活性化させると、高カロリー摂取でおきる脂肪細胞の肥大化・炎症およびアンジオテンシン受容体の過剰な亢進状態が是正され、内臓脂肪型肥満とインスリン抵抗性が改善することを報告しました。本研究ではさらに、アンジオテンシンII作用の亢進が、肥満を伴わない病態であってもインスリン抵抗性を引き起こすことを示し、これには骨格筋での糖取り込みに関わる機能の変化が重要であることを明らかにしました。また、骨格筋でATRAP発現を増加させることにより、やせ型インスリン抵抗性が改善できることを示しました。
糖尿病や脳心血管病の発症のリスクとして重要なメタボリック症候群は、内臓脂肪型肥満や高血圧、糖脂質代謝の異常を特徴とします。研究グループは以前、受容体結合蛋白ATRAP/Agtrap*1を内臓脂肪組織で活性化させると、高カロリー摂取でおきる脂肪細胞の肥大化・炎症およびアンジオテンシン受容体の過剰な亢進状態が是正され、内臓脂肪型肥満とインスリン抵抗性が改善することを報告しました。本研究ではさらに、アンジオテンシンII作用の亢進が、肥満を伴わない病態であってもインスリン抵抗性を引き起こすことを示し、これには骨格筋での糖取り込みに関わる機能の変化が重要であることを明らかにしました。また、骨格筋でATRAP発現を増加させることにより、やせ型インスリン抵抗性が改善できることを示しました。
| 研究成果のポイント 〇骨格筋での糖取り込み低下がやせ型なのにインスリン抵抗性を示す重要な要因
〇この糖取り込みの低下に関わるアンジオテンシン受容体の過剰な活性化をATRAPで改善できる
|
研究の背景
現代の高カロリー摂取や運動不足などの生活習慣に伴う肥満・メタボリック症候群は、先進国を中心に増加傾向にあり、世界的な問題となっています。肥満・メタボリック症候群では、全身のインスリン抵抗性が引き起こされ、糖尿病へと進展し、全身動脈硬化により心筋梗塞や脳卒中など生命を脅かす疾患に至る危険性が高まります。
メタボリック症候群の病態形成において、レニン-アンジオテンシン系(RAS)の関わりが注目されており、アンジオテンシンII(Ang II)産生の増大、特に1型アンジオテンシン受容体(AT1受容体)経路の過剰活性化が関わることが報告されています。研究グループは過去に、AT1受容体に結合して同受容体の過剰な活性化を抑制する蛋白として、ATRAPを発見しました。そして、過食による肥満・メタボリック症候群の発症・進展には、脂肪組織におけるATRAPの発現量低下が関与し、これを増加させることで、食事性肥満にともなう脂肪組織の炎症やアディポカイン障害を改善し、メタボリック症候群を抑制できることを報告してきました(文献2、3、4)。しかしながら、実際には、肥満をともなわないインスリン抵抗性(やせ型インスリン抵抗性)の患者も存在し、やせ型インスリン抵抗性の発症・進展におけるAT1受容体およびATRAPの関わりは今までよくわかっていませんでした。
メタボリック症候群の病態形成において、レニン-アンジオテンシン系(RAS)の関わりが注目されており、アンジオテンシンII(Ang II)産生の増大、特に1型アンジオテンシン受容体(AT1受容体)経路の過剰活性化が関わることが報告されています。研究グループは過去に、AT1受容体に結合して同受容体の過剰な活性化を抑制する蛋白として、ATRAPを発見しました。そして、過食による肥満・メタボリック症候群の発症・進展には、脂肪組織におけるATRAPの発現量低下が関与し、これを増加させることで、食事性肥満にともなう脂肪組織の炎症やアディポカイン障害を改善し、メタボリック症候群を抑制できることを報告してきました(文献2、3、4)。しかしながら、実際には、肥満をともなわないインスリン抵抗性(やせ型インスリン抵抗性)の患者も存在し、やせ型インスリン抵抗性の発症・進展におけるAT1受容体およびATRAPの関わりは今までよくわかっていませんでした。
研究の内容
野生型マウスに、低用量のAng IIを慢性的に投与すると、体重、脂肪重量や血圧に明らかな変化を及ぼさずにインスリン抵抗性が生じました。そこで血液中の糖取り込みに重要な役割を果たす骨格筋を調べてみると、Ang II投与によって、AT1受容体の下流経路の一つであるp38 MAPK*2活性化と、酸化ストレス増大が生じ、糖輸送体GLUT4*3の発現低下が認められました。一方、脂肪組織では、Ang II投与による炎症や酸化ストレス増大などの変化を認めませんでした。これに対して、脂肪組織および骨格筋組織でATRAPの発現を増加させたマウスでは、Ang IIを慢性投与しても、野生型マウスでみられたインスリン抵抗性の増悪を認めませんでした。詳細に調べてみると、ATRAPの発現量が増加したマウスでは、野生型マウスでみられた骨格筋での酸化ストレス増大-p38MAPK活性化-GLUT4発現低下による糖取り込みの減少が抑制されていました。一方で、脂肪組織においては形態的・機能的変化は認められませんでした。これらのことから、生体での循環Ang IIの増加は、骨格筋組織でのAT1受容体の過剰活性化を引き起こして糖取り込みに影響することで、インスリン抵抗性を引き起こすと考えられました(図)。
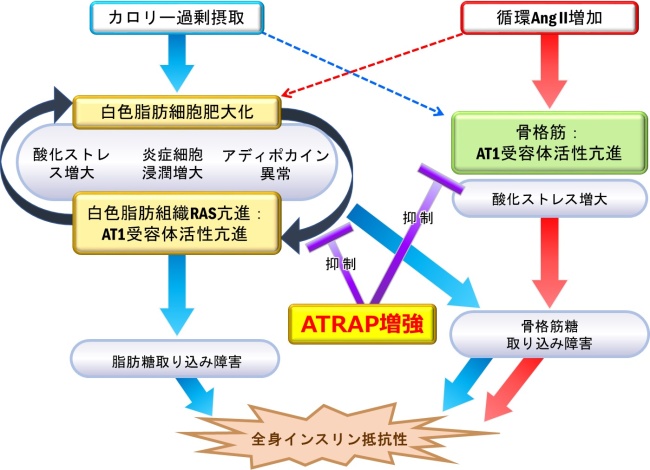 (図)カロリー過剰摂取は、主に白色脂肪組織の炎症惹起とAT1受容体経路の過剰活性化により、脂肪組織および骨格筋の糖取り込み障害を引き起こす。一方、循環Ang II増大は、骨格筋のAT1受容体系の活性化から酸化ストレスを増大させ、骨格筋の糖取り込み障害を引き起こす。
(図)カロリー過剰摂取は、主に白色脂肪組織の炎症惹起とAT1受容体経路の過剰活性化により、脂肪組織および骨格筋の糖取り込み障害を引き起こす。一方、循環Ang II増大は、骨格筋のAT1受容体系の活性化から酸化ストレスを増大させ、骨格筋の糖取り込み障害を引き起こす。
今後の展開
本研究の意義は、肥満、脂質異常や血圧上昇を伴わずとも、RAS過剰亢進により骨格筋での糖取り込みが低下しインスリン抵抗性が生じ得ることを明らかにした点です。これまでは、メタボリック症候群の主体である内臓脂肪型肥満に付随する脂肪組織RAS亢進と血圧上昇、インスリン抵抗性の関わりが注目されてきましたが、今回の研究成果により、やせ型で血圧正常範囲の健常者の中にも、インスリン抵抗性、延いては糖尿病進展への病態を抱えている人が隠れている可能性があると考えられます。
また、これまでの研究と合わせて、脂肪組織や骨格筋でのATRAPの活性化が、肥満だけでなく非肥満状態においてもAT1受容体の過剰な活性化を抑制することで、インスリン抵抗性を改善させることがわかりました。さらに、AT1受容体系の完全な遮断は、脂肪細胞分化障害などを介し、かえってインスリン抵抗性を増悪させてしまうのに対して、ATRAP活性化は組織の分化障害を起こさずに、AT1受容体の過剰な活性のみを選択的に抑制するという機能上の大きな利点をもつこともわかっています。したがって、今後開発が期待されるATRAP活性化治療によって、効率的に糖尿病の発症を抑制できる可能性があり、国民の健康増進に大きく貢献できると考えられます。
また、これまでの研究と合わせて、脂肪組織や骨格筋でのATRAPの活性化が、肥満だけでなく非肥満状態においてもAT1受容体の過剰な活性化を抑制することで、インスリン抵抗性を改善させることがわかりました。さらに、AT1受容体系の完全な遮断は、脂肪細胞分化障害などを介し、かえってインスリン抵抗性を増悪させてしまうのに対して、ATRAP活性化は組織の分化障害を起こさずに、AT1受容体の過剰な活性のみを選択的に抑制するという機能上の大きな利点をもつこともわかっています。したがって、今後開発が期待されるATRAP活性化治療によって、効率的に糖尿病の発症を抑制できる可能性があり、国民の健康増進に大きく貢献できると考えられます。
用語説明
*1 生活習慣病増悪因子結合受容体(1型アンジオテンシン受容体)に直接結合し、その機能を制御する低分子蛋白(AT1 receptor-associated protein; ATRAP)(文献2、3、4)
*2 MAPK(mitogen-activated protein kinase)ファミリーに属するセリンスレオニンキナーゼで、アポトーシスや炎症、細胞増殖などに関与する
*3 骨格筋で糖取り込みの働きを担う主要なトランスポーター(glucose transporter isoform 4; GLUT 4)
References
Angiotensin II Type 1 Receptor-associated Protein Inhibits Angiotensin II-induced Insulin Resistance with Suppression of Oxidative Stress in Skeletal Muscle Tissue.
Ohki K, Wakui H, Kishio N, Azushima K, Uneda K, Haku S, Kobayashi R, Haruhara K, Kinguchi S, Yamaji T, Yamada T, Minegishi S, Ishigami T, Toya Y, Yamashita A, Imajo K, Nakajima A, Kato I, Ohashi K, Tamura K. Scientific Reports. 2018. doi: 10.1038/s41598-018-21270-8.
(文献2)
Adipocyte-Specific Enhancement of Angiotensin II Type 1 Receptor-Associated Protein Ameliorates Diet-Induced Visceral Obesity and Insulin Resistance.
Azushima K, Ohki K, Wakui H, Uneda K, Haku S, Kobayashi R, Haruhara K, Kinguchi S, Matsuda M, Maeda A, Toya Y, Yamashita A, Umemura S, Tamura K.
J Am Heart Assoc. 2017;6(3):e004488. doi: 10.1161/JAHA.116.004488.
(文献3)
ATRAP Expression in Brown Adipose Tissue Does Not Influence the Development of Diet-Induced Metabolic Disorders in Mice.
Ohki K, Wakui H, Azushima K, Uneda K, Haku S, Kobayashi R, Haruhara K, Kinguchi S, Matsuda M, Ohsawa M, Maeda A, Minegishi S, Ishigami T, Toya Y, Yamashita A, Umemura S, Tamura K.
Int J Mol Sci. 2017;18(3): E676. doi: 10.3390/ijms18030676.
(文献4)
Angiotensin receptor-binding protein ATRAP/Agtrap inhibits metabolic dysfunction with visceral obesity.
Maeda A, Tamura K, Wakui H, Dejima T, Ohsawa M, Azushima K, Kanaoka T, Uneda K, Matsuda M, Yamashita A, Miyazaki N, Yatsu K, Hirawa N, Toya Y, Umemura S.
J Am Heart Assoc. 2013;2(4):e000312. doi: 10.1161/JAHA.113.000312.
※本研究は、日本学術振興会の研究補助金、一般財団法人 横浜総合医学振興財団、公益財団法人 先進医薬研究振興財団、公益財団法人 かなえ医薬振興財団、公益財団法人 MSD生命科学財団、公益財団法人 上原記念生命科学財団、公益財団法人 ソルト・サイエンス研究財団、および国立研究開発法人日本医療研究開発機構(AMED)などによる研究助成を受けて行われました。
Ohki K, Wakui H, Kishio N, Azushima K, Uneda K, Haku S, Kobayashi R, Haruhara K, Kinguchi S, Yamaji T, Yamada T, Minegishi S, Ishigami T, Toya Y, Yamashita A, Imajo K, Nakajima A, Kato I, Ohashi K, Tamura K. Scientific Reports. 2018. doi: 10.1038/s41598-018-21270-8.
(文献2)
Adipocyte-Specific Enhancement of Angiotensin II Type 1 Receptor-Associated Protein Ameliorates Diet-Induced Visceral Obesity and Insulin Resistance.
Azushima K, Ohki K, Wakui H, Uneda K, Haku S, Kobayashi R, Haruhara K, Kinguchi S, Matsuda M, Maeda A, Toya Y, Yamashita A, Umemura S, Tamura K.
J Am Heart Assoc. 2017;6(3):e004488. doi: 10.1161/JAHA.116.004488.
(文献3)
ATRAP Expression in Brown Adipose Tissue Does Not Influence the Development of Diet-Induced Metabolic Disorders in Mice.
Ohki K, Wakui H, Azushima K, Uneda K, Haku S, Kobayashi R, Haruhara K, Kinguchi S, Matsuda M, Ohsawa M, Maeda A, Minegishi S, Ishigami T, Toya Y, Yamashita A, Umemura S, Tamura K.
Int J Mol Sci. 2017;18(3): E676. doi: 10.3390/ijms18030676.
(文献4)
Angiotensin receptor-binding protein ATRAP/Agtrap inhibits metabolic dysfunction with visceral obesity.
Maeda A, Tamura K, Wakui H, Dejima T, Ohsawa M, Azushima K, Kanaoka T, Uneda K, Matsuda M, Yamashita A, Miyazaki N, Yatsu K, Hirawa N, Toya Y, Umemura S.
J Am Heart Assoc. 2013;2(4):e000312. doi: 10.1161/JAHA.113.000312.
※本研究は、日本学術振興会の研究補助金、一般財団法人 横浜総合医学振興財団、公益財団法人 先進医薬研究振興財団、公益財団法人 かなえ医薬振興財団、公益財団法人 MSD生命科学財団、公益財団法人 上原記念生命科学財団、公益財団法人 ソルト・サイエンス研究財団、および国立研究開発法人日本医療研究開発機構(AMED)などによる研究助成を受けて行われました。
お問い合わせ先
学術院医学群 循環器・腎臓・高血圧内科学涌井広道
主任教授 田村功一
E-mail:hiro1234@yokohama-cu.ac.jp(涌井)
tamukou@med.yokohama-cu.ac.jp(田村)
TEL:045-787-2635 FAX:045-701-3738
(取材対応窓口、資料請求など)
研究企画・産学連携推進課長渡邊 誠
TEL:045-787-2510E-Mail:kenki@yokohama-cu.ac.jp