タンパク質分解酵素MMP-7が悪性のがん組織でがんの転移を促進するメカニズムを解明
2017.12.19
- TOPICS
- 研究
- 病院
- 医療
タンパク質分解酵素MMP-7が悪性のがん組織でがんの転移を促進するメカニズムを解明
~『Journal of Biological Chemistry』に掲載~
横浜市立大学 大学院生命ナノシステム科学研究科 東 昌市教授らの研究グループは、本学先端医科学研究センターの木村弥生准教授、平野 久学長補佐との共同研究により、悪性がん組織に高発現するタンパク質分解酵素MMP-7が、がん細胞表層の細胞膜タンパク質HAI-1*1の切断を介してがん細胞の凝集を誘導することを明らかにしました。MMP-7の作用でがん細胞が凝集するとその転移能が顕著に増強されることから、HAI-1の切断が、そのがん転移促進機構において重要なステップであることが示唆されました。
| 研究成果のポイント 〇MMP-7が、がん細胞表層の細胞膜タンパク質HAI-1を切断することで産生されるHAI-1断片(sHAI-1)が、がん細胞の凝集を引き起こすことを明らかにした。
〇MMP-7によりがん細胞間の接着が誘導されると、がん細胞の転移能が顕著に増強されることから、sHAI-1はがん転移抑制の新たな標的分子となることが示唆された。
|
研究の背景
悪性のがん組織では、マトリックスメタロプロテアーゼ(MMPs)*2とよばれるタンパク質分解酵素が高発現しており、がん細胞周囲のタンパク質を分解することで浸潤・転移に寄与すると考えられています。MMP-7は大腸がん組織等で発現がみられるMMPsの一つですが、その発現量は大腸がんの悪性度(がんが浸潤・転移する能力)と高い相関を示します。東教授らは、これまでの研究で、大腸がん細胞を活性型MMP-7で処理すると、がん細胞の凝集が誘導され、肝臓への転移が著しく促進されることを見出しました(Kioi et al. Oncogene 2003)。がん細胞の転移は、血管内に侵入したがん細胞が血流により運ばれ、運ばれた先の臓器の毛細血管内に留まり血管外へ移動して組織内で増殖することにより成立します。がん細胞の凝集によりがんの転移が促進される理由として、がん細胞が凝集により転移する先の臓器の毛細血管に留まり易くなることなどが考えられます。
また、MMP-7ががん細胞表層のコレステロール硫酸(CS)という脂質を介して細胞表面に結合することを明らかにし、CSが存在する脂質ラフトと呼ばれる領域にある細胞膜タンパク質を切断することを予想しました(Yamamoto et al. J Biol Chem 2006)。さらに、CSとの結合に重要なMMP-7分子内のアミノ酸残基を同定し、このアミノ酸を置換するとMMP-7ががん細胞間の接着を誘導しなくなることも明らかにしました(Higashi et al. J Biol Chem 2008)。しかし、MMP-7によって切断され、細胞間の接着に関わる細胞膜タンパク質は長い間不明のままでした。これは細胞内タンパク質や分泌タンパク質と比較して微量である細胞膜タンパク質を網羅的に解析することが困難であったことに起因しますが、MMP-7がどのような分子メカニズムでがん細胞を凝集させ、転移を促進するのかについて明らかにするためには、その細胞膜タンパク質の同定が必要でした。
また、MMP-7ががん細胞表層のコレステロール硫酸(CS)という脂質を介して細胞表面に結合することを明らかにし、CSが存在する脂質ラフトと呼ばれる領域にある細胞膜タンパク質を切断することを予想しました(Yamamoto et al. J Biol Chem 2006)。さらに、CSとの結合に重要なMMP-7分子内のアミノ酸残基を同定し、このアミノ酸を置換するとMMP-7ががん細胞間の接着を誘導しなくなることも明らかにしました(Higashi et al. J Biol Chem 2008)。しかし、MMP-7によって切断され、細胞間の接着に関わる細胞膜タンパク質は長い間不明のままでした。これは細胞内タンパク質や分泌タンパク質と比較して微量である細胞膜タンパク質を網羅的に解析することが困難であったことに起因しますが、MMP-7がどのような分子メカニズムでがん細胞を凝集させ、転移を促進するのかについて明らかにするためには、その細胞膜タンパク質の同定が必要でした。
研究の内容
今回、がん細胞表層のタンパク質をビオチンで標識した後、この細胞をMMP-7処理することで特異的に細胞外へ切り出される標識タンパク質の断片を、質量分析を用いて調べたところ、MMP-7によって切断される細胞膜タンパク質がhepatocyte growth factor activator inhibitor type 1 (HAI-1)であることをつき止めました。また、細胞表層からCSを除去した場合、MMP-7によるHAI-1切断が起こらなくなることや、アミノ酸置換によりCS結合能を失ったMMP-7改変体ではHAI-1切断を起さないことが判明し、HAI-1切断が細胞表層のCSに結合したMMP-7により触媒されることを明らかにしました。さらに、MMP-7によって切り出されたHAI-1の細胞外領域(soluble HAI-1, sHAI-1)に細胞間接着活性があることを明らかにするとともに、その活性を担うHAI-1分子内領域の同定に成功しました(図1)。
興味深いことに、sHAI-1の存在下ではCS除去細胞をMMP-7で処理した場合、あるいはCS結合能を失ったMMP-7改変体で細胞を処理した場合でも細胞凝集が誘導されましたが、MMP-7処理を行わないとsHAI-1が存在していても細胞凝集は起きないことが分かりました。したがって、sHAI-1が細胞間接着を引き起こすためには、CSと結合していないMMP-7が細胞表層に作用することが必要であることが判明しました。これらの結果から、MMP-7とMMP-7のHAI-1切断によって産生されるsHAI-1が、がん転移を促進するがん細胞凝集において不可欠であることが明らかとなり、sHAI-1ががん転移抑制のための新規標的分子と成り得ることが示唆されました。
興味深いことに、sHAI-1の存在下ではCS除去細胞をMMP-7で処理した場合、あるいはCS結合能を失ったMMP-7改変体で細胞を処理した場合でも細胞凝集が誘導されましたが、MMP-7処理を行わないとsHAI-1が存在していても細胞凝集は起きないことが分かりました。したがって、sHAI-1が細胞間接着を引き起こすためには、CSと結合していないMMP-7が細胞表層に作用することが必要であることが判明しました。これらの結果から、MMP-7とMMP-7のHAI-1切断によって産生されるsHAI-1が、がん転移を促進するがん細胞凝集において不可欠であることが明らかとなり、sHAI-1ががん転移抑制のための新規標的分子と成り得ることが示唆されました。
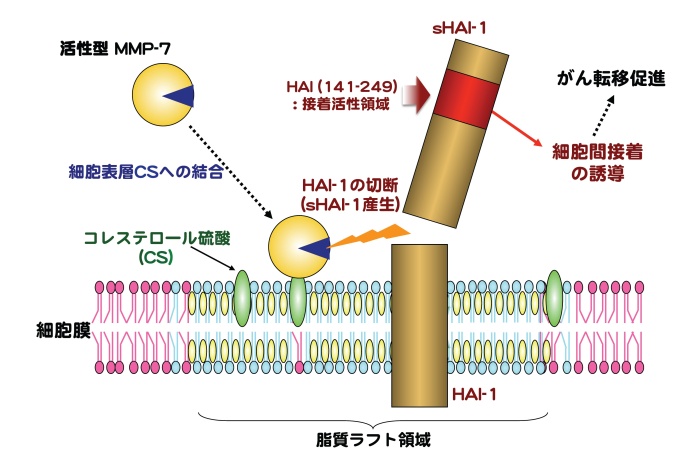 図1MMP-7による細胞間接着誘導とがん転移促進の分子メケニズム
図1MMP-7による細胞間接着誘導とがん転移促進の分子メケニズム
今後の展開
現在までに、MMP-7の酵素活性を特異的に阻害する薬剤は開発されていませんが、これは20種類以上存在するMMPsの活性部位が互いに良く似た構造を持っており、それぞれのMMPに特異的な阻害剤の設計が困難であることが原因であると考えられています。一方、特異性の低いMMPs阻害剤は重篤な副作用を示すことが報告されており、これらを用いてMMP-7のがん転移促進効果を抑制することは大きなリスクを伴うことが予想されます。
今回MMP-7によるHAI-1切断を介した細胞間接着誘導のメカニズムが明らかになったことにより、MMP-7ではなく、sHAI-1を分子標的とすることで、MMP-7が促進するがん転移を効果的に抑制できることが期待されます。
今回MMP-7によるHAI-1切断を介した細胞間接着誘導のメカニズムが明らかになったことにより、MMP-7ではなく、sHAI-1を分子標的とすることで、MMP-7が促進するがん転移を効果的に抑制できることが期待されます。
用語説明
*1hepatocyte growth factor activator inhibitor type 1(HAI-1):肝細胞増殖因子(hepatocyte growth factor, HGF)の活性化に関わるタンパク質分解酵素HGFA(HGF activator)の酵素活性を制御するインヒビタータンパク質として最初に見出された。HAI-1はI型細胞膜タンパク質(細胞膜貫通型タンパク質のうち、アミノ末端が細胞外、カルボキシ末端が細胞内にあるもの)として細胞表面に存在し、その細胞外領域にHGFA阻害活性を持つKunitz型インヒビタードメインを含んでいる。
*2マトリックスメタロプロテアーゼ(MMPs):酵素活性中心に金属イオン(亜鉛イオン)を持ち、コラーゲンなど、動物組織内の細胞周囲に存在するタンパク質(細胞外マトリックスタンパク質)を主な基質とするタンパク質分解酵素。近年ではMMPsが細胞増殖因子の活性化や細胞表面のタンパク質の切断修飾を介して細胞機能や細胞微小環境の調節に重要な役割を持つことが判明しており、それらの活性調節の乱れががん悪性進展をはじめとした様々な疾患の病態に関与すると考えられている。
*2マトリックスメタロプロテアーゼ(MMPs):酵素活性中心に金属イオン(亜鉛イオン)を持ち、コラーゲンなど、動物組織内の細胞周囲に存在するタンパク質(細胞外マトリックスタンパク質)を主な基質とするタンパク質分解酵素。近年ではMMPsが細胞増殖因子の活性化や細胞表面のタンパク質の切断修飾を介して細胞機能や細胞微小環境の調節に重要な役割を持つことが判明しており、それらの活性調節の乱れががん悪性進展をはじめとした様々な疾患の病態に関与すると考えられている。
掲載論文
Matrix metalloproteinase-7 induces homotypic tumor cell aggregation via proteolytic cleavage of the membrane-bound Kunitz-type inhibitor HAI-1
Tomohiro Ishikawa, Yayoi Kimura, Hisashi Hirano and Shouichi Higashi
Journal of Biological Chemistry, October 18, 2017, doi: 10.1074/jbc.M117.796789
※本研究は、米国科学雑誌『Journal of Biological Chemistry』に掲載されました。(December 15, 2017 issue)
※本研究は、イノベーションシステム整備事業「翻訳後修飾プロテオミクス医療研究拠点の形成」、横浜市立大学学術的研究推進事業「産学連携等支援プロジェクト」、文部科学省科学研究費補助金(挑戦的萌芽研究)、金沢大学がん進展制御研究所共同研究費などの助成により行われました。
Tomohiro Ishikawa, Yayoi Kimura, Hisashi Hirano and Shouichi Higashi
Journal of Biological Chemistry, October 18, 2017, doi: 10.1074/jbc.M117.796789
※本研究は、米国科学雑誌『Journal of Biological Chemistry』に掲載されました。(December 15, 2017 issue)
※本研究は、イノベーションシステム整備事業「翻訳後修飾プロテオミクス医療研究拠点の形成」、横浜市立大学学術的研究推進事業「産学連携等支援プロジェクト」、文部科学省科学研究費補助金(挑戦的萌芽研究)、金沢大学がん進展制御研究所共同研究費などの助成により行われました。
お問い合わせ先
(研究内容に関するお問い合わせ)
大学院生命ナノシステム科学研究科教授東昌市
TEL:045-787-2380E-mail:shigashi@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
研究企画・産学連携推進課長渡邊誠
TEL:045-787-2510E-Mail:sentan@yokohama-cu.ac.jp
大学院生命ナノシステム科学研究科教授東昌市
TEL:045-787-2380E-mail:shigashi@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
研究企画・産学連携推進課長渡邊誠
TEL:045-787-2510E-Mail:sentan@yokohama-cu.ac.jp