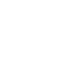iPS細胞を用いてヒト肝臓発生の複雑なメカニズムを解明~再生医療の実現を加速~
2017.06.15
- TOPICS
- 研究
- 医療
iPS細胞を用いてヒト肝臓発生の複雑なメカニズムを解明~再生医療の実現を加速~
英国科学誌『Nature』に掲載
横浜市立大学 学術院医学群 臓器再生医学 関根圭輔助教、武部貴則准教授、谷口英樹教授らの研究グループは、ドイツ・マックスプランク研究所のBarbara Treutlein、シンシナティ小児病院と共同で最先端の1細胞遺伝子発現解析技術を駆使したビッグデータ解析により、ヒトiPS細胞からミニ肝臓*1の形成過程で生じる多細胞間の相互作用を解析し、ヒトの肝臓発生に重要かつ複雑な分子メカニズムを世界で初めて明らかにしました。そして、本研究グループが2013年に確立したミニ肝臓作製技術は、従来のヒト肝細胞作製技術と比べ、血管形成促進作用を含むさまざまな性能において優れている可能性が示唆されました。
本研究で得られたビッグデータは、今まで研究が困難であったヒトの臓器発生に関する基礎研究のための画期的なツールとなるのみならず、iPS細胞から作製したミニ肝臓の機能性や安全性を評価するための重要な基盤情報となります。これらの情報を活用することで、ヒトiPS細胞を用いたミニ肝臓の品質を安定化するための手法の確立が期待され、再生医療や創薬応用が飛躍的に加速されます。
研究の背景
多種類の細胞で構成される複雑なヒト臓器の発生過程においては、臓器を構成する異なる細胞間における相互作用が、機能を発揮する上で重要な役割を担うと考えられています。これらを解明することは、ヒトにおける臓器発生の基礎生物学的知見を得ることに重要なばかりか、将来の再生医療応用のために用いる細胞や組織を構成する細胞の機能性や安全性を厳密に評価することが極めて重要です。しかしながら、マウスなどの動物を対象とした研究とは大きく異なり、ヒト臓器の発生・成熟における細胞間相互作用を明らかにするための有効なツールが存在しないために、これまでその実体はほとんど明らかになっていませんでした。
一方、横浜市立大学の研究グループは、2013年にヒトiPS細胞から分化誘導した肝内胚葉細胞、血管内皮細胞、間葉系細胞を最適な比率・培養液・細胞外基質上で培養することにより、肝臓の基となる立体的な肝臓の原基(肝芽、ミニ肝臓)をin vitro培養条件下で創出する画期的な細胞培養技術を確立しています(Nature 499(7459): 481-4, 2013 )。これまでに、人為的に作製したミニ肝臓は、生体内における臓器発生の初期段階で形成される肝臓に極めて類似していたことから、ヒト臓器発生現象に迫るための有効なツールと考えられていました。
本研究では、ミニ肝臓発生過程で生じる多細胞間で生じる生命現象の全容解明を目指し、 独自の組織創出技術であるミニ肝臓を対象として、1細胞レベルの全遺伝子発現情報の取得を行いました。さらに、複雑なビックデータ解析技術を活用することにより、ミニ肝臓発生段階では、血管化を促進する遺伝子群を始めとして多様な分子シグナルが活性化することを見いだしました。このような極めて精度の高い解析手法を活用することにより、 将来的に、再生医療に用いるヒトiPS細胞から作製した細胞や組織を対象とした画期的な品質評価手法が確立できるものと期待されます。これにより従来の評価手法では困難であった、分化誘導した細胞のバラツキ、例えば分化細胞の割合や未分化iPS細胞が残存する割合を精度高く評価することが可能となります。
一方、横浜市立大学の研究グループは、2013年にヒトiPS細胞から分化誘導した肝内胚葉細胞、血管内皮細胞、間葉系細胞を最適な比率・培養液・細胞外基質上で培養することにより、肝臓の基となる立体的な肝臓の原基(肝芽、ミニ肝臓)をin vitro培養条件下で創出する画期的な細胞培養技術を確立しています(Nature 499(7459): 481-4, 2013 )。これまでに、人為的に作製したミニ肝臓は、生体内における臓器発生の初期段階で形成される肝臓に極めて類似していたことから、ヒト臓器発生現象に迫るための有効なツールと考えられていました。
本研究では、ミニ肝臓発生過程で生じる多細胞間で生じる生命現象の全容解明を目指し、 独自の組織創出技術であるミニ肝臓を対象として、1細胞レベルの全遺伝子発現情報の取得を行いました。さらに、複雑なビックデータ解析技術を活用することにより、ミニ肝臓発生段階では、血管化を促進する遺伝子群を始めとして多様な分子シグナルが活性化することを見いだしました。このような極めて精度の高い解析手法を活用することにより、 将来的に、再生医療に用いるヒトiPS細胞から作製した細胞や組織を対象とした画期的な品質評価手法が確立できるものと期待されます。これにより従来の評価手法では困難であった、分化誘導した細胞のバラツキ、例えば分化細胞の割合や未分化iPS細胞が残存する割合を精度高く評価することが可能となります。
 (図1)ヒトiPS細胞から創出したミニ肝臓、およびミニ肝臓の材料となる肝内胚葉細胞と血管内皮細胞、間葉系細胞それぞれについて、細胞を分散し、ひとつひとつばらばらの状態で捕捉します。それぞれの細胞の全発現遺伝子情報を次世代シークエンサーを用いて解読し、ビッグデータ解析により、視覚的に理解できるように分類・整理して解析しました。
(図1)ヒトiPS細胞から創出したミニ肝臓、およびミニ肝臓の材料となる肝内胚葉細胞と血管内皮細胞、間葉系細胞それぞれについて、細胞を分散し、ひとつひとつばらばらの状態で捕捉します。それぞれの細胞の全発現遺伝子情報を次世代シークエンサーを用いて解読し、ビッグデータ解析により、視覚的に理解できるように分類・整理して解析しました。
研究の内容
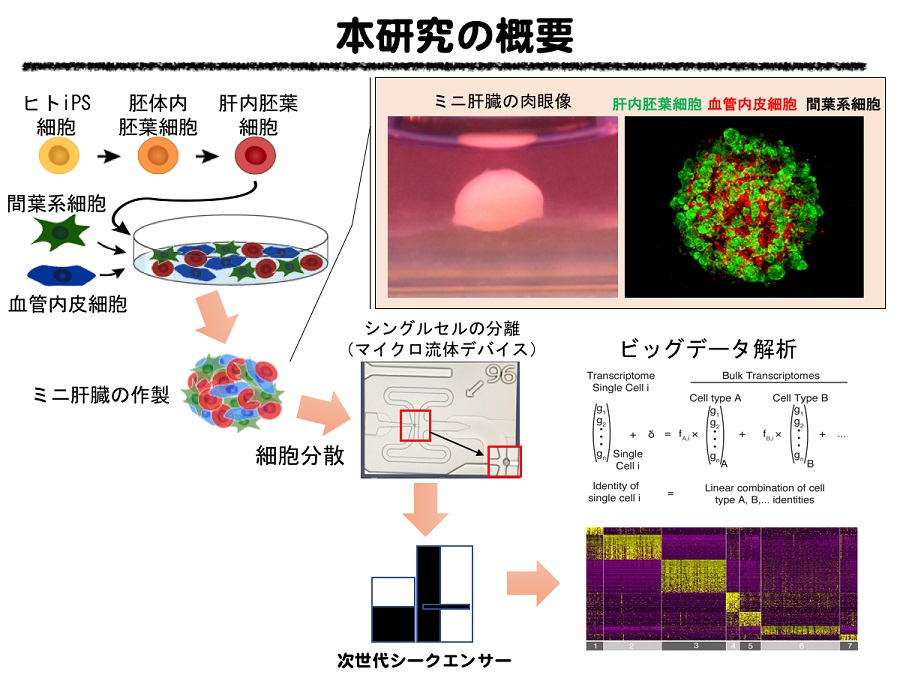
本研究では、細胞ひとつひとつを対象として、全ての遺伝子発現を次世代シークエンサー*2により評価するシングルセルRNAシークエンス*3という手法を用いて、立体的なミニ肝臓でみられる複数の細胞種間の相互作用を解析しました(図1)。ヒトiPS細胞から分化誘導されたミニ肝臓の材料となる各種の細胞、および、これらの細胞から創出されたミニ肝臓について、1細胞レベルで全遺伝子の発現情報を取得し、総計1,949細胞に関する膨大な遺伝子の発現情報を、バイオインフォマティックス技術を駆使して、視覚的に理解できるように分類・整理して解析しました。この新しい細胞評価法を用いると、ヒトiPS細胞から分化誘導した細胞のバラツキや未分化iPS細胞の残存などを精度高く評価することが可能となります(図2)。
 (図2)なぜ1細胞遺伝子発現解析が必要か?
(図2)なぜ1細胞遺伝子発現解析が必要か?
(1)ミニ肝臓形成における多細胞メカニズムの解明(図3)
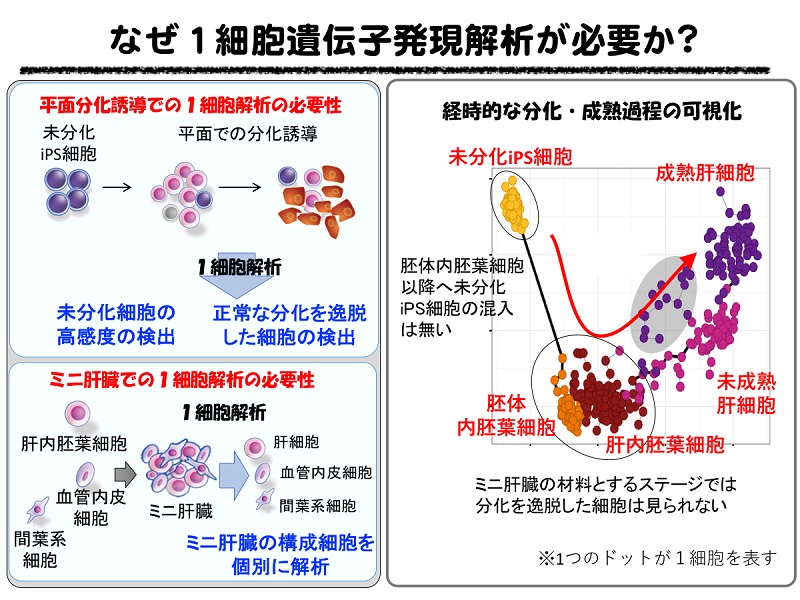
ヒトiPS細胞から平面培養により単一の細胞種として分化誘導した肝細胞と、ミニ肝臓内の肝細胞における遺伝子発現の変化を1細胞レベルで解析しました。その結果、どちらの培養でも肝細胞の分化・成熟に重要な遺伝子群の経時的な発現パターンがみられるなど、生体内における肝臓発生をおおむね再現していることが明らかとなりました。生体内のヒト肝細胞、平面培養したヒト肝細胞、ミニ肝臓内のヒト肝細胞を比較したところ、平面培養で分化誘導した肝細胞に比べて、ミニ肝臓内の肝細胞は生体内の肝細胞により高い相関を持つことが明らかとなりました。これが、平面培養した肝細胞に比べ、ミニ肝臓の方が肝障害に対する高い治療効果が得られることの理由のひとつではないかと考えられます。
ヒトiPS細胞から平面培養により単一の細胞種として分化誘導した肝細胞と、ミニ肝臓内の肝細胞における遺伝子発現の変化を1細胞レベルで解析しました。その結果、どちらの培養でも肝細胞の分化・成熟に重要な遺伝子群の経時的な発現パターンがみられるなど、生体内における肝臓発生をおおむね再現していることが明らかとなりました。生体内のヒト肝細胞、平面培養したヒト肝細胞、ミニ肝臓内のヒト肝細胞を比較したところ、平面培養で分化誘導した肝細胞に比べて、ミニ肝臓内の肝細胞は生体内の肝細胞により高い相関を持つことが明らかとなりました。これが、平面培養した肝細胞に比べ、ミニ肝臓の方が肝障害に対する高い治療効果が得られることの理由のひとつではないかと考えられます。
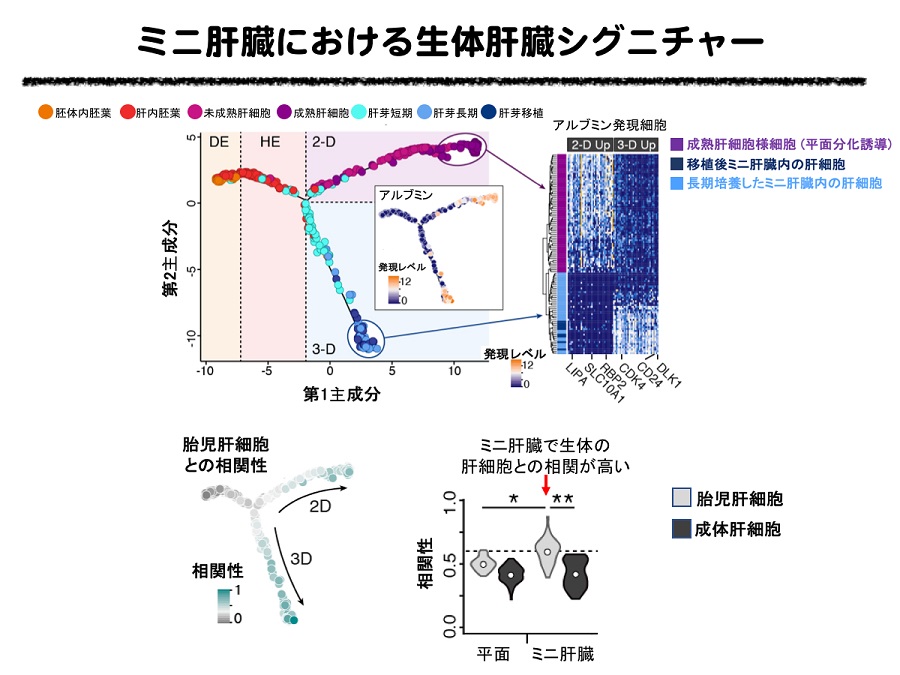 (図3)(i)右方向に進むに連れて代謝能など肝細胞としての成熟度が増す(横軸)。平面培養(2-D)、ミニ肝臓(3-D)、どちらの培養でもアルブミンなど肝細胞の分化・成熟に重要な遺伝子群の経時的な発現パターンがみられる。しかし、培養方法の違いにより、発現に違いがある遺伝子も見られた(縦軸および上段右)。1つのドットが1細胞を表す。 (ii)胎児肝細胞との相関性を比較すると、平面培養で分化誘導した肝細胞に比べて、ミニ肝臓内の肝細胞は生体内の肝細胞により高い相関を持つことが明らかとなりました(下段左および下段右赤矢印)。
(図3)(i)右方向に進むに連れて代謝能など肝細胞としての成熟度が増す(横軸)。平面培養(2-D)、ミニ肝臓(3-D)、どちらの培養でもアルブミンなど肝細胞の分化・成熟に重要な遺伝子群の経時的な発現パターンがみられる。しかし、培養方法の違いにより、発現に違いがある遺伝子も見られた(縦軸および上段右)。1つのドットが1細胞を表す。 (ii)胎児肝細胞との相関性を比較すると、平面培養で分化誘導した肝細胞に比べて、ミニ肝臓内の肝細胞は生体内の肝細胞により高い相関を持つことが明らかとなりました(下段左および下段右赤矢印)。
(2)ミニ肝臓における多様な細胞間相互作用に関わる活性化シグナルの同定(図4)
ミニ肝臓の材料となる各細胞について、それぞれの細胞が単独で存在する場合と、他の細胞種間との相互作用が誘導された後の状態での全遺伝子発現を比較することにより、ミニ肝臓の形成過程における複数細胞間における相互作用を解析しました。その結果、ミニ肝臓内では血管新生や細胞外基質に関するシグナル活性化など、活発な細胞間相互作用が誘導されることが明らかとなりました。データ解析で得られたシグナル経路を約70種類の低分子化合物により阻害実験を行った結果、抽出された複数のシグナルがミニ肝臓内での細胞間相互作用に実際に働いていることが明らかとなりました。さらに、いくつかのシグナル分子を、siRNA*5を用いて発現抑制すると、ミニ肝臓の機能が抑制されることが明らかとなり、ミニ肝臓の成熟化においてこれらの細胞種間シグナルが重要な役割を担うことが明らかとなりました。
ミニ肝臓の材料となる各細胞について、それぞれの細胞が単独で存在する場合と、他の細胞種間との相互作用が誘導された後の状態での全遺伝子発現を比較することにより、ミニ肝臓の形成過程における複数細胞間における相互作用を解析しました。その結果、ミニ肝臓内では血管新生や細胞外基質に関するシグナル活性化など、活発な細胞間相互作用が誘導されることが明らかとなりました。データ解析で得られたシグナル経路を約70種類の低分子化合物により阻害実験を行った結果、抽出された複数のシグナルがミニ肝臓内での細胞間相互作用に実際に働いていることが明らかとなりました。さらに、いくつかのシグナル分子を、siRNA*5を用いて発現抑制すると、ミニ肝臓の機能が抑制されることが明らかとなり、ミニ肝臓の成熟化においてこれらの細胞種間シグナルが重要な役割を担うことが明らかとなりました。
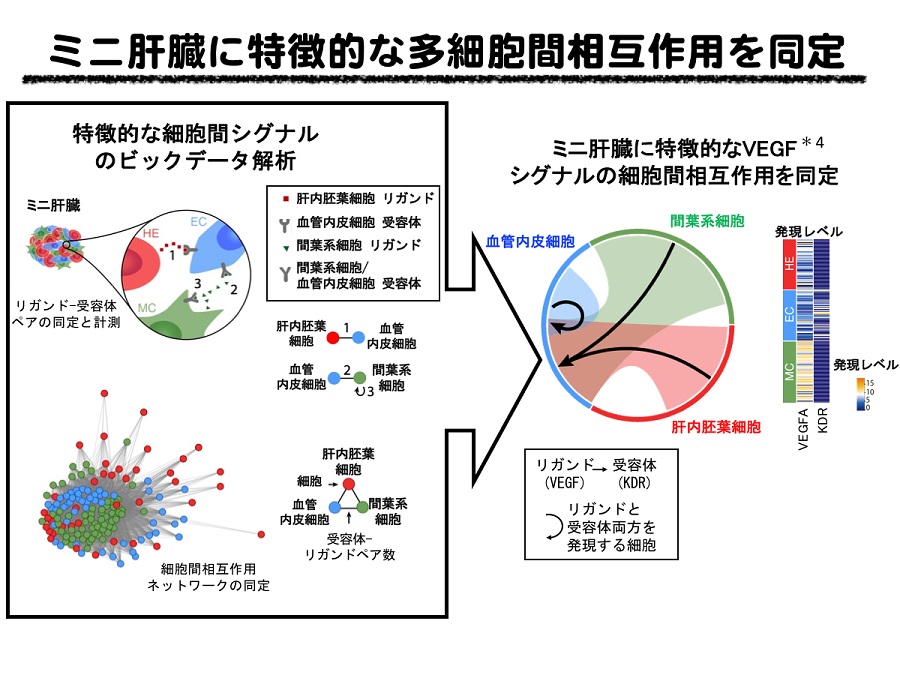 (図4) (図左上段) 細胞種間のシグナルの模式図。シグナル分子(リガンド)とそのシグナルの受け手(受容体)の数を計測 (図左下段) ミニ肝臓では細胞種間シグナルの数が飛躍的に増加した。 (図右) 肝内胚葉細胞、間葉系細胞から産生されるリガンド、VEGFが受容体であるKDRを介して血管内皮細胞に働き、ミニ肝臓の成熟化に重要な役割を担うことが明らかとなった。
(図4) (図左上段) 細胞種間のシグナルの模式図。シグナル分子(リガンド)とそのシグナルの受け手(受容体)の数を計測 (図左下段) ミニ肝臓では細胞種間シグナルの数が飛躍的に増加した。 (図右) 肝内胚葉細胞、間葉系細胞から産生されるリガンド、VEGFが受容体であるKDRを介して血管内皮細胞に働き、ミニ肝臓の成熟化に重要な役割を担うことが明らかとなった。
今後の展開
この研究により、ヒトiPS細胞から平面培養により分化誘導した肝細胞と比べて、三次元培養した立体的なミニ肝臓は、生体内のヒト肝細胞により近い状態に分化することが明確に証明されました。また、これらの解析により、ヒト肝臓の発生・成熟過程で起こるダイナミックな細胞間相互作用を世界で初めて解析することに成功しました。ミニ肝臓の作製技術は、再生医療応用に有益な基盤技術となるだけでなく、in vitroにおいて人為的にヒト臓器を立体的に構成することを可能にする点において、ヒューマンバイオロジーを解析するための新たな糸口となる技術であることが確認されました。従来、解析することが不可能であったヒト臓器の発生プロセスやヒト疾患の発症メカニズムの解明に関する新たな学術領域の扉が開かれ、将来的に大きく展開していくことが期待されます。
一方、ミニ肝臓の品質評価という観点においては、ヒトiPS細胞から肝細胞を平面的に分化誘導した各分化段階での細胞群の中には、未分化iPS細胞の残存は全くみられませんでした。また、ヒトiPS細胞が成熟肝細胞に成熟化するにつれて、各々の細胞間のバラツキが増すことが明らかとなりました。さらに、成熟肝細胞の中には分化過程から逸脱した細胞も一部存在することが明らかとなりました。その一方で、ミニ肝臓を作製するための細胞材料としている、ヒトiPS細胞由来の胚体内胚葉細胞、肝内胚葉細胞については、当初の予測よりも細胞間のバラツキが極めて少ないことが明らかとなりました。これらのことから、シングルセルRNAシークエンス法は再生医療に用いる細胞等の品質評価に極めて有効な基盤技術になると考えられます。今後、解析対象とする細胞数を著明に増加させるための手法、解析時間を短縮するための手法の開発などを進め、再生医療等製品の製造工程に実装可能な細胞評価技術として実用化することを将来的な目標としています。
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム」、国立研究開発法人科学技術振興機構(JST)「戦略的創造研究推進事業」の一環として行われました。
一方、ミニ肝臓の品質評価という観点においては、ヒトiPS細胞から肝細胞を平面的に分化誘導した各分化段階での細胞群の中には、未分化iPS細胞の残存は全くみられませんでした。また、ヒトiPS細胞が成熟肝細胞に成熟化するにつれて、各々の細胞間のバラツキが増すことが明らかとなりました。さらに、成熟肝細胞の中には分化過程から逸脱した細胞も一部存在することが明らかとなりました。その一方で、ミニ肝臓を作製するための細胞材料としている、ヒトiPS細胞由来の胚体内胚葉細胞、肝内胚葉細胞については、当初の予測よりも細胞間のバラツキが極めて少ないことが明らかとなりました。これらのことから、シングルセルRNAシークエンス法は再生医療に用いる細胞等の品質評価に極めて有効な基盤技術になると考えられます。今後、解析対象とする細胞数を著明に増加させるための手法、解析時間を短縮するための手法の開発などを進め、再生医療等製品の製造工程に実装可能な細胞評価技術として実用化することを将来的な目標としています。
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム」、国立研究開発法人科学技術振興機構(JST)「戦略的創造研究推進事業」の一環として行われました。
用語解説
*1ミニ肝臓:
ヒトiPS細胞から分化誘導した肝内胚葉細胞と、血管内皮細胞、間葉系細胞を最適な比率で混ぜ合わせることで、in vitro培養条件下で自律的に創出した肝臓の基となる立体的な肝芽(ミニ肝臓)のこと(Nature 499(7459): 481-4, 2013 ; Nature Protocol 9(2): 396-409, 2014 )。さらに、この革新的な3次元培養技術(器官原基法)を他器官の作製に応用し、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳から分離した細胞から3次元的な器官原基を創出することを報告している。創出された3次元器官原基は、移植後すみやかに血流を有する血管網を再構成し、機能的な組織を自律的に形成することができる(Cell Stem Cell. 16(5): 556-65, 2015 )。
*2次世代シークエンサー:
2000年代に登場したDNA配列情報を高速で取得する(シークエンス)機器の総称。従来のシークエンス機器と異なり、精度の高い大量のデータを短時間で取得することができるため、ゲノム全域に渡る遺伝子配列の決定や全遺伝子の発現情報の解析において強力な解析ツールとなる。
*3シングルセルRNAシークエンス:
ひとつひとつの細胞(シングルセル)における全発現遺伝子を次世代シークエンサーを用いて網羅的に解析する手法。細胞をひとつひとつばらばらの状態で補足し、ひとつひとつの細胞から超微量RNAを抽出、増幅し、DNAの状態にして次世代シークエンサーにより塩基配列を解読する。得られた塩基配列情報から、発現する遺伝子を特定し得られる数を数えることで発現量を測定する手法。一度に超大量のデータが得られるため、高度な情報解析が求められる。
*4VEGFシグナル(血管内皮細胞増殖因子):
血管内皮細胞に働き血管内皮細胞の生存や血管内皮細胞からの活性物質の産生誘導など、複雑な臓器形成のプロセスにおける血管形成において重要な役割を担うが、臓器形成におけるVEGFの産生細胞については不明な点が多かった。受容体であるKDR はVEGFに対し高い親和性で結合し、血管形成に関与する。
*5siRNA:
siRNA (small interfering RNA) とは21~23程度の塩基対から成る低分子二本鎖RNAである。siRNAを細胞内に導入することにより、RNA干渉(RNAi)が生じ、目的とする遺伝子の発現を配列特異的に抑制することができる。
ヒトiPS細胞から分化誘導した肝内胚葉細胞と、血管内皮細胞、間葉系細胞を最適な比率で混ぜ合わせることで、in vitro培養条件下で自律的に創出した肝臓の基となる立体的な肝芽(ミニ肝臓)のこと(Nature 499(7459): 481-4, 2013 ; Nature Protocol 9(2): 396-409, 2014 )。さらに、この革新的な3次元培養技術(器官原基法)を他器官の作製に応用し、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳から分離した細胞から3次元的な器官原基を創出することを報告している。創出された3次元器官原基は、移植後すみやかに血流を有する血管網を再構成し、機能的な組織を自律的に形成することができる(Cell Stem Cell. 16(5): 556-65, 2015 )。
*2次世代シークエンサー:
2000年代に登場したDNA配列情報を高速で取得する(シークエンス)機器の総称。従来のシークエンス機器と異なり、精度の高い大量のデータを短時間で取得することができるため、ゲノム全域に渡る遺伝子配列の決定や全遺伝子の発現情報の解析において強力な解析ツールとなる。
*3シングルセルRNAシークエンス:
ひとつひとつの細胞(シングルセル)における全発現遺伝子を次世代シークエンサーを用いて網羅的に解析する手法。細胞をひとつひとつばらばらの状態で補足し、ひとつひとつの細胞から超微量RNAを抽出、増幅し、DNAの状態にして次世代シークエンサーにより塩基配列を解読する。得られた塩基配列情報から、発現する遺伝子を特定し得られる数を数えることで発現量を測定する手法。一度に超大量のデータが得られるため、高度な情報解析が求められる。
*4VEGFシグナル(血管内皮細胞増殖因子):
血管内皮細胞に働き血管内皮細胞の生存や血管内皮細胞からの活性物質の産生誘導など、複雑な臓器形成のプロセスにおける血管形成において重要な役割を担うが、臓器形成におけるVEGFの産生細胞については不明な点が多かった。受容体であるKDR はVEGFに対し高い親和性で結合し、血管形成に関与する。
*5siRNA:
siRNA (small interfering RNA) とは21~23程度の塩基対から成る低分子二本鎖RNAである。siRNAを細胞内に導入することにより、RNA干渉(RNAi)が生じ、目的とする遺伝子の発現を配列特異的に抑制することができる。
掲載論文
Multilineage communication regulates human liver bud development from pluripotency
*J. Gray Camp, *Keisuke Sekine, Tobias Gerber, Henry Loeffler-Wirth, Hans Binder, Malgorzata Gac, Sabina Kanton, Jorge Kageyama, Georg Damm, Daniel Seehofer, Lenka Belicova, Marc Bickle, Rico Barsacchi, Ryo Okuda, Emi Yoshizawa, Masaki Kimura, Hiroaki Ayabe, Hideki Taniguchi, Takanori Takebe#, Barbara Treutlein#
*, # These authors contributed equally to this work
Nature, 14 June 2017, DOI: 10.1038/nature22796
*J. Gray Camp, *Keisuke Sekine, Tobias Gerber, Henry Loeffler-Wirth, Hans Binder, Malgorzata Gac, Sabina Kanton, Jorge Kageyama, Georg Damm, Daniel Seehofer, Lenka Belicova, Marc Bickle, Rico Barsacchi, Ryo Okuda, Emi Yoshizawa, Masaki Kimura, Hiroaki Ayabe, Hideki Taniguchi, Takanori Takebe#, Barbara Treutlein#
*, # These authors contributed equally to this work
Nature, 14 June 2017, DOI: 10.1038/nature22796
お問い合わせ先
(本資料の内容に関するお問い合わせ)
学術院医学群臓器再生医学助教 関根 圭輔、准教授 武部 貴則、教授 谷口 英樹
TEL&FAX:045-787-8963
E-mail:ksekine@yokohama-cu.ac.jp(関根)、ttakebe@yokohama-cu.ac.jp(武部)、rtanigu@yokohama-cu.ac.jp(谷口)
(取材対応窓口、資料請求など)
横浜市立大学研究企画・産学連携推進課長渡邊誠
Tel:045-787-2510
E-mail:sentan@yokohama-cu.ac.jp
(AMEDの事業について)
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課
Tel:03-6870-2220Fax:03-6870-2242
E-mail:saisei-ML@amed.go.jp
URL: http://www.amed.go.jp/
(JSTの事業について)
国立研究開発法人科学技術振興機構(JST)
戦略研究推進部川口哲
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:presto@ jst.go.jp
URL:http://www.jst.go.jp/kisoken/presto/
学術院医学群臓器再生医学助教 関根 圭輔、准教授 武部 貴則、教授 谷口 英樹
TEL&FAX:045-787-8963
E-mail:ksekine@yokohama-cu.ac.jp(関根)、ttakebe@yokohama-cu.ac.jp(武部)、rtanigu@yokohama-cu.ac.jp(谷口)
(取材対応窓口、資料請求など)
横浜市立大学研究企画・産学連携推進課長渡邊誠
Tel:045-787-2510
E-mail:sentan@yokohama-cu.ac.jp
(AMEDの事業について)
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課
Tel:03-6870-2220Fax:03-6870-2242
E-mail:saisei-ML@amed.go.jp
URL: http://www.amed.go.jp/
(JSTの事業について)
国立研究開発法人科学技術振興機構(JST)
戦略研究推進部川口哲
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:presto@ jst.go.jp
URL:http://www.jst.go.jp/kisoken/presto/