必須アミノ酸バリンの代謝、肝臓発生に重要な役割 -iPS細胞からミニ肝臓を安価に大量創出する技術へ期待ー
2017.03.23
- TOPICS
- 研究
- 医療
必須アミノ酸バリンの代謝、肝臓発生に重要な役割-iPS細胞からミニ肝臓を安価に大量創出する技術へ期待ー
Developmentに掲載
横浜市立大学学術院医学群 臓器再生医学の武部貴則准教授、小池博之研究員、谷口英樹教授ら研究グループは、網羅的な遺伝子発現・代謝物発現解析により、マウス肝臓の胎内発生初期段階において、分岐鎖アミノ酸、特にバリンの代謝がその成長に重要であることを世界で初めて特定しました。さらに、この知見をヒトiPS細胞の培養に応用し、最適な濃度のバリンを培養液に添加するとヒトiPS由来肝臓細胞の増殖性が亢進すること、また、継代培養したヒト肝臓細胞を用いてミニ肝臓形成が可能であることを見出しました。本研究成果により、分岐鎖アミノ酸濃度を最適化した培養液を用いることで、iPS細胞などに由来する肝臓細胞の安価かつ効率的な創出が可能になると考えられます。再生医療の実用化を阻む大きな課題であった巨額の製造コストの低減につながり、再生医療・創薬研究の促進が期待されます。
本研究成果は、英科学誌「Development」に掲載されました。(3月14日掲載Development (2017) 144, 1018-1024 doi:10.1242/dev.143032)。
研究の背景
近年、様々な機能細胞へ分化する能力を有するiPS細胞などの多能性幹細胞を分化誘導することにより、創薬スクリーニングや再生医療に有益なヒト細胞や組織を創出する方法が注目されています。本研究グループも、器官の原基(臓器の芽:Organ Bud)が胎内で形成される過程を模倣する新規の細胞培養操作技術(器官原基法:Organ Bud Generation法)を開発し、試験管内においてヒトiPS細胞から立体的な肝臓の原基(ミニ肝臓)を自律的に誘導できることを示しました(Takebe T, et al. Nature, 2013)。一般に多能性幹細胞の培養系では、サイトカインを始めとしたさまざまなタンパク質製剤などの試薬を大量添加することによる各種機能細胞への分化誘導が試みられています。しかし、これらの試薬が極めて高額であるために、医療応用に要する莫大な数の細胞を得るためには巨額の製造コストを要することが重大な課題となっていました。
そこで本研究グループでは、胎内での肝臓発生(ミニ肝臓の形成時期)において成長が活発な時期に特徴的な細胞の代謝特性に着目しました。すなわち、ミニ肝臓発生期における細胞の代謝がどのようになっているときに増殖が活発化しているのかを解明することで、そのメカニズムを培養細胞の増殖迅速化に活用しようという試みです。これらを通じ、目的とする細胞のみが生存可能な代謝環境を構築することにより、標的細胞のみを安価に効率的に得る方法の確立を目指しました。
そこで本研究グループでは、胎内での肝臓発生(ミニ肝臓の形成時期)において成長が活発な時期に特徴的な細胞の代謝特性に着目しました。すなわち、ミニ肝臓発生期における細胞の代謝がどのようになっているときに増殖が活発化しているのかを解明することで、そのメカニズムを培養細胞の増殖迅速化に活用しようという試みです。これらを通じ、目的とする細胞のみが生存可能な代謝環境を構築することにより、標的細胞のみを安価に効率的に得る方法の確立を目指しました。
研究の内容
まず、異なる分化段階の細胞における代謝特性の差異の検出を目的として、胎生初期から成体に至るまでの肝臓を対象にメタボローム解析・トランスクリプトーム解析を行いました。その結果、未分化な細胞が高頻度に存在する胎生初期(E9.5~11.5)の肝臓で特異的に、分岐鎖アミノ酸の分解酵素であるアミノ基転移酵素(branched-chain aminotransferase: BCAT1)が高発現し、分岐鎖アミノ酸の分解が亢進していることを見出しました。また、BCAT1が高発現する傾向は、ヒトにおいても同様であることを確認しました。以上の結果から、細胞増殖が活発な胎生初期の肝臓細胞では、分岐鎖アミノ酸の代謝要求度が著しく高いことが示唆されました(図1)。
そこで、発生初期の胎児肝臓形成に対する分岐鎖アミノ酸の効果を検証するため、分岐鎖アミノ酸非含有飼料を作製、その投与による影響を評価しました。肝発生が始まる妊娠8.5日目の母体マウスに分岐鎖アミノ酸非含有飼料を与えて飼育した結果、この飼料を与えた群の胎児肝臓においては、標準餌群と比較して肝重量が著しく減少しました(図2)。さらに、胎児肝臓中に含まれる肝前駆細胞の存在頻度をフローサイトメトリーにより解析したところ、標準餌群に比べて、分岐鎖アミノ酸非含有飼料、およびL-バリン非含有飼料を与えた群ではその存在頻度が大きく減少していました。これらの結果から、発生初期の肝形成過程で肝臓の前駆細胞が活発に増殖する時期においては、分岐鎖アミノ酸、特に、バリンの存在が重要であることが示されました。
そこで、発生初期の胎児肝臓形成に対する分岐鎖アミノ酸の効果を検証するため、分岐鎖アミノ酸非含有飼料を作製、その投与による影響を評価しました。肝発生が始まる妊娠8.5日目の母体マウスに分岐鎖アミノ酸非含有飼料を与えて飼育した結果、この飼料を与えた群の胎児肝臓においては、標準餌群と比較して肝重量が著しく減少しました(図2)。さらに、胎児肝臓中に含まれる肝前駆細胞の存在頻度をフローサイトメトリーにより解析したところ、標準餌群に比べて、分岐鎖アミノ酸非含有飼料、およびL-バリン非含有飼料を与えた群ではその存在頻度が大きく減少していました。これらの結果から、発生初期の肝形成過程で肝臓の前駆細胞が活発に増殖する時期においては、分岐鎖アミノ酸、特に、バリンの存在が重要であることが示されました。
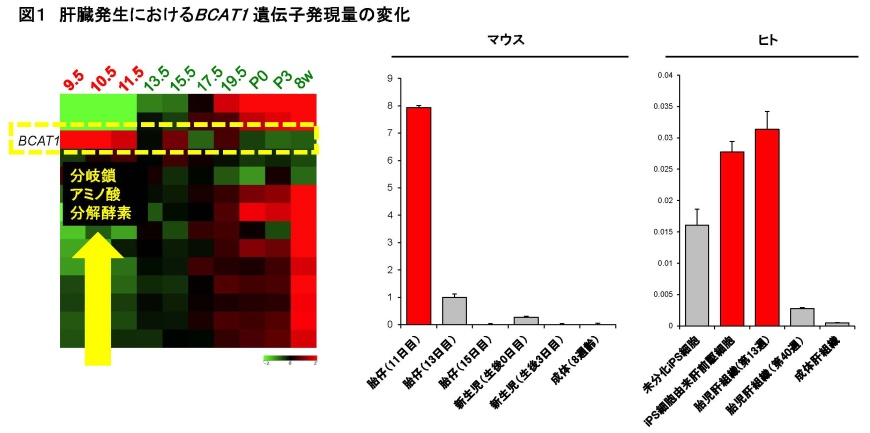
図1肝臓発生におけるBCAT1 遺伝子発現量の変化
(左)網羅的な遺伝子発現解析の結果、肝臓形成初期(E9.5-11.5)では分岐鎖アミノ酸分解酵素の発現が高いことが判明した。(右)各発生時期のマウス肝臓および、ヒト肝臓あるいはiPS細胞由来肝臓細胞から抽出したRNAを用いて、定量PCR(ポリメラーゼ連鎖反応)にてBCAT1遺伝子の発現量を比較した(左;マウス、右;ヒト)。マウス、ヒト双方でBCAT1の発現量は発生初期に高く、発生の進行に伴い減少することが確認された。
(左)網羅的な遺伝子発現解析の結果、肝臓形成初期(E9.5-11.5)では分岐鎖アミノ酸分解酵素の発現が高いことが判明した。(右)各発生時期のマウス肝臓および、ヒト肝臓あるいはiPS細胞由来肝臓細胞から抽出したRNAを用いて、定量PCR(ポリメラーゼ連鎖反応)にてBCAT1遺伝子の発現量を比較した(左;マウス、右;ヒト)。マウス、ヒト双方でBCAT1の発現量は発生初期に高く、発生の進行に伴い減少することが確認された。
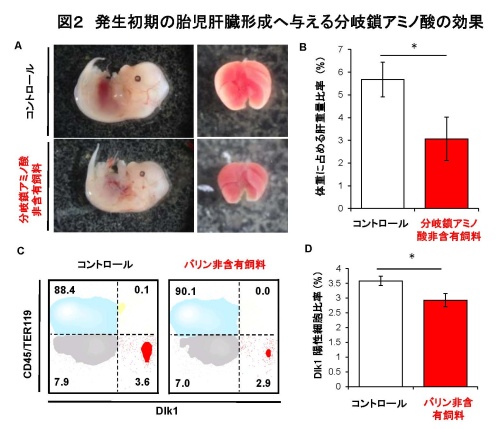
図2発生初期の胎児肝臓形成へ与える分岐鎖アミノ酸の効果
(A)胎仔(13日目)の全体および肝臓の像。標準飼料あるいは分岐鎖アミノ酸非含有飼料を胎生8日目より母体マウスへ与えた。(B)(A)の肝臓重量が胎仔全重量に占める割合。分岐鎖アミノ酸非含有飼料群では標準資料群に比べて有意に肝臓が縮小することが確認された。(C)胎仔(13日目)肝臓細胞のフローサイトメトリー解析結果。縦軸;血球細胞マーカー(CD45およびTER119)、横軸;肝前駆細胞マーカー(Dlk1)の蛍光強度。数字は点線で区分けされた分画が全体に占める割合(%)を示す。(D)(C)の解析におけるDlk1陽性肝前駆細胞比率。肝臓中における肝前駆細胞の比率はバリン非含有飼料群で有意に減少することが確認された。
統計解析はMann-Whitney U 検定により行った(*; P < 0.05)
(A)胎仔(13日目)の全体および肝臓の像。標準飼料あるいは分岐鎖アミノ酸非含有飼料を胎生8日目より母体マウスへ与えた。(B)(A)の肝臓重量が胎仔全重量に占める割合。分岐鎖アミノ酸非含有飼料群では標準資料群に比べて有意に肝臓が縮小することが確認された。(C)胎仔(13日目)肝臓細胞のフローサイトメトリー解析結果。縦軸;血球細胞マーカー(CD45およびTER119)、横軸;肝前駆細胞マーカー(Dlk1)の蛍光強度。数字は点線で区分けされた分画が全体に占める割合(%)を示す。(D)(C)の解析におけるDlk1陽性肝前駆細胞比率。肝臓中における肝前駆細胞の比率はバリン非含有飼料群で有意に減少することが確認された。
統計解析はMann-Whitney U 検定により行った(*; P < 0.05)
次に、培養条件下においても、分岐鎖アミノ酸やL-バリンの存在による増殖促進効果を検証しました。マウスおよびヒトiPS細胞由来肝前駆細胞への分岐鎖アミノ酸添加による影響を評価した結果、BCAT1が代謝反応を担っている分岐鎖アミノ酸のうち、バリンを添加した群においてのみ高い増殖性を示すコロニーの頻度が増加することを確認できました(図3)。一方、より発生の進行したE13.5およびE15.5の肝臓由来細胞に対してはこの効果は認められませんでした。以上の結果から、胎生中期(マウスではE13.5〜)以降ではなく、胎生初期(マウスではE11.5相当)に存在する未分化な肝臓細胞でのみ特異的に、L-バリンの添加による増殖促進効果が現れることが示されました。また、ヒトにおけるミニ肝臓形成過程においても同様の代謝メカニズムを増殖活発化に活用している可能性が示唆されました。
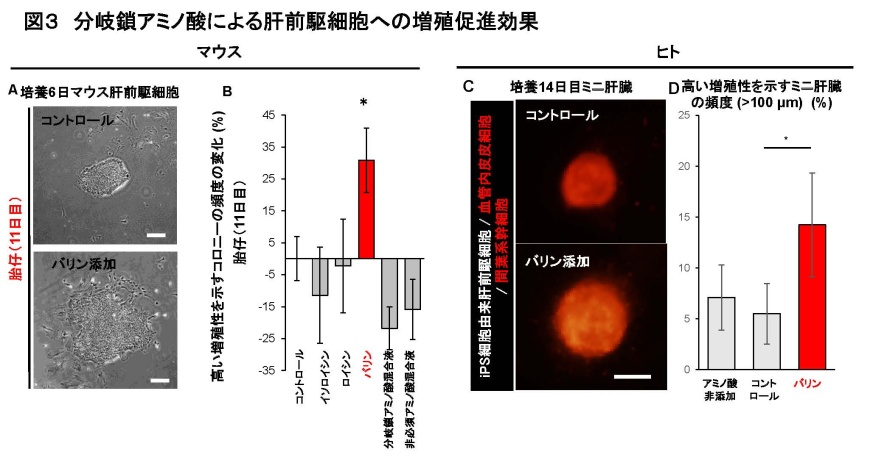
図3分岐鎖アミノ酸による肝前駆細胞への増殖促進効果
(A)マウス胎仔由来肝臓細胞の培養6日目像。胎生11日目の肝臓より単一細胞を分取し、ラミニンコートされた培養皿で低密度培養を行った。標準培地へ各種アミノ酸を添加し比較を行った。スケール;100 μm。
(B)(A)の培養実験で得られたコロニーのうち、増殖性の高い(90細胞以上からなる)コロニーの頻度。標準培地あるいは他の種類のアミノ酸を添加した群と比較して胎生11日目肝臓由来細胞へバリンを添加した群では有意に高い増殖性を示すコロニーの頻度が向上した。
(C)培養14日目のヒトiPS細胞由来ミニ肝臓蛍光像。血管内皮細胞(ヒト臍帯静脈内皮細胞)および間葉系幹細胞が赤色蛍光で標識されている。標準培地へバリンを添加し比較を行った。スケール;100 μm。(D)(C)の実験で得られたミニ肝臓のうち、高い増殖性を示すものの頻度。蛍光像を元に各ミニ肝臓の大きさを計測し、直径100 μm以上のものをカウントした。統計解析はMann-Whitney U 検定により行った(*; P < 0.05)
(A)マウス胎仔由来肝臓細胞の培養6日目像。胎生11日目の肝臓より単一細胞を分取し、ラミニンコートされた培養皿で低密度培養を行った。標準培地へ各種アミノ酸を添加し比較を行った。スケール;100 μm。
(B)(A)の培養実験で得られたコロニーのうち、増殖性の高い(90細胞以上からなる)コロニーの頻度。標準培地あるいは他の種類のアミノ酸を添加した群と比較して胎生11日目肝臓由来細胞へバリンを添加した群では有意に高い増殖性を示すコロニーの頻度が向上した。
(C)培養14日目のヒトiPS細胞由来ミニ肝臓蛍光像。血管内皮細胞(ヒト臍帯静脈内皮細胞)および間葉系幹細胞が赤色蛍光で標識されている。標準培地へバリンを添加し比較を行った。スケール;100 μm。(D)(C)の実験で得られたミニ肝臓のうち、高い増殖性を示すものの頻度。蛍光像を元に各ミニ肝臓の大きさを計測し、直径100 μm以上のものをカウントした。統計解析はMann-Whitney U 検定により行った(*; P < 0.05)
今後の展開
ミニ肝臓の医療応用実現に向けて、その材料である肝臓の前駆細胞に特徴的な細胞増殖機構を解明しました。アミノ酸製剤(分岐鎖アミノ酸)を添加するという単純かつ安価な方法を用いることにより、ヒト臓器細胞の工業的製造を劇的にコストダウンできる基盤的培養技術となる可能性があります。今後、iPS細胞からミニ肝臓を作製する際に、アミノ酸を用いて増殖促進させた前駆細胞の安全性や有効性に関する解析を進め、再生医療や創薬スクリーニングに必要なヒト肝細胞の大量創出に有益な細胞操作技術の確立を進めます。
用語解説
*1 分岐鎖アミノ酸(BCAABranched Chain Amino Acid)
・ロイシン、イソロイシン、バリンの3種類のアミノ酸がある。
・成体では、肝臓ではほとんど代謝されず、主として、骨格筋と脳で代謝される。
・成体では、運動時に筋肉のエネルギー源として利用される。
・BCAT1により、α-ケトグルタル酸と反応し、アンモニア処理に必要なグルタミン酸が、生成される。
肝不全、肝硬変など重度の肝機能障害時に生じた高アンモニア血症に対し、BCAAが投与される。
・ロイシン、イソロイシン、バリンの3種類のアミノ酸がある。
・成体では、肝臓ではほとんど代謝されず、主として、骨格筋と脳で代謝される。
・成体では、運動時に筋肉のエネルギー源として利用される。
・BCAT1により、α-ケトグルタル酸と反応し、アンモニア処理に必要なグルタミン酸が、生成される。
肝不全、肝硬変など重度の肝機能障害時に生じた高アンモニア血症に対し、BCAAが投与される。
掲載論文
Nutritional modulation of mouse and human liver bud growth through a branched-amino acid metabolism
Hiroyuki Koike, Ran-Ran Zhang, Yasuharu Ueno, Keisuke Sekine, Yun-wen Zheng, Takanori Takebe & Hideki Taniguchi
Development (2017) 144, 1018-1024 doi:10.1242/dev.143032
※本研究は、国立研究開発法人科学技術振興機構(JST)「戦略的創造研究推進事業」、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム」の一環として、また武田科学振興財団、日本IDDMネットワークの支援を受けて行われました。
Hiroyuki Koike, Ran-Ran Zhang, Yasuharu Ueno, Keisuke Sekine, Yun-wen Zheng, Takanori Takebe & Hideki Taniguchi
Development (2017) 144, 1018-1024 doi:10.1242/dev.143032
※本研究は、国立研究開発法人科学技術振興機構(JST)「戦略的創造研究推進事業」、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム」の一環として、また武田科学振興財団、日本IDDMネットワークの支援を受けて行われました。
お問い合わせ先
(本資料の内容に関するお問い合わせ)
学術院医学群臓器再生医学准教授武部 貴則、教授 谷口 英樹
TEL:045-787-2672,FAX:045-787-8963
E-mail:ttakebe@yokohama-cu.ac.jp(武部)、rtanigu@yokohama-cu.ac.jp(谷口)
(取材対応窓口、資料請求など)
横浜市立大学研究企画・産学連携推進課長渡邊誠
Tel:045-787-2510
E-mail:
学術院医学群臓器再生医学准教授武部 貴則、教授 谷口 英樹
TEL:045-787-2672,FAX:045-787-8963
E-mail:ttakebe@yokohama-cu.ac.jp(武部)、rtanigu@yokohama-cu.ac.jp(谷口)
(取材対応窓口、資料請求など)
横浜市立大学研究企画・産学連携推進課長渡邊誠
Tel:045-787-2510
E-mail: