微生物学 梁 明秀 教授ら研究グループがエイズウイルスの細胞間伝播に関わる宿主蛋白質を発見
- TOPICS
- 研究
- 医療
エイズウイルスの体内での拡がりに関わる宿主蛋白質を発見〜新たな治療法の開発へ期待~
~『Nature communications』に掲載~
横浜市立大学学術院医学群 微生物学の梁 明秀 教授、宮川 敬 助教らの研究グループは、国立感染症研究所・シンガポール国立大学・北里大学・米国ミシガン大学などとの共同研究により、エイズの原因となるヒト免疫不全ウイルス(HIV)が体内で効率よく感染を拡げるための分子メカニズムを解明し、これに関わる宿主蛋白質を発見しました。
HIVが体内で多量に増殖するメカニズムとして、感染細胞から放出されたウイルス粒子が別の細胞に感染するいわゆる「cell-free感染」と、感染細胞と非感染細胞が直接接触することにより一度に大量のウイルスを受け渡す、いわゆる「cell-to-cell(細胞-細胞間)感染」という仕組みが知られています。このcell-to-cell感染は、細胞どうしが密に存在するリンパ節などの組織でみられ、一度に100~1000個のウイルスを伝播することが知られています。そのため、抗ウイルス薬を投与しても相対的な薬剤濃度が低下し薬の効果を弱める一因となっており、HIVの潜伏化や慢性感染の維持にも重要な役割を果たすと考えられています。したがってその分子メカニズムの解明は、エイズウイルスの体内での拡がりや潜伏化機構の解明につながるだけでなく、新たな治療法開発への応用に寄与するものと期待されます。
※本研究成果は英国の科学雑誌「Nature Communications」(平成29年1月30日オンライン版)に掲載されます。
※本研究は、日本医療研究開発機構(AMED)「エイズ対策実用化研究事業」、文部科学省 科学研究費および文部科学省「イノベーションシステム整備事業先端融合領域イノベーション創出拠点形成プログラム」の一環として行われ、横浜市立大学 先端医科学研究センターが推進している研究開発プロジェクトの成果の一つです。
研究の背景
HIV(ヒト免疫不全ウイルス)が体内に侵入すると、免疫細胞が徐々に破壊され、普段は感染しない病原体に感染して病気を発症しやすくなります。このような状態をエイズ(AIDS、後天性免疫不全症候群)と言い、全世界で3500万人以上がHIVに感染していると推測されています。2014年には、15万人の子供を含む210万人が新たにHIVに感染しました。日本では、年間1500人が新規HIV感染者となっており、年々増加傾向がみられています。
HIV感染を未然に防ぐワクチンはまだありませんが、抗ウイルス薬の服用によってウイルスの増殖を抑え、エイズの発症を遅らせることはできます。しかし、一度感染したウイルスを体内から完全に排除する治療法は確立されておらず、HIV感染者は抗ウイルス薬を日常的に飲み続ける必要があります。また、長期間の抗ウイルス薬の服用によって薬剤が効かなくなる事例も多数報告されています。そのため、HIVワクチンの開発と並行して、既存薬が効かない耐性ウイルスにも効果のある新しい薬剤を常に作り続ける必要があります。
研究の概要と成果
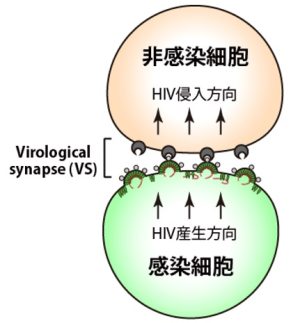 図1Virological Synapseを介した細胞-細胞間感染
図1Virological Synapseを介した細胞-細胞間感染
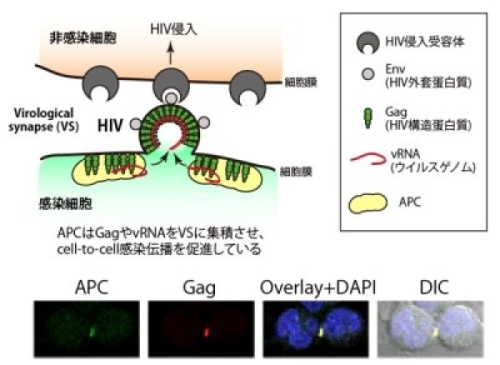 図2Cell-to-cell 感染におけるAPCの役割
図2Cell-to-cell 感染におけるAPCの役割
今後の展開
用語解説
(*1) CD4陽性Tリンパ球
免疫機能の司令塔の役割を担う免疫細胞の一種。HIVはこの細胞に侵入して増殖を続けるため、HIV感染によってこの値は大幅に減少し、これに伴って免疫力も低下する。この値はエイズの診断や進行の度合いを測る上で重要な指標となっており、400個/mm3以下の場合はエイズ以外にも単純ヘルペスウイルス感染症、結核の再燃、カンジダ症、非ホジキンリンパ腫など、多くの病気が疑われる。
(*2) Gag
HIVの骨格蛋白質。複数の構造的ドメインを含み、細胞膜への結合やウイルス粒子形成、ウイルスゲノムの粒子への取り込みなどの機能を担う。
(*3) TAP (Tandem Affinity Purification)
蛋白質に2種類のタグ(目印)を付け、タグを用いて2段階精製を行うことで、その蛋白質の結合パートナーを高純度に精製する手法。
(*4) 家族性大腸腺腫症
大腸全体に多数のポリープ(腺腫)が形成され、放置により大腸癌を発症する遺伝性疾患。APC遺伝子の異常が主要な原因であるが、癌化にはさらに複数の遺伝子変異が関わるとされる。
論文著者・タイトル
Kei Miyakawa, Mayuko Nishi, Satoko Matsunaga, Akiko Okayama, Masaki Anraku, Ayumi Kudoh, Hisashi Hirano, Hirokazu Kimura, Yuko Morikawa, Naoki Yamamoto, Akira Ono & Akihide Ryo : The tumour suppressor APC promotes HIV-1 assembly via interaction with Gag precursor protein, Nature Communications 8, 14259(2017)
DOI: 10.1038/ncomms14259
お問い合わせ先
公立大学法人横浜市立大学 大学院医学研究科 微生物学教授 梁明秀
TEL:045-787-2602
E-mail:
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学 研究企画・産学連携推進課長 渡邊誠
Tel:045-787-2510
E-Mail: