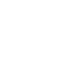遺伝学 松本教授らの共同研究グループが軸性脊椎骨幹端異形成症の原因遺伝子を発見
2016.03.15
- TOPICS
- 研究
遺伝学 松本教授らの共同研究グループが軸性脊椎骨幹端異形成症の原因遺伝子を発見
~『PLOS ONE』に掲載~
理化学研究所(理研)統合生命医科学研究センター骨関節疾患研究チームの池川志郎チームリーダー、王铮(ワン・ゼン)研究員、飯田有俊上級研究員、横浜市立大学学術院医学群の松本直通教授、東北大学大学院医学系研究科の西口康二准教授らの共同研究グループ※は、遺伝性の難病である軸性脊椎骨幹端異形成症の原因遺伝子「C21orf2 」を発見しました。C21orf2 遺伝子の機能喪失により、網膜視細胞や成長軟骨細胞の繊毛の機能不全が起こり、同疾患を発症するメカニズムを解明しました。
軸性脊椎骨幹端異形成症は、網膜色素変性症[1]の発症と骨格の形成異常を特徴とする常染色体劣性遺伝病[2]です。多くの患者は、網膜の視細胞が変性するため幼児期に視力を失います。また、肋骨の短縮による胸郭の狭小化・変形、脊椎の変形、四肢関節の異常など多様な骨格異常をきたす難病です。そのため、発症原因の解明、予防・治療法の確立が待ち望まれています。
共同研究グループは世界各地の研究者・医師の協力により軸性脊椎骨幹端異形成症の患者とその両親のデータとDNAを計9家系分収集しました。そして、次世代シーケンサー[3]を用いたエクソーム解析[4]でDNAを調べた結果、6家系にC21orf2 遺伝子の変異を5種類発見しました。発見した5種類の変異は、いずれも遺伝子機能の低下・喪失をきたす変異でした。C21orf2 遺伝子は最近の研究で、繊毛の機能に関係することが明らかになっています。そこで、網膜でのC21orf2タンパク質の局在を調べたところ、視細胞の結合繊毛に存在することを発見しました。また、ヒト培養軟骨細胞のC21orf2 遺伝子を欠損させた実験で、同遺伝子が軟骨の分化に重要な役割を果たすことも発見しました。今回の原因遺伝子の発見により、軸性脊椎骨幹端異形成症の遺伝子診断、保因者診断が可能になりました。また、C21orf2 遺伝子の機能解析を通じて、網膜や骨格の形成メカニズム、および視細胞や軟骨の代謝について理解が進み、軸性脊椎骨幹端異形成症やそれに類する網膜の変性疾患、骨格異常症に対する有効な治療法の開発につながると期待できます。
本研究は日本医療研究開発機構の難治性疾患実用化研究事業のプロジェクト、『遺伝性難治疾患の網羅的遺伝子解析拠点研究』の一環として行われました。成果は、米国のオンライン科学雑誌『PLOS ONE』(3月14日付け:日本時間3月15日)に掲載されました。
軸性脊椎骨幹端異形成症は、網膜色素変性症[1]の発症と骨格の形成異常を特徴とする常染色体劣性遺伝病[2]です。多くの患者は、網膜の視細胞が変性するため幼児期に視力を失います。また、肋骨の短縮による胸郭の狭小化・変形、脊椎の変形、四肢関節の異常など多様な骨格異常をきたす難病です。そのため、発症原因の解明、予防・治療法の確立が待ち望まれています。
共同研究グループは世界各地の研究者・医師の協力により軸性脊椎骨幹端異形成症の患者とその両親のデータとDNAを計9家系分収集しました。そして、次世代シーケンサー[3]を用いたエクソーム解析[4]でDNAを調べた結果、6家系にC21orf2 遺伝子の変異を5種類発見しました。発見した5種類の変異は、いずれも遺伝子機能の低下・喪失をきたす変異でした。C21orf2 遺伝子は最近の研究で、繊毛の機能に関係することが明らかになっています。そこで、網膜でのC21orf2タンパク質の局在を調べたところ、視細胞の結合繊毛に存在することを発見しました。また、ヒト培養軟骨細胞のC21orf2 遺伝子を欠損させた実験で、同遺伝子が軟骨の分化に重要な役割を果たすことも発見しました。今回の原因遺伝子の発見により、軸性脊椎骨幹端異形成症の遺伝子診断、保因者診断が可能になりました。また、C21orf2 遺伝子の機能解析を通じて、網膜や骨格の形成メカニズム、および視細胞や軟骨の代謝について理解が進み、軸性脊椎骨幹端異形成症やそれに類する網膜の変性疾患、骨格異常症に対する有効な治療法の開発につながると期待できます。
本研究は日本医療研究開発機構の難治性疾患実用化研究事業のプロジェクト、『遺伝性難治疾患の網羅的遺伝子解析拠点研究』の一環として行われました。成果は、米国のオンライン科学雑誌『PLOS ONE』(3月14日付け:日本時間3月15日)に掲載されました。
背景
骨・関節には非常に多くの遺伝性疾患が存在します。現在、はっきりと病像が確認され、国際分類に含まれているものだけでも、436疾患が知られています。また、すべての遺伝性疾患のうち3割近くに骨・関節の異常が見られると言われています。その多くが、有効な治療法がない希少難病です。
池川志郎チームリーダーらは、これまでに20種以上の遺伝性疾患の原因遺伝子を発見しています 注1)。2014年度からは、国立研究開発法人日本医療研究開発機構の難治性疾患実用化研究事業のプロジェクト『遺伝性難治疾患の網羅的遺伝子解析拠点研究』(班長:横浜市立大学遺伝学松本直通教授)に参加し、ゲノム科学の基礎研究を医療現場へ見える形で還元することを目指して、遺伝性の骨関節の難病の大規模シーケンス解析に取り組んでいます。
骨関節の遺伝性疾患は、各疾患により特徴的なパターンの病像を示し、そのパターンにより42のグループに分けられています。今回、研究対象とした「軸性脊椎骨幹端異形成症 (axial spondylometaphyseal dysplaia)」は、主に脊椎と長管骨の骨幹端に異常をきたす疾患のグループである脊椎骨幹端異形成症のグループに属する疾患で、網膜色素変性症と骨格の形成異常を特徴とする常染色体劣性遺伝病です。肋骨の短縮による胸郭の狭小化・変形、脊椎の変形、骨盤の発達障害、四肢関節の異常など多様な骨格異常をきたす難病です(図1)。“軸性”の名は、病変が体の軸の部分(体幹部)に主にみられることに由来します。網膜視細胞の変性による視力低下(夜盲、失明)、胸郭変形による疼痛(とうつう)、呼吸障害、四肢関節、特に股関節の異常による疼痛、歩行障害等の症状が、患者を苦しめており、発症原因の解明、予防・治療法の確立が待ち望まれています。
池川志郎チームリーダーらは、これまでに20種以上の遺伝性疾患の原因遺伝子を発見しています 注1)。2014年度からは、国立研究開発法人日本医療研究開発機構の難治性疾患実用化研究事業のプロジェクト『遺伝性難治疾患の網羅的遺伝子解析拠点研究』(班長:横浜市立大学遺伝学松本直通教授)に参加し、ゲノム科学の基礎研究を医療現場へ見える形で還元することを目指して、遺伝性の骨関節の難病の大規模シーケンス解析に取り組んでいます。
骨関節の遺伝性疾患は、各疾患により特徴的なパターンの病像を示し、そのパターンにより42のグループに分けられています。今回、研究対象とした「軸性脊椎骨幹端異形成症 (axial spondylometaphyseal dysplaia)」は、主に脊椎と長管骨の骨幹端に異常をきたす疾患のグループである脊椎骨幹端異形成症のグループに属する疾患で、網膜色素変性症と骨格の形成異常を特徴とする常染色体劣性遺伝病です。肋骨の短縮による胸郭の狭小化・変形、脊椎の変形、骨盤の発達障害、四肢関節の異常など多様な骨格異常をきたす難病です(図1)。“軸性”の名は、病変が体の軸の部分(体幹部)に主にみられることに由来します。網膜視細胞の変性による視力低下(夜盲、失明)、胸郭変形による疼痛(とうつう)、呼吸障害、四肢関節、特に股関節の異常による疼痛、歩行障害等の症状が、患者を苦しめており、発症原因の解明、予防・治療法の確立が待ち望まれています。
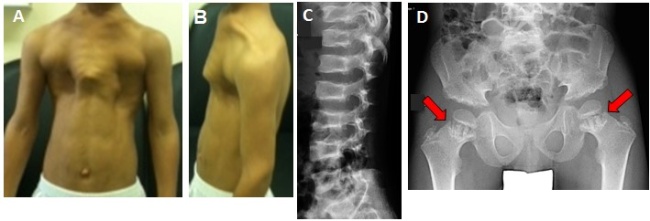
図1 軸性脊椎骨幹端異形成症の病像
A:胸郭の変形(正面)。
B:胸郭の変形(側面)。胸骨下部の突出と肋骨の陥凹が顕著である。
C:腰椎側面のX線像。脊椎の形成障害により、脊椎椎体が扁平化している。
D:骨盤正面のX線像。骨盤、股関節の成長障害。近位大腿骨の成長軟骨下の骨化が障害されて、線上に見える(矢印)。
池川チームリーダーらは、これまでに次世代シーケンサーによるエクソーム解析により短体幹症 注2)、Beighton型脊椎骨端骨幹端異形成症 注3)など、多くの骨関節の遺伝性疾患の原因遺伝子を世界に先駆けて発見しています。
A:胸郭の変形(正面)。
B:胸郭の変形(側面)。胸骨下部の突出と肋骨の陥凹が顕著である。
C:腰椎側面のX線像。脊椎の形成障害により、脊椎椎体が扁平化している。
D:骨盤正面のX線像。骨盤、股関節の成長障害。近位大腿骨の成長軟骨下の骨化が障害されて、線上に見える(矢印)。
池川チームリーダーらは、これまでに次世代シーケンサーによるエクソーム解析により短体幹症 注2)、Beighton型脊椎骨端骨幹端異形成症 注3)など、多くの骨関節の遺伝性疾患の原因遺伝子を世界に先駆けて発見しています。
研究手法と成果
共同研究グループは、池川チームリーダーが創設した骨系統疾患のより良い医療、研究のためのボランティアのネットワーク「骨系統疾患コンソーシアム[5]」と、諸外国(サウジアラビア、韓国、フランス、ノルウェー、スエーデン、イギリス)の骨系統疾患の研究者・医師の協力により、9家系13例の軸性脊椎骨幹端異形成症の患者のデータとDNAを収集しました。家系内での病気の伝わり方を詳細に調べたところ、常染色体劣性遺伝の遺伝形式として矛盾がないことを確認しました。
共同研究グループは、エクソーム解析を用いて、患者と両親のゲノムを広範囲に調べました。被検者の遺伝子とその遺伝子周辺のゲノムの塩基配列を次世代シーケンサーで決定し、公開されているビッグデータを利用して、病気と無関係で無害な遺伝子多型[6]を除外し、原因遺伝子変異の候補となる遺伝子の塩基の変化を絞り込みました。
軸性脊椎骨幹端異形成症は常染色体劣性遺伝病のため、患者は2つ、両親は1つの原因遺伝子の変異を持っていることになります。共同研究グループは各家系につき、条件に見合う遺伝子の塩基変化を調べたところ、6家系の患者において、C21orf2 遺伝子に変異をそれぞれ2つ持つことを発見しました。最近の研究でこの遺伝子は、常染色体の21番染色体上に存在し、繊毛の機能に関係し、網膜視細胞の代謝に重要な役割を果たすことが分かっています。
今回、発見したC21orf2 遺伝子の変異は5種類で、3種類がミスセンス変異(タンパク質を構成するアミノ酸の配列に変化を起こす変異)、2種類が遺伝子のスプライシング[7]に関係する塩基の変異でした。いずれの遺伝子変異も、各家系内で常染色体劣性の遺伝形式に矛盾がない伝達をしていることを確認しました。3種類のミスセンス変異について変異の機能評価プログラムを用いて評価したところ、すべての変異がC21orf2タンパク質の機能に障害をきたすと予測されました。また、2種類のスプライシング異常をきたす変異について、患者と両親から得たリンパ球を用いてメッセンジャーRNA(mRNA)の発現を調べたところ、正常よりはるかにアミノ酸配列の短いC21orf2タンパク質が生じるスプライシング異常を起こしていることを確認しました。これにより、いずれの遺伝子変異も、C21orf2タンパク質の機能障害を引き起こすと考えられました。ミスセンス変異「c.218G>C」は2つのヨーロッパ人家系に、スプライシング変異 「c.643-23A>T」は2つのサウジアラビア人家系に共通して見つかりました。これらの人種には、多くの軸性脊椎骨幹端異形成症の保因者(遺伝病の原因遺伝子を持っているが発症していない人)が存在する可能性があります。C21orf2 遺伝子が繊毛の機能に関係し、網膜視細胞の代謝に重要な役割を果たすことが明らかになっていることから、共同研究グループは、マウスの網膜視細胞(光受容体細胞)を用いてC21orf2タンパク質の局在を調べました。その結果、C21orf2タンパク質は2種類の視細胞、捍体細胞(かんたいさいぼう)[8] と錐体細胞(すいたいさいぼう)[8]の結合繊毛に存在することを発見しました。さらに共同研究グループは、ヒトの培養軟骨細胞を用いたsiRNAによる遺伝子ノックダウン実験で、成長軟骨の分化に対するC21orf2 遺伝子の影響を調べました(図2)。2種類の短いRNA(siRNA-1,2)を用いてC21orf2 遺伝子の発現を阻害したところ、II型コラーゲンやアグリカンなど、軟骨の分化マーカー遺伝子(軟骨の分化に伴って発現が上昇する遺伝子)の発現が低下しました。このことから、C21orf2 遺伝子は、軟骨の分化に必要であることが分かりました。以上のデータから、軸性脊椎骨幹端異形成症は、C21orf2 遺伝子の機能喪失変異により、網膜視細胞や成長軟骨細胞に繊毛の機能不全が起こり、その結果、発症すると考えられました。
共同研究グループは、エクソーム解析を用いて、患者と両親のゲノムを広範囲に調べました。被検者の遺伝子とその遺伝子周辺のゲノムの塩基配列を次世代シーケンサーで決定し、公開されているビッグデータを利用して、病気と無関係で無害な遺伝子多型[6]を除外し、原因遺伝子変異の候補となる遺伝子の塩基の変化を絞り込みました。
軸性脊椎骨幹端異形成症は常染色体劣性遺伝病のため、患者は2つ、両親は1つの原因遺伝子の変異を持っていることになります。共同研究グループは各家系につき、条件に見合う遺伝子の塩基変化を調べたところ、6家系の患者において、C21orf2 遺伝子に変異をそれぞれ2つ持つことを発見しました。最近の研究でこの遺伝子は、常染色体の21番染色体上に存在し、繊毛の機能に関係し、網膜視細胞の代謝に重要な役割を果たすことが分かっています。
今回、発見したC21orf2 遺伝子の変異は5種類で、3種類がミスセンス変異(タンパク質を構成するアミノ酸の配列に変化を起こす変異)、2種類が遺伝子のスプライシング[7]に関係する塩基の変異でした。いずれの遺伝子変異も、各家系内で常染色体劣性の遺伝形式に矛盾がない伝達をしていることを確認しました。3種類のミスセンス変異について変異の機能評価プログラムを用いて評価したところ、すべての変異がC21orf2タンパク質の機能に障害をきたすと予測されました。また、2種類のスプライシング異常をきたす変異について、患者と両親から得たリンパ球を用いてメッセンジャーRNA(mRNA)の発現を調べたところ、正常よりはるかにアミノ酸配列の短いC21orf2タンパク質が生じるスプライシング異常を起こしていることを確認しました。これにより、いずれの遺伝子変異も、C21orf2タンパク質の機能障害を引き起こすと考えられました。ミスセンス変異「c.218G>C」は2つのヨーロッパ人家系に、スプライシング変異 「c.643-23A>T」は2つのサウジアラビア人家系に共通して見つかりました。これらの人種には、多くの軸性脊椎骨幹端異形成症の保因者(遺伝病の原因遺伝子を持っているが発症していない人)が存在する可能性があります。C21orf2 遺伝子が繊毛の機能に関係し、網膜視細胞の代謝に重要な役割を果たすことが明らかになっていることから、共同研究グループは、マウスの網膜視細胞(光受容体細胞)を用いてC21orf2タンパク質の局在を調べました。その結果、C21orf2タンパク質は2種類の視細胞、捍体細胞(かんたいさいぼう)[8] と錐体細胞(すいたいさいぼう)[8]の結合繊毛に存在することを発見しました。さらに共同研究グループは、ヒトの培養軟骨細胞を用いたsiRNAによる遺伝子ノックダウン実験で、成長軟骨の分化に対するC21orf2 遺伝子の影響を調べました(図2)。2種類の短いRNA(siRNA-1,2)を用いてC21orf2 遺伝子の発現を阻害したところ、II型コラーゲンやアグリカンなど、軟骨の分化マーカー遺伝子(軟骨の分化に伴って発現が上昇する遺伝子)の発現が低下しました。このことから、C21orf2 遺伝子は、軟骨の分化に必要であることが分かりました。以上のデータから、軸性脊椎骨幹端異形成症は、C21orf2 遺伝子の機能喪失変異により、網膜視細胞や成長軟骨細胞に繊毛の機能不全が起こり、その結果、発症すると考えられました。
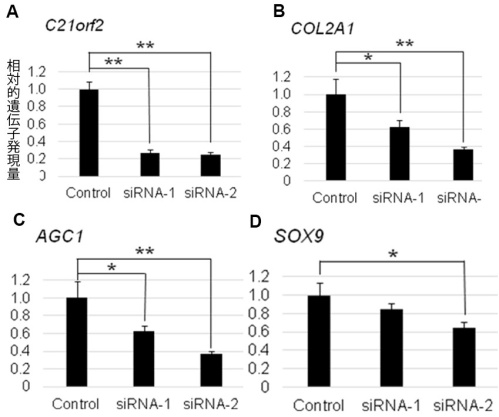
図2C21orf2 遺伝子の発現の阻害実験
2種類のsiRNA(siRNA-1,2)を用いてC21orf2 遺伝子の発現を阻害し、軟骨の分化のマーカー遺伝子のmRNAの発現を調べた。
A:siRNAによりC21orf2 遺伝子の発現が阻害されている。
B,C,D:軟骨の分化のマーカー遺伝子の発現。どちらのsiRNAにおいても、II型コラーゲンの遺伝子(C21orf2 遺伝子)、アグリカンの遺伝子(AGC1 遺伝子)、Sox9転写因子の遺伝子(SOX9 遺伝子)の3つのマーカー遺伝子の発現が低下し、軟骨の分化が遅いことが分かる。*: P< 0.05, **: P< 0.01.
共同研究グループは、エクソーム解析でC21orf2 遺伝子の変異が見つからなかった3家系4例のC21orf2 遺伝子の変異をサンガー法[9]で調べましたが変異は見つかりませんでした。これらの患者の表現型を確認したところ、臨床像、X線像にC21orf2 遺伝子の変異が見つかった6家系との差はありませんでした。また、3家系の1つである韓国人家系で、両親と患者兄妹のC21orf2 遺伝子領域のハプロタイプ(染色体上の各遺伝子座位にある対立遺伝子の組合せ)の解析を行ったところ、患者兄妹は、両親から異なったC21orf2 遺伝子領域を受け継いでおり(図3)、C21orf2 遺伝子は、彼らの疾患の原因遺伝子ではあり得ないことが分りました。これらのデータは軸性脊椎骨幹端異形成症にはC21orf2 遺伝子以外の原因遺伝子が存在することを示しています。
2種類のsiRNA(siRNA-1,2)を用いてC21orf2 遺伝子の発現を阻害し、軟骨の分化のマーカー遺伝子のmRNAの発現を調べた。
A:siRNAによりC21orf2 遺伝子の発現が阻害されている。
B,C,D:軟骨の分化のマーカー遺伝子の発現。どちらのsiRNAにおいても、II型コラーゲンの遺伝子(C21orf2 遺伝子)、アグリカンの遺伝子(AGC1 遺伝子)、Sox9転写因子の遺伝子(SOX9 遺伝子)の3つのマーカー遺伝子の発現が低下し、軟骨の分化が遅いことが分かる。*: P< 0.05, **: P< 0.01.
共同研究グループは、エクソーム解析でC21orf2 遺伝子の変異が見つからなかった3家系4例のC21orf2 遺伝子の変異をサンガー法[9]で調べましたが変異は見つかりませんでした。これらの患者の表現型を確認したところ、臨床像、X線像にC21orf2 遺伝子の変異が見つかった6家系との差はありませんでした。また、3家系の1つである韓国人家系で、両親と患者兄妹のC21orf2 遺伝子領域のハプロタイプ(染色体上の各遺伝子座位にある対立遺伝子の組合せ)の解析を行ったところ、患者兄妹は、両親から異なったC21orf2 遺伝子領域を受け継いでおり(図3)、C21orf2 遺伝子は、彼らの疾患の原因遺伝子ではあり得ないことが分りました。これらのデータは軸性脊椎骨幹端異形成症にはC21orf2 遺伝子以外の原因遺伝子が存在することを示しています。
図3患者兄妹とその両親のハプロタイプ解析
□父、○母、■兄、●妹。C21orf2 遺伝子が原因遺伝子である場合、患者兄妹は同じC21orf2 遺伝子の変異を持っているはずである。しかし、兄妹は、両親からそれぞれ異なったC21orf2 遺伝子領域を受け継いでいる。よって、C21orf2 遺伝子は、患者兄妹の疾患の原因でないことが分かる。
□父、○母、■兄、●妹。C21orf2 遺伝子が原因遺伝子である場合、患者兄妹は同じC21orf2 遺伝子の変異を持っているはずである。しかし、兄妹は、両親からそれぞれ異なったC21orf2 遺伝子領域を受け継いでいる。よって、C21orf2 遺伝子は、患者兄妹の疾患の原因でないことが分かる。
今後の期待
C21orf2 遺伝子が軸性脊椎骨幹端異形成症の原因遺伝子であると分かったことにより、遺伝子解析による同疾患の遺伝子診断、保因者診断が可能になりました。これにより、これまで不明瞭だった脊椎骨幹端異形成症グループの疾患の分類・整理が進み、臨床診断が容易になると期待できます。今後、共同研究グループは、C21orf2 遺伝子の機能解析を通じて、軸性脊椎骨幹端異形成症の発症機構・病態の解明、および、骨格、網膜の形成機構、視細胞、軟骨細胞の代謝機構の解明を目指します。これらが解明されると軸性脊椎骨幹端異形成症やその類縁疾患の画期的な治療法の開発が可能になると考えられます。また、これらの研究から得られる知見は、C21orf2 遺伝子の変異によって起こる網膜色素変性だけでなく、他の原因による網膜色素変性症にも適用できると期待できます。
論文情報
Axial Spondylometaphyseal Dysplasia Is Caused by C21orf2 Mutations.Zheng Wang, Aritoshi Iida, Noriko Miyake, Koji M. Nishiguchi, Kosuke Fujita, Toru Nakazawa, Abdulrahman Alswaid, Mohammed A. Albalwi, Ok-Hwa Kim, Tae-Joon Cho, Gye-Yeon Lim, Bertrand Isidor, Albert David, Cecilie F. Rustad, Else Merckoll, Jostein Westvik, Eva-Lena Stattin, Giedre Grigelioniene, Ikuyo Kou, Masahiro Nakajima, Hirohumi Ohashi, Sarah Smithson, Naomichi Matsumoto, Gen Nishimura, Shiro Ikegawa.
補足説明
[1] 網膜色素変性症
網膜変性症は、網膜を構成する特定の種類の細胞が加齢や遺伝的原因などで変性し、細胞の機能障害や脱落を起こす疾患で、失明を含む強度の視力障害を生じます。網膜色素変性症は網膜変性症の代表的な疾患で、視細胞が遺伝的原因などで変性して起こります。多くは中高年発症で、視細胞の変性は、長年かけてゆっくり起こることが多いが、一部若年発症のものもあります。暗いところで光を感知する棹体細胞が優先的に変性することで、初期には夜盲症(夜に物が見えない)で始まることが多く、次第に見える視野が狭まってゆき、ついには失明にいたることがあります。
[2] 常染色体劣性遺伝病
原因遺伝子が常染色体上に存在し、父母よりそれぞれ1つずつ受け継ぐその遺伝子の両方に異常があった時に発症する疾患。一方の遺伝子のみに異常があっても、疾患は発症しない(この場合、保因者となる)。
[3] 次世代シーケンサー
最近まで標準的に使われていたサンガー法に基づくDNAシーケンサーに対して、それと異なる原理に基づく、より高速・大量にDNA配列を解析できるシーケンサーのこと。多くの種類のシーケンサーが開発されている。
[4] エクソーム解析
ゲノムの中のタンパク質に関する情報を含むエクソン部分(ゲノム全体の約3%)を、次世代シーケンサーを用いて包括的に解析する方法。
[5] 骨系統疾患コンソーシアム
骨関節の単一遺伝病である骨系統疾患の医療の改善・発展を目指して立ち上げられた非営利組織。ホームページ:http://www.riken.jp/lab-www/OA-team/JSDC/
[6] 遺伝子多型
私たちの顔が個々人で異なるように、ヒトゲノムの全配列約30億塩基対は一人一人を比較すると、塩基配列に違いがみられる。この集団内での塩基配列の個人差を遺伝子多型と呼ぶ。
[7] スプライシング
真核生物の多くの遺伝子では、タンパク質のアミノ酸配列を指定する情報を持つ領域(エクソン)とタンパク質を持たない領域(イントロン)が混在している。DNAから転写されたmRNA前駆体からイントロンを除去してエクソン同士を連結する反応をスプライシングという。
[8] 捍体細胞(かんたいさいぼう)、錐体細胞(すいたいさいぼう)
網膜の2種類の視細胞(視覚情報を受容する細胞)。桿体細胞は暗所で機能し、光に対する感度が高い。錐体細胞は明所で機能し、光に対する感度は低いが色彩を識別する。
[9] サンガー法
DNAのシーケンス(DNAを構成するヌクレオチドの塩基の結合順序)の決定法のひとつ。次世代シーケンサーの出現以前は、標準的に使われていた。
<発表者>
理化学研究所統合生命医科学研究センター骨関節疾患研究チーム
チームリーダー池川志郎(いけがわしろう)
TEL:03-5449-5393FAX:03-5449-5393
E-mail:
<機関窓口>
理化学研究所広報室報道担当
TEL:048-467-9272FAX:048-462-4715
E-mail:
東北大学大学院医学系研究科・医学部広報室
TEL:022-717-7891FAX:022-717-8187
E-mail:
横浜市立大学先端研究推進課長立石 建
TEL:045-787-2510FAX:045-787-2509
E-mail:
—————————————————————————————————————
<共同研究グループ>
理化学研究所統合生命医科学研究センター骨関節疾患研究チーム
チームリーダー池川志郎(いけがわしろう)
研究員王铮/WANG Zheng(わんぜん)
上級研究員飯田有俊(いいだありとし)
東京都立小児総合医療センター放射線科
西村 玄(にしむらげん)
埼玉県立小児医療センター遺伝科
部長大橋 博文(おおはしひろふみ)
横浜市立大学学術院医学群遺伝学
准教授三宅紀子 (みやけのりこ)
教授松本直通(まつもとなおみち)
東北大学大学院医学系研究科視覚先端医療学寄付講座
准教授西口康二(にしぐちこうじ)
東北大学大学院医学系研究科感覚器制御学寄付講座
助手藤田幸輔(ふじたこうすけ)
東北大学大学院医学系研究科眼科学
教授中澤徹(なかざわとおる)
網膜変性症は、網膜を構成する特定の種類の細胞が加齢や遺伝的原因などで変性し、細胞の機能障害や脱落を起こす疾患で、失明を含む強度の視力障害を生じます。網膜色素変性症は網膜変性症の代表的な疾患で、視細胞が遺伝的原因などで変性して起こります。多くは中高年発症で、視細胞の変性は、長年かけてゆっくり起こることが多いが、一部若年発症のものもあります。暗いところで光を感知する棹体細胞が優先的に変性することで、初期には夜盲症(夜に物が見えない)で始まることが多く、次第に見える視野が狭まってゆき、ついには失明にいたることがあります。
[2] 常染色体劣性遺伝病
原因遺伝子が常染色体上に存在し、父母よりそれぞれ1つずつ受け継ぐその遺伝子の両方に異常があった時に発症する疾患。一方の遺伝子のみに異常があっても、疾患は発症しない(この場合、保因者となる)。
[3] 次世代シーケンサー
最近まで標準的に使われていたサンガー法に基づくDNAシーケンサーに対して、それと異なる原理に基づく、より高速・大量にDNA配列を解析できるシーケンサーのこと。多くの種類のシーケンサーが開発されている。
[4] エクソーム解析
ゲノムの中のタンパク質に関する情報を含むエクソン部分(ゲノム全体の約3%)を、次世代シーケンサーを用いて包括的に解析する方法。
[5] 骨系統疾患コンソーシアム
骨関節の単一遺伝病である骨系統疾患の医療の改善・発展を目指して立ち上げられた非営利組織。ホームページ:http://www.riken.jp/lab-www/OA-team/JSDC/
[6] 遺伝子多型
私たちの顔が個々人で異なるように、ヒトゲノムの全配列約30億塩基対は一人一人を比較すると、塩基配列に違いがみられる。この集団内での塩基配列の個人差を遺伝子多型と呼ぶ。
[7] スプライシング
真核生物の多くの遺伝子では、タンパク質のアミノ酸配列を指定する情報を持つ領域(エクソン)とタンパク質を持たない領域(イントロン)が混在している。DNAから転写されたmRNA前駆体からイントロンを除去してエクソン同士を連結する反応をスプライシングという。
[8] 捍体細胞(かんたいさいぼう)、錐体細胞(すいたいさいぼう)
網膜の2種類の視細胞(視覚情報を受容する細胞)。桿体細胞は暗所で機能し、光に対する感度が高い。錐体細胞は明所で機能し、光に対する感度は低いが色彩を識別する。
[9] サンガー法
DNAのシーケンス(DNAを構成するヌクレオチドの塩基の結合順序)の決定法のひとつ。次世代シーケンサーの出現以前は、標準的に使われていた。
<発表者>
理化学研究所統合生命医科学研究センター骨関節疾患研究チーム
チームリーダー池川志郎(いけがわしろう)
TEL:03-5449-5393FAX:03-5449-5393
E-mail:
<機関窓口>
理化学研究所広報室報道担当
TEL:048-467-9272FAX:048-462-4715
E-mail:
東北大学大学院医学系研究科・医学部広報室
TEL:022-717-7891FAX:022-717-8187
E-mail:
横浜市立大学先端研究推進課長立石 建
TEL:045-787-2510FAX:045-787-2509
E-mail:
—————————————————————————————————————
<共同研究グループ>
理化学研究所統合生命医科学研究センター骨関節疾患研究チーム
チームリーダー池川志郎(いけがわしろう)
研究員王铮/WANG Zheng(わんぜん)
上級研究員飯田有俊(いいだありとし)
東京都立小児総合医療センター放射線科
西村 玄(にしむらげん)
埼玉県立小児医療センター遺伝科
部長大橋 博文(おおはしひろふみ)
横浜市立大学学術院医学群遺伝学
准教授三宅紀子 (みやけのりこ)
教授松本直通(まつもとなおみち)
東北大学大学院医学系研究科視覚先端医療学寄付講座
准教授西口康二(にしぐちこうじ)
東北大学大学院医学系研究科感覚器制御学寄付講座
助手藤田幸輔(ふじたこうすけ)
東北大学大学院医学系研究科眼科学
教授中澤徹(なかざわとおる)
本学のお問い合わせ先
(資料の内容に関するお問い合わせ)
公立大学法人横浜市立大学学術院医学群遺伝学教授松本直通
TEL:045-787-2606 FAX:045-786-5219E-mail:
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学先端研究推進課長立石建
TEL:045-787-2510FAX:045-787-2509E-mail:
公立大学法人横浜市立大学学術院医学群遺伝学教授松本直通
TEL:045-787-2606 FAX:045-786-5219E-mail:
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学先端研究推進課長立石建
TEL:045-787-2510FAX:045-787-2509E-mail: