2022.11.24
- プレスリリース
- 研究
- 理学部
細胞運命を決定するタンパク質DNMT1の活性制御機構を解明
~立体構造解析に基づくがん・老化の新治療薬開発に期待~
横浜市立大学大学院生命医科学研究科 構造生物学研究室 菊地 杏美香さん(博士前期課程1年)、小野田 浩宜特任助教(現名古屋大学助教)、有田 恭平教授らを中心とした研究グループは、DNAメチル化の維持に関わるタンパク質DNMT1*1とその活性化因子であるユビキチン化*2されたヒストン*3H3、片鎖メチル化DNA*4の複合体構造をクライオ電子顕微鏡*5で決定しました。本成果は、DNMT1の新規の活性化機構の分子メカニズムを解明し、DNAメチル化の維持の破綻で生じるがんをはじめとした疾患に対する新たな薬剤開発の基盤となります(図1)。
本研究成果は、「Nature Communications」に掲載されました。また、この分野で最近発表されたベスト50の論文に選ばれ、エディターズ・ハイライト・ページで紹介されています。https://www.nature.com/collections/hhfigaahch
本研究成果は、「Nature Communications」に掲載されました。また、この分野で最近発表されたベスト50の論文に選ばれ、エディターズ・ハイライト・ページで紹介されています。https://www.nature.com/collections/hhfigaahch
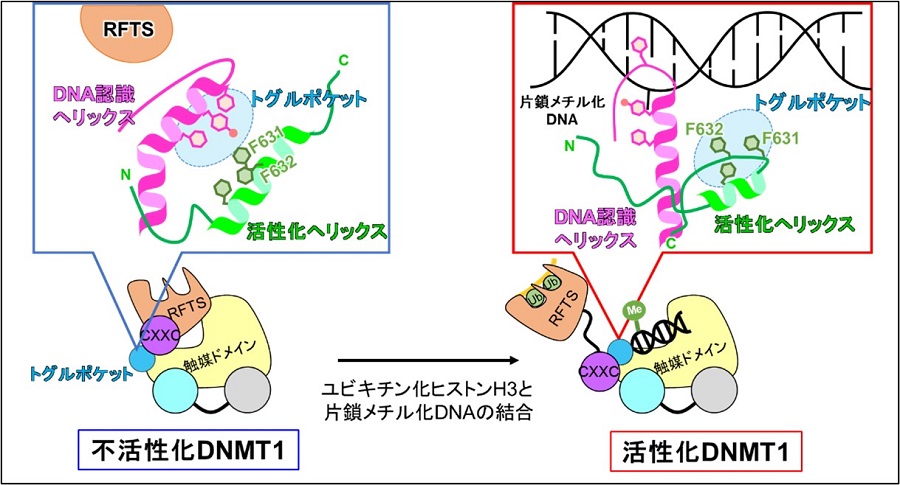
図1: DNMT1の活性化機構の概略図
左:不活性化状態のDNMT1のトグルポケット近傍の模式図。DNA認識ヘリックスがトグルポケットに入り込む。右:活性化状態のDNMT1のトグルポケット近傍の模式図。活性化ヘリックスがトグルポケットに入り込むことがDNMT1の活性化に必須。
左:不活性化状態のDNMT1のトグルポケット近傍の模式図。DNA認識ヘリックスがトグルポケットに入り込む。右:活性化状態のDNMT1のトグルポケット近傍の模式図。活性化ヘリックスがトグルポケットに入り込むことがDNMT1の活性化に必須。
研究成果のポイント
|
研究背景
生物は目や腕などを形づくるために必要な「設計図」を持っています。この設計図は細胞中のDNAが担い、DNA配列中に生物の形や性質(形質)を決める遺伝情報(遺伝子)が書き込まれています。ヒトの体は約270種類の細胞で構成されますが、たった1個の受精卵から細胞分裂してできているため、我々の身体の細胞は基本的に同じ遺伝情報を持ちます。なぜ同じ遺伝情報を持つにも関わらず、多種多様な細胞が存在するのでしょうか?これは、細胞が様々な働きを持つ細胞へと変化するにつれて、細胞ごとに使わない遺伝子に目印が付けられ、使う遺伝子が決定されるからです。このDNA上に目印をつけて遺伝子を使わないようにする現象を、「DNAメチル化」といいます。
哺乳類のDNAメチル化は、CG配列中のシトシン塩基にDNAメチル化酵素がメチル基(-CH3)を付加する現象です。細胞が一旦獲得したDNAメチル化の情報は、細胞の形質を維持するために生涯を通して、つまりDNA複製・細胞分裂後も正確に受け継がれます。これをDNA維持メチル化といいます。DNA維持メチル化の破綻は、がんをはじめ精神疾患や代謝疾患に関与することが知られています。
DNA維持メチル化には、DNAメチル化酵素DNMT1とその呼び込み因子UHRF1*6が必須です。DNA複製後、新生鎖はメチル化されないので、片鎖がメチル化されたDNA(片鎖メチル化DNA)が一過的に生じます。UHRF1は片鎖メチル化DNAを認識し、近傍のヌクレオソーム中のヒストンH3をユビキチン化します。我々は、2017年にDNMT1がRFTSドメインでユビキチン化ヒストンH3を認識し、片鎖メチル化DNAへ呼び込まれることを報告しました(Ishiyama et al., Moll Cell 2017: 2017年10月記者発表: 細胞固有の性質が遺伝する仕組みを解明)。さらに、ユビキチン化ヒストンH3は、DNMT1の酵素活性を促進することも明らかにしました。しかし、ユビキチン化ヒストンH3の結合がDNMT1の構造をどのようにダイナミックに変化させて活性化するのかは不明でした。また、このようなダイナミックな構造変化を伴う活性化機構を既存の構造生物学的な手法で解析するのは困難であることが予想されました。そこで本研究ではクライオ電子顕微鏡で、ユビキチン化ヒストンH3と片鎖メチル化DNAが結合した活性化状態のDNMT1の立体構造を決定し、DNMT1の酵素活性化機構の解明を目指しました。
哺乳類のDNAメチル化は、CG配列中のシトシン塩基にDNAメチル化酵素がメチル基(-CH3)を付加する現象です。細胞が一旦獲得したDNAメチル化の情報は、細胞の形質を維持するために生涯を通して、つまりDNA複製・細胞分裂後も正確に受け継がれます。これをDNA維持メチル化といいます。DNA維持メチル化の破綻は、がんをはじめ精神疾患や代謝疾患に関与することが知られています。
DNA維持メチル化には、DNAメチル化酵素DNMT1とその呼び込み因子UHRF1*6が必須です。DNA複製後、新生鎖はメチル化されないので、片鎖がメチル化されたDNA(片鎖メチル化DNA)が一過的に生じます。UHRF1は片鎖メチル化DNAを認識し、近傍のヌクレオソーム中のヒストンH3をユビキチン化します。我々は、2017年にDNMT1がRFTSドメインでユビキチン化ヒストンH3を認識し、片鎖メチル化DNAへ呼び込まれることを報告しました(Ishiyama et al., Moll Cell 2017: 2017年10月記者発表: 細胞固有の性質が遺伝する仕組みを解明)。さらに、ユビキチン化ヒストンH3は、DNMT1の酵素活性を促進することも明らかにしました。しかし、ユビキチン化ヒストンH3の結合がDNMT1の構造をどのようにダイナミックに変化させて活性化するのかは不明でした。また、このようなダイナミックな構造変化を伴う活性化機構を既存の構造生物学的な手法で解析するのは困難であることが予想されました。そこで本研究ではクライオ電子顕微鏡で、ユビキチン化ヒストンH3と片鎖メチル化DNAが結合した活性化状態のDNMT1の立体構造を決定し、DNMT1の酵素活性化機構の解明を目指しました。
研究内容
【クライオ電子顕微鏡による構造決定】
DNMT1-ユビキチン化ヒストンH3-片鎖メチル化DNA複合体の分子量(約170,000 Da)と、予想される構造柔軟性を考慮してクライオ電子顕微鏡で3者複合体の立体構造の決定を試みました。DNMT1は、18番目と23番目のリジン残基(K18, K23)がユビキチン化されたヒストンH3を特異的に認識します。本研究ではK18, K23の以外のリジン残基をアルギニン残基に置換したヒストンH3を作成し、試験管内ユビキチン化反応でK18, K23が特異的にユビキチン化されたヒストンH3を調製しました。また、DNAが結合した反応中間体のDNMT1の構造を観察するため、メチル化が起こるシトシンを5-フルオロシトシンに置換した片鎖メチル化DNAを調製しました。これらの試料調製を基に、加速電圧300 kVのクライオ電子顕微鏡を用いて、3者複合体の構造を2.5 Åの高分解能で決定しました。
【DNMT1の新規の酵素活性化の分子メカニズムの解明】
DNMT1は5つの機能ドメイン*7から成ります(図2)。DNAやユビキチン化ヒストンH3が結合していないDNMT1では、アミノ末端に位置するRFTSドメインが触媒ドメインのDNA結合部位に入り込んでおり、自己活性阻害型の構造を形成することが知られています (Zang et al., JMB 2015)。今回研究グループが決定した活性化型DNMT1の構造では、ユビキチン化ヒストンH3と片鎖メチル化DNAの結合によって、RFTSドメインは触媒ドメインから完全に解離していることがわかりました。クライオ電子顕微鏡を用いることで、活性化に伴うDNMT1のダイナミックな構造変化を明らかにできました。
さらにDNMT1のRFTSドメインとCXXCドメインの間に活性化のカギとなるモチーフ (活性化へリックス)と、触媒ドメインに活性を制御する疎水性ポケット(トグルポケット: トグルはスイッチの意味)があることを発見しました(図2)。DNMT1の触媒ドメインにはDNAの認識に働くDNA認識ヘリックスがあります。不活性化型DNMT1では、トグルポケットにDNA認識ヘリックスが曲がった状態で入り込んでいることがわかりました。これによりDNA認識ヘリックスは、たとえDNAが結合してもDNAに到達できず、その機能が阻害されていることがわかりました。一方で活性化型DNMT1では、トグルポケットに活性化へリックスが入り込んでいました。これにより、DNA認識ヘリックスはまっすぐ伸びた状態になり、DNAに結合できる状態になることがわかりました。つまりトグルポケットに入る領域が異なることで、DNMT1の活性が制御されることが明らかになりました(図3)。
DNMT1-ユビキチン化ヒストンH3-片鎖メチル化DNA複合体の分子量(約170,000 Da)と、予想される構造柔軟性を考慮してクライオ電子顕微鏡で3者複合体の立体構造の決定を試みました。DNMT1は、18番目と23番目のリジン残基(K18, K23)がユビキチン化されたヒストンH3を特異的に認識します。本研究ではK18, K23の以外のリジン残基をアルギニン残基に置換したヒストンH3を作成し、試験管内ユビキチン化反応でK18, K23が特異的にユビキチン化されたヒストンH3を調製しました。また、DNAが結合した反応中間体のDNMT1の構造を観察するため、メチル化が起こるシトシンを5-フルオロシトシンに置換した片鎖メチル化DNAを調製しました。これらの試料調製を基に、加速電圧300 kVのクライオ電子顕微鏡を用いて、3者複合体の構造を2.5 Åの高分解能で決定しました。
【DNMT1の新規の酵素活性化の分子メカニズムの解明】
DNMT1は5つの機能ドメイン*7から成ります(図2)。DNAやユビキチン化ヒストンH3が結合していないDNMT1では、アミノ末端に位置するRFTSドメインが触媒ドメインのDNA結合部位に入り込んでおり、自己活性阻害型の構造を形成することが知られています (Zang et al., JMB 2015)。今回研究グループが決定した活性化型DNMT1の構造では、ユビキチン化ヒストンH3と片鎖メチル化DNAの結合によって、RFTSドメインは触媒ドメインから完全に解離していることがわかりました。クライオ電子顕微鏡を用いることで、活性化に伴うDNMT1のダイナミックな構造変化を明らかにできました。
さらにDNMT1のRFTSドメインとCXXCドメインの間に活性化のカギとなるモチーフ (活性化へリックス)と、触媒ドメインに活性を制御する疎水性ポケット(トグルポケット: トグルはスイッチの意味)があることを発見しました(図2)。DNMT1の触媒ドメインにはDNAの認識に働くDNA認識ヘリックスがあります。不活性化型DNMT1では、トグルポケットにDNA認識ヘリックスが曲がった状態で入り込んでいることがわかりました。これによりDNA認識ヘリックスは、たとえDNAが結合してもDNAに到達できず、その機能が阻害されていることがわかりました。一方で活性化型DNMT1では、トグルポケットに活性化へリックスが入り込んでいました。これにより、DNA認識ヘリックスはまっすぐ伸びた状態になり、DNAに結合できる状態になることがわかりました。つまりトグルポケットに入る領域が異なることで、DNMT1の活性が制御されることが明らかになりました(図3)。
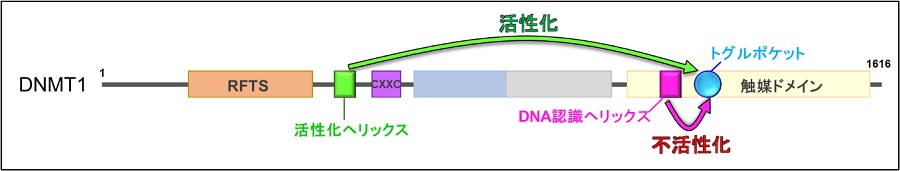
図2:DNMT1のドメイン構造
活性化型DNMT1では活性化ヘリックスがトグルポケットに入り込むが、不活性化型DNMT1ではDNA認識ヘリックスがトグルポケットに入り込む。
活性化型DNMT1では活性化ヘリックスがトグルポケットに入り込むが、不活性化型DNMT1ではDNA認識ヘリックスがトグルポケットに入り込む。
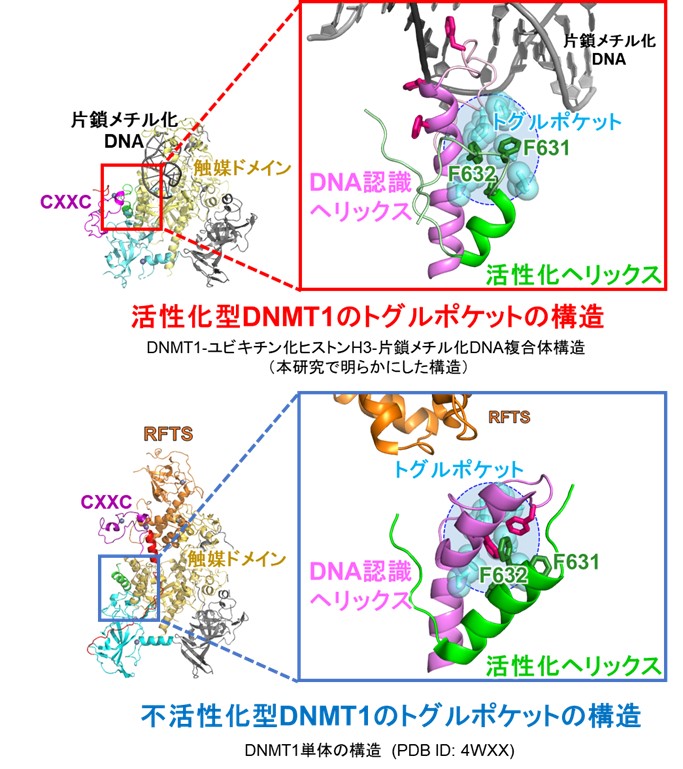
図3:活性化型DNMT1(上)と不活性型DNMT1(下)のトグルポケットの構造
緑:活性化ヘリックス、ピンク: DNA認識ヘリックス、水色: トグルポケット。本研究で活性化へリックス中のフェニルアラニン632と632 (F631, F632) がトグルポケットに入り込むことがDNMT1の活性化に必須であることが明らかになった。トグルポケットに結合する薬剤は、DNMT1がん関連する病気の治療薬になると期待される。
緑:活性化ヘリックス、ピンク: DNA認識ヘリックス、水色: トグルポケット。本研究で活性化へリックス中のフェニルアラニン632と632 (F631, F632) がトグルポケットに入り込むことがDNMT1の活性化に必須であることが明らかになった。トグルポケットに結合する薬剤は、DNMT1がん関連する病気の治療薬になると期待される。
【アフリカツメガエルや哺乳類細胞を用いた変異体DNMT1の機能解析】
DNMT1のトグルポケットには、活性化ヘリックス中の2つのフェニルアラニン残基(F631/F632)が入り込んでいました。そこで、活性化へリックス中のF631/F632がDNMT1の活性化に重要であると考え、フェニルアラニンをアラニンに置換した変異体DNMT1を作成して、その機能を評価しました。
試験管内で変異体DNMT1の機能を生化学的に検証した結果、変異体DNMT1は片鎖メチル化DNAへの結合が著しく低下し、その結果DNAメチル化活性が野生型DNMT1に比べて大幅に減少することがわかりました。この変異体DNMT1の機能を、アフリカツメガエル(東京大学 中西 真 教授、西山 敦史 准教授との共同研究)と大腸がん細胞株HCT116を用いて評価しました(パリ・ディドロ大学 Pierre-Antoine Defossez教授、山口 幸佑博士研究員との共同研究)。その結果、変異体DNMT1は細胞内でDNAメチル化の維持ができなくなっていることがわかりました。これにより、クライオ電子顕微鏡による構造解析で同定したDNMT1の新規の活性制御モチーフは、DNMT1が細胞内で正常な機能を発揮するためにも重要であることがわかりました。この活性化へリックス中の2つのフェニルアラニン残基は脊椎動物で高度に保存されています。したがって、活性化へリックスによるDNMT1の活性化は種を超えた分子メカニズムであることが考えられます。
DNMT1のトグルポケットには、活性化ヘリックス中の2つのフェニルアラニン残基(F631/F632)が入り込んでいました。そこで、活性化へリックス中のF631/F632がDNMT1の活性化に重要であると考え、フェニルアラニンをアラニンに置換した変異体DNMT1を作成して、その機能を評価しました。
試験管内で変異体DNMT1の機能を生化学的に検証した結果、変異体DNMT1は片鎖メチル化DNAへの結合が著しく低下し、その結果DNAメチル化活性が野生型DNMT1に比べて大幅に減少することがわかりました。この変異体DNMT1の機能を、アフリカツメガエル(東京大学 中西 真 教授、西山 敦史 准教授との共同研究)と大腸がん細胞株HCT116を用いて評価しました(パリ・ディドロ大学 Pierre-Antoine Defossez教授、山口 幸佑博士研究員との共同研究)。その結果、変異体DNMT1は細胞内でDNAメチル化の維持ができなくなっていることがわかりました。これにより、クライオ電子顕微鏡による構造解析で同定したDNMT1の新規の活性制御モチーフは、DNMT1が細胞内で正常な機能を発揮するためにも重要であることがわかりました。この活性化へリックス中の2つのフェニルアラニン残基は脊椎動物で高度に保存されています。したがって、活性化へリックスによるDNMT1の活性化は種を超えた分子メカニズムであることが考えられます。
今後の展開
我々の細胞が持つDNAメチル化の情報は、DNMT1の働きによって正確に受け継がれていきます。これにより細胞は、その形質を保ったまま正常に増殖できます。今回発見したDNMT1の新たな活性制御機構の発見は、DNMT1が忠実にメチル化を維持する分子メカニズムを解明し、DNA維持メチル化に新しい生物学的知見をもたらしました。
DNAメチル化の異常は様々ながん細胞で報告されており、立体構造情報を基に、DNAメチル化異常の改善を目指した薬剤開発が行われています。例えば、アメリカ食品医薬品局 (FDA)で承認されている骨髄異形成症候群の薬である5-アザシチジンは、DNAメチル化酵素のDNA結合部位を標的としています。しかし、この薬剤は副作用が大きくその使用は限定的です。DNAメチル化の制御はがんの薬剤開発につながるため、本研究で発見したDNAメチル化酵素の新規の活性制御部位は、既存の薬剤とは異なる作用機序でDNAメチル化を制御できる可能性があり、今後の創薬開発への展開が期待されます。また、最近の研究で、DNAメチル化レベルは組織や細胞の老化具合と相関があることが明らかとなり、老化の原因となることも示唆されています。したがって、本研究の成果は、老化が生じるメカニズムの解明への貢献や、加齢性疾患への新たな治療法および予防法の創出にも期待できます。
DNAメチル化の異常は様々ながん細胞で報告されており、立体構造情報を基に、DNAメチル化異常の改善を目指した薬剤開発が行われています。例えば、アメリカ食品医薬品局 (FDA)で承認されている骨髄異形成症候群の薬である5-アザシチジンは、DNAメチル化酵素のDNA結合部位を標的としています。しかし、この薬剤は副作用が大きくその使用は限定的です。DNAメチル化の制御はがんの薬剤開発につながるため、本研究で発見したDNAメチル化酵素の新規の活性制御部位は、既存の薬剤とは異なる作用機序でDNAメチル化を制御できる可能性があり、今後の創薬開発への展開が期待されます。また、最近の研究で、DNAメチル化レベルは組織や細胞の老化具合と相関があることが明らかとなり、老化の原因となることも示唆されています。したがって、本研究の成果は、老化が生じるメカニズムの解明への貢献や、加齢性疾患への新たな治療法および予防法の創出にも期待できます。
研究費
本研究は、JSPS科研費 新学術領域「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構(19H05741)」(JSPS科研費: 18H02392, 19H05294, 19H05285, 21H00272)をはじめ、武田科学振興財団(1871140003)、横浜市立大学(学長裁量事業)戦略的研究推進事業などの助成を受けて行われました。
論文情報
タイトル: Structural basis for activation of DNMT1
著者: Amika Kikuchi†, Hiroki Onoda†, Kosuke Yamaguchi, Satomi Kori, Shun Matsuzawa, Yoshie Chiba, Shota Tanimoto, Sae Yoshimi, Hiroki Sato, Atsushi Yamagata, Mikako Shirouzu, Naruhiko Adachi, Jafar Sharif, Haruhiko Koseki, Atsuya Nishiyama, Makoto Nakanishi, Pierre-Antoine Defossez, Kyohei Arita
†: equal contribution in this work.
掲載雑誌: Nature Communications
DOI:10.1038/s41467-022-34779-4
著者: Amika Kikuchi†, Hiroki Onoda†, Kosuke Yamaguchi, Satomi Kori, Shun Matsuzawa, Yoshie Chiba, Shota Tanimoto, Sae Yoshimi, Hiroki Sato, Atsushi Yamagata, Mikako Shirouzu, Naruhiko Adachi, Jafar Sharif, Haruhiko Koseki, Atsuya Nishiyama, Makoto Nakanishi, Pierre-Antoine Defossez, Kyohei Arita
†: equal contribution in this work.
掲載雑誌: Nature Communications
DOI:10.1038/s41467-022-34779-4
用語説明
*1 DNMT1:
片鎖メチル化DNAを基質とし、DNA中のシトシン塩基にメチル基を転移する反応を触媒する酵素。DNA維持メチル化に必須のタンパク質であり、その機能の異常は細胞のがん化に関わるため創薬のターゲットとなっている。
*2 ユビキチン(化):
76個のアミノ酸からなる球状タンパク質で、基質となるタンパク質のリジン残基に共有結合を介して付加される翻訳後修飾因子。基質に付加されたユビキチンのリジン残基には、さらにユビキチンが数珠状に付加されることがあり、タンパク質分解やシグナル伝達、DNA損傷修復などの様々な生命現象を制御する。
*3 ヒストン:
真核生物の染色体を構成するタンパク質で、H1、H2A、H2B、H3、H4の5種類が存在する。このうち、H2A、H2B、H3、H4を2分子ずつ含む8量体はヒストンコアとよばれ、これにゲノムDNAが巻き付くことでヌクレオソームという構造体を形成する。ヒストンはメチル化やユビキチン化などの様々な化学修飾を受け、遺伝子発現の調節に関与する。
*4 片鎖メチル化DNA:
哺乳類のDNAメチル化はCG配列中におこるので、2重鎖DNAの両鎖に対称的にメチル化が起こる。DNA複製の過程では、DNAポリメラーゼはメチル化の情報を新生鎖DNAに継承できないため、親鎖のみがメチル化された片鎖メチル化DNAが一過的に生じる。
*5クライオ電子顕微鏡:
凍結した生体分子に電子線を照射し、試料の観察を行う手法。試料の結晶化が不要なため、複合体等の大きな分子量のタンパク質の動的な構造解析が可能になる。
*6 UHRF1:
DNAメチル化維持に必須の役割をするタンパク質。片鎖メチル化DNAへの結合や、9番目のリジンがメチル化されたヒストンH3への結合、ヒストンH3や複製因子PAF15のユビキチン化など様々な機能を発揮することで、DNAメチル化パターンの複製を誘導する。がん細胞では過剰発現しており、異常な細胞増殖に関与する。
*7 ドメイン:
タンパク質中に存在する特定の立体構造と機能を持つ領域。
片鎖メチル化DNAを基質とし、DNA中のシトシン塩基にメチル基を転移する反応を触媒する酵素。DNA維持メチル化に必須のタンパク質であり、その機能の異常は細胞のがん化に関わるため創薬のターゲットとなっている。
*2 ユビキチン(化):
76個のアミノ酸からなる球状タンパク質で、基質となるタンパク質のリジン残基に共有結合を介して付加される翻訳後修飾因子。基質に付加されたユビキチンのリジン残基には、さらにユビキチンが数珠状に付加されることがあり、タンパク質分解やシグナル伝達、DNA損傷修復などの様々な生命現象を制御する。
*3 ヒストン:
真核生物の染色体を構成するタンパク質で、H1、H2A、H2B、H3、H4の5種類が存在する。このうち、H2A、H2B、H3、H4を2分子ずつ含む8量体はヒストンコアとよばれ、これにゲノムDNAが巻き付くことでヌクレオソームという構造体を形成する。ヒストンはメチル化やユビキチン化などの様々な化学修飾を受け、遺伝子発現の調節に関与する。
*4 片鎖メチル化DNA:
哺乳類のDNAメチル化はCG配列中におこるので、2重鎖DNAの両鎖に対称的にメチル化が起こる。DNA複製の過程では、DNAポリメラーゼはメチル化の情報を新生鎖DNAに継承できないため、親鎖のみがメチル化された片鎖メチル化DNAが一過的に生じる。
*5クライオ電子顕微鏡:
凍結した生体分子に電子線を照射し、試料の観察を行う手法。試料の結晶化が不要なため、複合体等の大きな分子量のタンパク質の動的な構造解析が可能になる。
*6 UHRF1:
DNAメチル化維持に必須の役割をするタンパク質。片鎖メチル化DNAへの結合や、9番目のリジンがメチル化されたヒストンH3への結合、ヒストンH3や複製因子PAF15のユビキチン化など様々な機能を発揮することで、DNAメチル化パターンの複製を誘導する。がん細胞では過剰発現しており、異常な細胞増殖に関与する。
*7 ドメイン:
タンパク質中に存在する特定の立体構造と機能を持つ領域。
参考文献など
Structure of the Dnmt1 reader module complexed with a unique two-mono-ubiquitin mark on histone H3 reveals the basis for DNA methylation maintenance
Ishiyama et al., 2017, Molecular Cell 68, 350-360
https://doi.org/10.1016/j.molcel.2017.09.037
Crystal Structure of Human DNA Methyltransferase 1
Zhang et al., 2015, Journal of Molecular Biology 427, 2520-2531
https://www.sciencedirect.com/science/article/pii/S0022283615003411?via%3Dihub
Ishiyama et al., 2017, Molecular Cell 68, 350-360
https://doi.org/10.1016/j.molcel.2017.09.037
Crystal Structure of Human DNA Methyltransferase 1
Zhang et al., 2015, Journal of Molecular Biology 427, 2520-2531
https://www.sciencedirect.com/science/article/pii/S0022283615003411?via%3Dihub



