2021.09.01
- プレスリリース
- 研究
世界初 スギのゲノム編集技術を開発 ~針葉樹の品種改良を⼤幅に短縮する新技術として期待~
横浜市立大学大学院生命ナノシステム科学研究科(木原生物学研究所)遠藤 真咲 客員准教授が、主所属である農研機構より8月31日付けでプレスリリースを発表しました。
また、本論文は、本学の生命ナノシステム科学研究科(木原生物学研究所)において博士号を取得した三上雅史さんが在学当時に取り組まれた研究成果です。
また、本論文は、本学の生命ナノシステム科学研究科(木原生物学研究所)において博士号を取得した三上雅史さんが在学当時に取り組まれた研究成果です。
ポイント
|
概要
林⽊の品種改良には交配と優良系統の選抜からなる地道な作業が必要で、世代の更新(次世代化)に10年単位の時間を要します。⼀⽅、⼈⼯DNA切断酵素を利⽤して、狙った遺伝⼦領域だけを特異的に改変する「ゲノム編集技術」は、育種期間を⼤幅に短縮す る新技術として注⽬されてきましたが、針葉樹での利⽤はこれまでに報告されていませんでした。森林総合研究所森林バイオ研究センターは、森林総合研究所、農研機構、横浜市⽴⼤学と共同で、CRISPR/Cas9システムをスギに最適化することで、世界で初めて針葉樹のゲノム編集に成功しました。
本研究成果は、国際科学雑誌『Scientific Reports』オンライン版(8 ⽉10⽇付)に掲載されました。
本研究成果は、国際科学雑誌『Scientific Reports』オンライン版(8 ⽉10⽇付)に掲載されました。
背景
林⽊育種は交配と優良個体の選抜を⼀連とする作業ですが、世代の更新(次世代化)には10 年以上の⻑い歳⽉と多⼤な労⼒を必要とします。林⽊育種の期間を短縮するために、DNAマーカーを⽤いた優良系統の早期選抜など、ゲノム情報に基づいた新育種技術も開発されてきました。しかし、有⽤な形質(例えば、無花粉かつ初期成⻑量や材質がよいなど)を複数兼ね備えた系統を直接得るためには、新たな技術開発が必要となります。
DNAの狙った領域のみをピンポイントに改変するゲノム編集技術は、2012年に発表されたCRISPR/Cas9 システム[1]により様々な⽣物へ爆発的に広まりました。そして、ゲノム編集は育種期間を⼤幅に短縮し、さらに複数の形質を同時に改変した系統を創出する⾰新的な技術として、林⽊への利⽤が期待されてきました。2015年には広葉樹のモデルであるポプラにおいてゲノム編集が報告されましたが、針葉樹においては報告がありませんでした。そこで研究チームは、我が国の主要な針葉樹であるスギにおいてゲノム編集を試みました。
DNAの狙った領域のみをピンポイントに改変するゲノム編集技術は、2012年に発表されたCRISPR/Cas9 システム[1]により様々な⽣物へ爆発的に広まりました。そして、ゲノム編集は育種期間を⼤幅に短縮し、さらに複数の形質を同時に改変した系統を創出する⾰新的な技術として、林⽊への利⽤が期待されてきました。2015年には広葉樹のモデルであるポプラにおいてゲノム編集が報告されましたが、針葉樹においては報告がありませんでした。そこで研究チームは、我が国の主要な針葉樹であるスギにおいてゲノム編集を試みました。
成果
植物で⼀般的に⽤いられているアグロバクテリウム法[2]にて、CRISPR/Cas9 遺伝⼦ベク ター[3]をスギ不定胚形成細胞[4](以下、「細胞」とします)へ導⼊しました。その際、CRISPR/Cas9システムがスギで効率的に機能するように、ベクター構造の最適化を試みました。最適化の検証⽅法として、あらかじめ緑⾊蛍光タンパク質(GFP)[5]を導⼊し蛍光を有するスギの遺伝⼦組換え細胞系統を⽤意し、GFP遺伝⼦を標的としたゲノム編集による改変効率を調査する⽅法をとりました。GFP遺伝⼦が改変されると蛍光が消えた細胞系 統が得られます (図1)。ベクター構造を改良した結果、最⼤41.4%の効率でGFP 蛍光が消失した細胞系統が得られました。
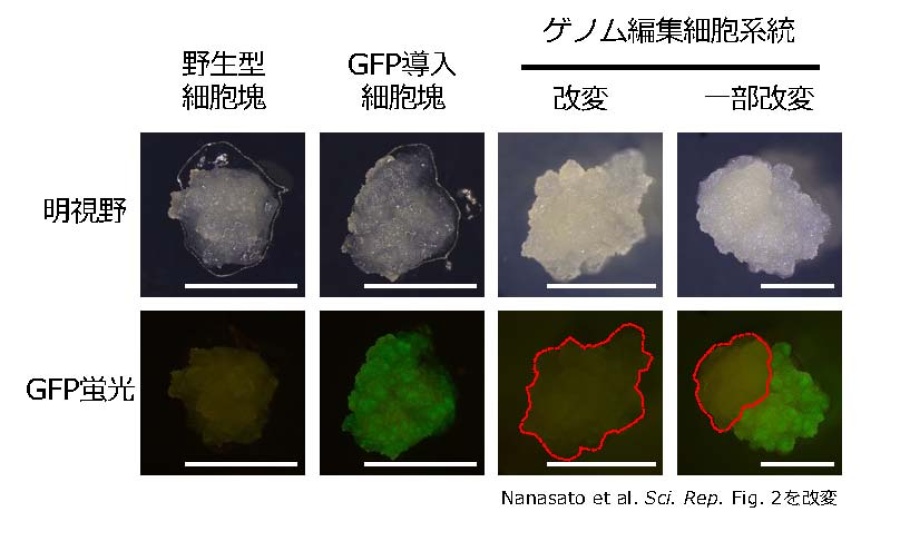 図1 GFP導入細胞のゲノム編集。 ー赤破線で囲んだ部分はゲノム編集によりGFP遺伝子が改変し、蛍光を失った部分を示す。スケールバー:5mm。
図1 GFP導入細胞のゲノム編集。 ー赤破線で囲んだ部分はゲノム編集によりGFP遺伝子が改変し、蛍光を失った部分を示す。スケールバー:5mm。
この調査から、ゲノム編集に成功した細胞系統において、(i) 全ての細胞でゲノム編集に 成功して細胞塊全体からGFP蛍光が消えている系統と、(ii) 細胞塊の⼀部分のみでゲノム編集が起き、GFP蛍光の消失が細胞塊の⼀部分で⾒られる系統、という2つのパターンに分かれることがわかりました。もし、(ii)の細胞塊から個体再⽣をした個体が、ゲノム編集されている細胞とされていない細胞がいり混じった「キメラ」[6]であるならば、林⽊育種への利⽤は難しくなります。そこで、細胞の⼀部分でのみゲノム編集が起きている6つの細胞系統から不定胚[7]を誘導し、個々のGFP遺伝⼦の塩基配列を解析しました。その結果、計102の胚のうちひとつを除いた101について単⼀の塩基配列を⽰すことが明らかとなりました。これは、⼀部分でのみゲノム編集が起きている細胞系統であっても、「キメラ」個体ができる確率は⾮常に低いということを⽰しています(図2)。
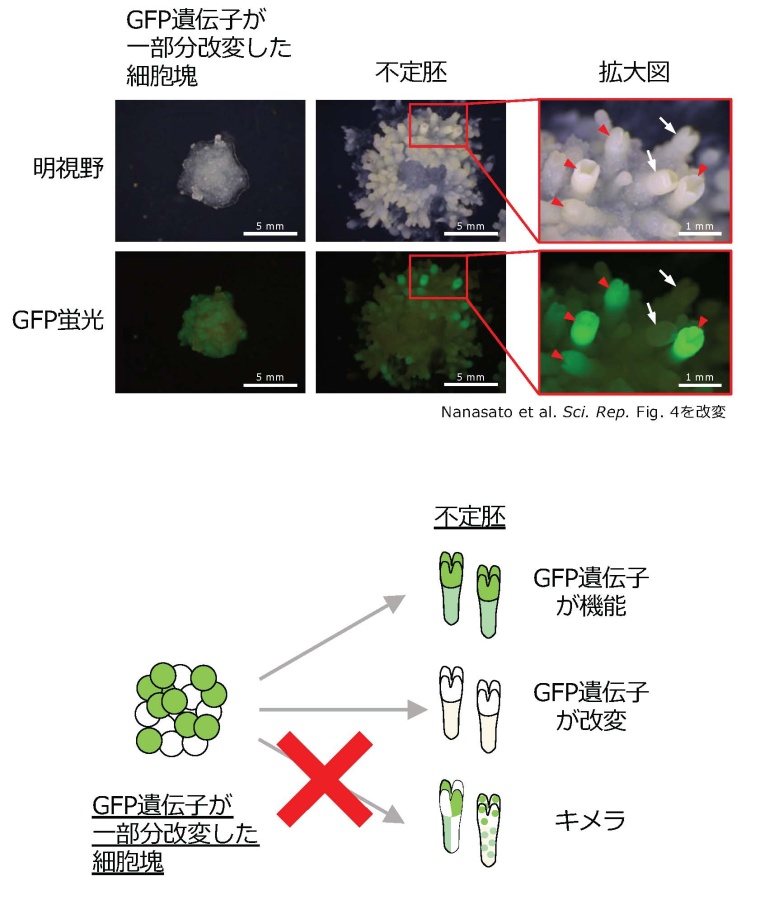 図2 ゲノム編集により細胞塊の一部分が改変した細胞系統から誘導した不定胚の調査。 ーGFP遺伝子が一部分改変した細胞塊から誘導した不定胚は、「GFP遺伝子が機能しているもの」と「GFP遺伝子が改変したもの」に分離し、GFP遺伝子が一部分で機能する「キメラ」が得られる割合は非常に低い(約1%)ことが明らかとなった。赤矢印:GFP蛍光を発する不定胚、白矢印:GFP蛍光が消えた不定胚。
図2 ゲノム編集により細胞塊の一部分が改変した細胞系統から誘導した不定胚の調査。 ーGFP遺伝子が一部分改変した細胞塊から誘導した不定胚は、「GFP遺伝子が機能しているもの」と「GFP遺伝子が改変したもの」に分離し、GFP遺伝子が一部分で機能する「キメラ」が得られる割合は非常に低い(約1%)ことが明らかとなった。赤矢印:GFP蛍光を発する不定胚、白矢印:GFP蛍光が消えた不定胚。
続いて、ゲノム編集がスギの内在遺伝⼦の改変にも利⽤できるかを検証するために、葉緑素の⽣合成に関与するマグネシウムキラターゼ遺伝⼦を標的としたゲノム編集を試みました。本遺伝⼦を改変すると葉緑素の合成が阻害され⽩化した個体が得られるため、ゲノム編集の成否が容易に判別できます。その結果、⽩化個体を創り出すことに成功すると共に、標的領域の塩基配列が改変されていることも明らかとなりました(図3)。本成果は針葉樹であるスギでゲノム編集に成功した世界初の成果となります。
 図3 ゲノム編集によりマグネシウムキラターゼ遺伝子を改変したスギ個体。 -写真は培地に置床してそれぞれ231日間成育させた植物体。ゲノム編集に成功した個体の葉は白化し、成育に著しい遅延が生じた。また、標的領域において様々な塩基欠失や塩基挿入が見られた。スケールバー:1cm。
図3 ゲノム編集によりマグネシウムキラターゼ遺伝子を改変したスギ個体。 -写真は培地に置床してそれぞれ231日間成育させた植物体。ゲノム編集に成功した個体の葉は白化し、成育に著しい遅延が生じた。また、標的領域において様々な塩基欠失や塩基挿入が見られた。スケールバー:1cm。
今後の展望
本研究により、CRISPR/Cas9システムによる針葉樹のゲノム編集が可能であることが⽰されました。ゲノム編集により意図したとおりの遺伝⼦改変ができたことは、優良系統に無花粉化の形質を付加するなど、ピンポイントかつ効率的に望ましい形質を付与できる可能性を⽰しています。今後、ゲノム編集技術は、スギの品種改良技術の選択肢のひとつとして利⽤が期待されます。現在、本⼿法を利⽤したスギの無花粉化、ゲノム編集効率をさらに良くする改良法の開発、そしてスギ以外の主要樹種へのゲノム編集技術を応⽤する研究を進めています。
⽤語の解説
[1] CRISPR/Cas9 システム:アーキア(古細菌)や真正細菌が持つ⽣体防御システムを利⽤したゲノム編集技術のひとつ。⼈⼯制限酵素として利⽤する化膿レンサ球菌由来の Cas9 と、標的DNAを認識する分⼦としてガイドRNAと呼ばれる100bpほどの短い RNAからなる。Cas9とガイドRNAは複合体を形成し、標的DNA配列だけを特異的に切断することで、標的の遺伝⼦のみに変化を加えることができる。
[2] アグロバクテリウム法:⼟壌細菌アグロバクテリウム(学名Rhizobium radiobacter、旧学名Agrobacterium tumefaciens )は植物細胞に感染して、⾃⾝が有するTiプラスミドの⼀部、T-DNAと呼ばれるDNA領域を植物細胞のゲノムDNAに挿⼊する性質 がある。この性質を利⽤して、植物細胞へ任意の外来遺伝⼦を導⼊する⽅法をさす。
[3] ベクター: 「遺伝⼦の運び屋」という意味を持ち、ここではアグロバクテリウムに保持させる「バイナリーベクター」といわれる⼈⼯環状DNAをさす。このバイナリーベクターには上記[2]のT-DNA領域を含み、任意の遺伝⼦をT-DNA上に連結させることで、アグロバクテリウムを介した植物への遺伝⼦導⼊が可能となる。
[4] 不定胚形成細胞: 未熟種⼦胚由来の培養細胞の⼀種。スギは本細胞から不定胚形成を経た個体再⽣が可能。また、不定胚形成細胞の形質転換技術も当センターで開発されている。
[5] GFP:オワンクラゲから単離された緑⾊蛍光タンパク質(Green fluorescent protein)をさす。⻘⾊の光を照射すると緑⾊の蛍光を発する。
[6] キメラ:同⼀の個体において遺伝的に異なる細胞が混じっている⽣物。ここでは、GFP蛍光を有する細胞とGFP蛍光が⾒られない細胞が混じっている状態をさす。
[7] 不定胚:種⼦中にある胚と類似構造をもち、組織培養により⼈⼯的に発⽣させた胚をさす。スギを含む多くの針葉樹においては、上記[4]の不定胚形成細胞からのみ誘導が可能である。
[2] アグロバクテリウム法:⼟壌細菌アグロバクテリウム(学名Rhizobium radiobacter、旧学名Agrobacterium tumefaciens )は植物細胞に感染して、⾃⾝が有するTiプラスミドの⼀部、T-DNAと呼ばれるDNA領域を植物細胞のゲノムDNAに挿⼊する性質 がある。この性質を利⽤して、植物細胞へ任意の外来遺伝⼦を導⼊する⽅法をさす。
[3] ベクター: 「遺伝⼦の運び屋」という意味を持ち、ここではアグロバクテリウムに保持させる「バイナリーベクター」といわれる⼈⼯環状DNAをさす。このバイナリーベクターには上記[2]のT-DNA領域を含み、任意の遺伝⼦をT-DNA上に連結させることで、アグロバクテリウムを介した植物への遺伝⼦導⼊が可能となる。
[4] 不定胚形成細胞: 未熟種⼦胚由来の培養細胞の⼀種。スギは本細胞から不定胚形成を経た個体再⽣が可能。また、不定胚形成細胞の形質転換技術も当センターで開発されている。
[5] GFP:オワンクラゲから単離された緑⾊蛍光タンパク質(Green fluorescent protein)をさす。⻘⾊の光を照射すると緑⾊の蛍光を発する。
[6] キメラ:同⼀の個体において遺伝的に異なる細胞が混じっている⽣物。ここでは、GFP蛍光を有する細胞とGFP蛍光が⾒られない細胞が混じっている状態をさす。
[7] 不定胚:種⼦中にある胚と類似構造をもち、組織培養により⼈⼯的に発⽣させた胚をさす。スギを含む多くの針葉樹においては、上記[4]の不定胚形成細胞からのみ誘導が可能である。
論⽂情報
Yoshihiko Nanasato, Masafumi Mikami, Norihiro Futamura, Masaki Endo, Mitsuru Nishiguchi, Yasunori Ohmiya, Ken-ichi Konagaya, Toru Taniguchi ”CRISPR/Cas9- mediated targeted mutagenesis in Japanese cedar (Cryptomeria japonica D. Don)” Scientific Reports, (https://doi.org/10.1038/s41598-021-95547-w).
研究⽀援
本研究は、以下の⽀援を受けて⾏われました。
⽇本学術振興会 科学研究費 基盤B (JP16H04942)、基盤C (JP17K07854)
⽇本学術振興会 科学研究費 基盤B (JP16H04942)、基盤C (JP17K07854)
