2021.02.02
- TOPICS
- 研究
ムール貝のR-型レクチン「セヴィル」の立体構造を決定
- レクチン創薬への利用に期待 -
『Scientific Reports』に掲載(12月16日オンライン)

横浜市立大学大学院 生命医科学研究科 鎌田健一 研究員、ジェレミー・テイム 教授、水谷健二 助教、朴 三用 教授、小沼 剛 助教、池上貴久 教授、生命ナノシステム科学研究科 大関泰裕 教授は、イタリア共和国フェデリコⅡ世ナポリ大学 ロベルタ・マルケッティ 博士、アルバ・シリポ 教授らと国際共同研究を行い、ムール貝の持つR-型レクチン『セヴィル』の立体構造を決定しました。構造を決定した結果、セヴィル(レクチン)と糖鎖の結合によって赤血球凝集活性を消失させることが分かりました。今後、この機序を解明することでがん治療などの免疫疾患に作用するレクチン創薬への利用が期待されます。
セヴィルの具体的な構造はサブユニットの二量体化からなり、各サブユニットはβ-トレフォイル骨格を有することが判明しました。セヴィルはガングリオシド糖鎖内部の3糖を認識し、糖鎖内のシアル酸の位置も見分ける、きわめて高い糖鎖結合特異性を有していることが、原子レベルで証明されました。このレクチンは抗腫瘍活性と糖脂質ガングリオシド糖鎖結合性を持つことが分かっており、また遺伝子組み換え大腸菌を用いて、室温で安定なセヴィルを大量に作製できたことから、レクチン創薬への利用が期待されます。
本成果の一部は、海と産業革新コンベンション(ON LINE うみコン2021)で報告されます。(2月25日(木))
研究成果のポイント
|
研究の背景
レクチンは、糖鎖と結合するタンパク質です。生物の細胞は様々な糖鎖でおおわれており、その多様な構造を認識するレクチンもまた多数存在しています。それらの結合により、ヒトや動物で病原体の感染、免疫活性化、細胞増殖などのはたらきがあることが知られています。
海の動物は、動物の祖先に近い、すなわち進化の基盤となる遺伝子を豊富に持ち、そのレクチンも多様な構造と機能が発見されています。われわれは、ムール貝からレクチン「セヴィル」を発見し、これが植物毒素のリシン(ricin)-B鎖のアミノ酸配列に似た「R-型レクチンファミリー」に属するものであることを明らかにしてきました。さらに、セヴィルはヒトのナチュラルキラー細胞のマーカーである糖脂質「アシアロ-GM1」、およびギラン・バレー症候群により作られる自己抗体の認識する「GM1b」ガングリオシド糖鎖と結合し、これらの糖鎖を持つがん細胞にセヴィルを投与すると、細胞増殖を抑制することを報告しました。
R-型レクチンであるセヴィルはβ-トレフォイル(三つ葉)骨格と呼ばれる立体構造をとると推察されましたが、その機能を理解するには、それがどのような会合状態で存在し、糖鎖と結合しているかといった情報が必要でした。例えば、セヴィルはアシアロ-GM (Galβ1-3GalNAcβ1-4Galβ1-4Glc)、GM1b(Siaα2-3Galβ1-3GalNAcβ1-4Galβ1-4Glc)という、がんの免疫に重要なナチュラルキラー細胞や、自己免疫疾患の原因になるカンピロバクター菌に存在する特殊な糖脂質糖鎖に結合します。これを診断・治療に利用するには、糖鎖のどの部分をレクチンが認識しているかの解明も必要です。これらを明らかにする目的から、今回、セヴィルの立体構造の決定を行いました。
研究概要と成果
まずは、東アジアのイガイ科ムラサキインコガイ(Mytilisepta virgata)の鰓(エラ)から得たセヴィルを、アミノ酸配列をもとに遺伝子組み換え技術で大腸菌に作らせ、X線結晶構造解析法で立体構造を決定しました。その結果、セヴィルはβ-トレフォイル骨格のサブユニットからなる二量体レクチンで、各サブユニットには3個のサブドメインが含まれていました。そして、そのうち第一サブドメインのみに糖鎖結合活性が認められ、細胞表面の糖鎖を挟むようにして結合し、細胞に作用することが明らかとなりました(図上)。
さらに、セヴィルはアシアロ-GM1、GM1bガングリオシド糖鎖の持つ3糖構造 (Galβ1-3GalNAcβ1-4Gal)を認識して結合することが原子レベルで証明されました(図下)。一方、ガングリオシド糖鎖の代表でコレラ毒素の標的として知られるGM1 (Galβ1-3GalNAcβ1-4[Siaα2-3]Galβ1-4Glc)とは結合せず、この3糖に付いたシアル酸(Sia)の位置を見分けており、きわめて高い糖鎖結合特異性を有することが判明しました。また、サブユニットの二量体化に働くアミノ酸配列を改変し、単量体セヴィルを作ると、糖鎖結合性を持ちながら、レクチン創薬上の課題である赤血球凝集活性を消失させることができました。
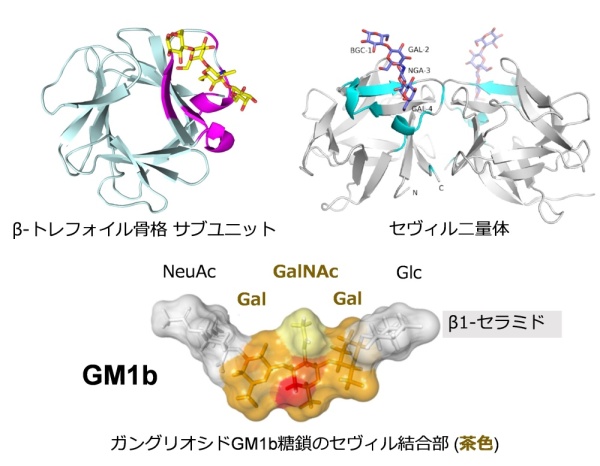
図 セヴィルの立体構造と糖鎖結合性の概要
今後の展開
β-トレフォイル骨格を作る遺伝子は、ウイルスから哺乳類まで生物界に広く存在し、レクチンのみならず、細胞成長因子(IL-1、線維芽細胞増殖因子FGF)や酵素(細菌キシラナーゼ、植物チロシナーゼ)、レセプター(哺乳類マンノースレセプター、ホスホリパーゼレセプター)、毒素(リシン毒素、ボツリヌス菌毒素)などにも存在します。これは本骨格が、生物進化の初期に出現し、進化の過程で変化して様々な機能を持つようになった、機能上で高い汎用性を持つ骨格であることを示唆します。本研究で確立した遺伝子組み換えセヴィルの作製法と、β-トレフォイル骨格が有する特異的な糖鎖結合性をさらに改良し、診断プローブや、細胞の分化増殖を糖鎖認識で調節するレクチン創薬へと展開してゆきます。
論文情報
The structure of SeviL, a GM1b/asialo-GM1 binding R-type lectin from the mussel Mytilisepta virgata.
Kenichi Kamata, Kenji Mizutani, Katsuya Takahashi, Roberta Marchetti, Alba Silipo, Christine Addy, Sam-Yong Park, Yuki Fujii, Hideaki Fujita, Tsuyoshi Konuma, Takahisa Ikegami, Yasuhiro Ozeki, Jeremy R. H. Tame.
Scientific Reports (2020) DOI:https://doi.org/10.1038/s41598-020-78926-7
研究費情報
本研究は、OpenEye Scientific Software 、科研費補助金JP18K06091、JP18H02413、JP16K14683、JP19K06239、横浜ライフイノベーションプラットフォーム リーディング事業助成金.、横浜市立大学基礎研究費 を受けて行われました。
研究体制
(1)横浜市立大学
大学院生命医科学研究科
ジェレミー R.H. テイム 教授(構造創薬科学)
鎌田健一 研究員
水谷健二 助教
朴 三用 教授
小沼 剛 助教
池上貴久 教授
大学院生命ナノシステム科学研究科
大関泰裕 教授 (糖鎖生物学)
(2)フェデリコⅡ世ナポリ大学(イタリア共和国)
ロベルタ・マルケッティ 博士
アルバ・シリポ 教授