2020.08.04
- プレスリリース
- 研究
クロマチンの活性型と不活性型の基本構造
エピゲノムにおけるヌクレオソーム中の ヒストンの末端間相互作用の変化を解明
横浜市立大学大学院生命医科学研究科の古川亜矢子特任助教と西村善文特任教授(広島大学大学院統合生命科学研究科長兼任)らは、理化学研究所生命機能科学研究センターの梅原崇史チームリーダーらとの共同研究で、NMRという特殊な分光器を用いて、遺伝子活性化に関与するクロマチンの基本構造であるヌクレオソームの動的な構造変化を初めて解明しました。
本研究は、『米国科学アカデミー紀要:Proceedings of the National Academy of Sciences of the United States of America』に掲載されました。(日本時間8 月4日午前4時オンライン)
本研究は、『米国科学アカデミー紀要:Proceedings of the National Academy of Sciences of the United States of America』に掲載されました。(日本時間8 月4日午前4時オンライン)
研究成果のポイント
|
研究の背景
真核生物のゲノムDNA*1は、クロマチン構造という形でコンパクトに細胞核内に収納されています。クロマチン構造は、基本構造である4種類のヒストン(H2A、H2B、H3、H4)の各2個が形成した8個のタンパク質複合体に約146塩基対のDNAが巻き付いたヌクレオソームが、数珠状に連なっています。このヒストンタンパク質は、様々な翻訳後修飾を受けることで、遺伝子発現の制御を行っており、このDNA配列の変化を伴わない遺伝子発現の制御はエピゲノムとして知られています。ある翻訳後修飾は、ヌクレオソームを凝集させる(ヘテロクロマチン)ことによって遺伝子発現の抑制を、また別の翻訳後修飾は、ヌクレオソーム同士の間隔を広げる(ユークロマチン)ことによって遺伝子発現の活性化を行います。遺伝子発現の調節は、個体発生、細胞の増殖・分化など、様々な生物学的事象の制御やがんや神経疾患など多くの疾病に関わる重要な機構です。
ヌクレオソームは4種類のヒストンが作る集合体にDNAが巻き付いた構造で、中核の部分はスイスのグループが1997年にX線結晶構造解析で詳細な構造を発表し、その後様々な構造がX線やクライオ電子顕微鏡法などで発表されてきました。しかし、これまでの構造解析では、染色体構造の変化の原因となるヌクレオソームの中核から突き出ているヒストンの末端構造は、紐様の構造がなびくようにふらふらと動いているため、動的な構造を解析することが難しいX線や電子顕微鏡では見えていませんでした。(図1)。
ヌクレオソームは4種類のヒストンが作る集合体にDNAが巻き付いた構造で、中核の部分はスイスのグループが1997年にX線結晶構造解析で詳細な構造を発表し、その後様々な構造がX線やクライオ電子顕微鏡法などで発表されてきました。しかし、これまでの構造解析では、染色体構造の変化の原因となるヌクレオソームの中核から突き出ているヒストンの末端構造は、紐様の構造がなびくようにふらふらと動いているため、動的な構造を解析することが難しいX線や電子顕微鏡では見えていませんでした。(図1)。
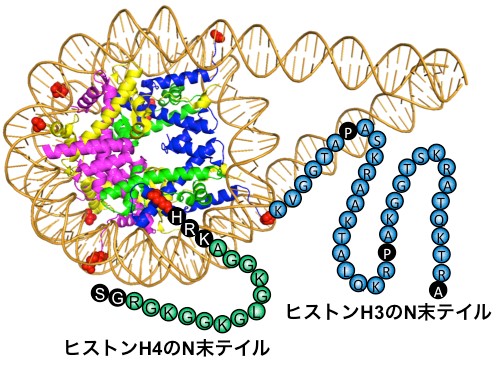
図1. ヌクレオソームの中核構造とヒストン
H3とH4の末端(N末テイル)構造の模式図。中核構造のらせん部位はヒストンH2Aが黄、H2Bが赤、H3が青、H4が緑で示されていて各々2個あり、その周りをDNAが巻き付いている詳細な構造が分かっていたが、紐様に伸びているヒストンH3とH4の末端(テイル)の構造は今まで全く分かっていなかった。
今世紀になって、生化学や分子生物学的な手法により、ヒストン末端のアセチル化、メチル化、リン酸化などの翻訳後修飾がクロマチンの構造を変化させ、遺伝子の発現を制御している事が分かり、エピゲノムの研究が進展しました。クロマチン中でヒストンの翻訳後修飾はヌクレオソーム間の複合体構造を変化させ、エピゲノムの情報をコードしていると考えられています。しかし、X線や電子顕微鏡法で得られた活性型と不活性型のヌクレオソームの中核構造は変化しておらず、ヒストン末端の翻訳後修飾によりヌクレオソームの構造がどのように変化しているのか、これまで全く不明でした。
そこで、高磁場NMR分光器*2を用いて、ヒストン末端の動的な構造を解析し、翻訳後修飾の変化がどのようにヒストン末端の動的な構造を変化させ、ヌクレオソームの構造と活性を変化させるのかを明らかにしました。
そこで、高磁場NMR分光器*2を用いて、ヒストン末端の動的な構造を解析し、翻訳後修飾の変化がどのようにヒストン末端の動的な構造を変化させ、ヌクレオソームの構造と活性を変化させるのかを明らかにしました。
研究の内容
本研究では、ヌクレオソーム中のヒストンH3及びH4末端を本学の高磁場NMR分光器を用いて解析し、ヒストンH4末端に4個のアセチル化が入ると、同一ヌクレオソーム中のヒストンH3末端の挙動も変化することを見出しました。我々は、H4末端の5番、8番、12番、16番のリシンがアセチル化したヌクレオソーとアセチル化していないヌクレオソームを調製し、2種類のヌクレオソーム中のヒストンH3とH4の末端の動的構造をNMRスペクトルで比較しました(図2、図3)
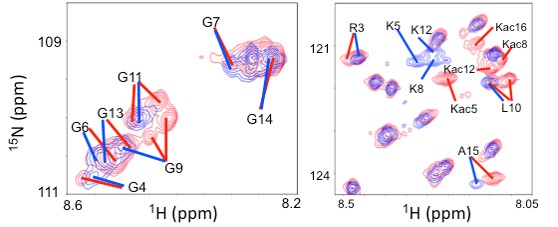
図2 ヌクレオソーム中のヒストンH4のN末末端のNMRスペクトル
青:通常のヌクレオソーム中のH4末端のシグナル
赤:H4末端をアセチル化した時のH4末端のシグナル
Gはアミノ酸のグリシンを、Rはアルギニンを、Aはアラニンを、Lはロイシンを、Kはリシンを、Kacはアセチル化リシン由来のシグナルを示し、N末から何番目かを数字で示している。
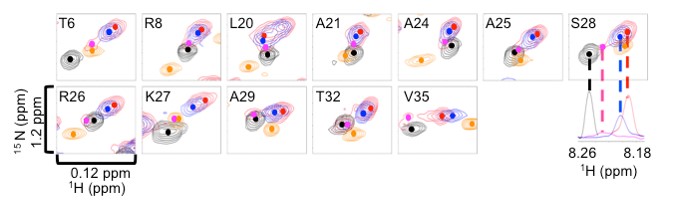
図3 ヌクレオソーム中のヒストンH3のN末末端のNMRスペクトル
青:通常のヌクレオソームのH3末端のシグナル
赤:H4末端をアセチル化した時のH3末端のメインなシグナル
ピンク:H4末端をアセチル化した時のH3末端のマイナーなシグナル
黒:イオン強度を高くしてH3末端がDNAと結合できなくなった時のシグナル
オレンジ:ヒストンH3末端に相当する遊離のペプチド断片のDNA結合型のシグナルでヌクレオソーム中のH3末端とはシグナルの位置が異なる。遊離したペプチド断片のシグナルは大きく離れていて、ここでは見えていない。
ヒストンH3・H4末端は、正電荷の塩基性アミノ酸を多く含むため、ヌクレオソーム中で負電荷のDNAに結合したり離れたりを繰り返していると考えられます。NMRでシグナルが観測されたアミノ酸は、ふらふらしていることを示し、シグナルが観測されないアミノ酸は、ヌクレオソームの中核構造に強く結合していることを示します。H4のリシンのアセチル化によって、観測されていなかったH4の16番目のアセチル化されたリシン(Kac16)が新たに観測されたことやH4末端の5番目、8番目、12番目のアセチル化リシン(それぞれKac5、Kac8、Kac12)のシグナル強度が増加したこと、アセチル化リシンの近くのアミノ酸である6番目のグリシン、9番目のグリシン、10番目のロイシン、11番目のグリシン、13番目のグリシン、15番目のアラニン(それぞれG6、G9、L10、G11、G13、A15)のシグナルが変化したり2個に分離したりしたことなどから、H4の末端はリシンのアセチル化によって、DNAと結合しにくくなりDNAから離れている状態が増えたことが明らかになりました(図4)。
また、図3に示すようにH4のリシンのアセチル化によって、ヒストンH3末端のいくつかの残基のシグナルもメインのシグナル(赤)とマイナーなシグナル(ピンク)に分離しました。これらのシグナルがどのような状態を示しているのかを明らかにするために、塩強度を高くしてH3末端がDNAから離れたときのNMRを測定し、シグナルの位置を比較した結果、マイナーなシグナルは塩強度の高い時のシグナルの位置(黒)の近くでした。このことは、メインの赤のシグナルはDNAと結合した構造でマイナーのピンクのシグナルはDNAと離れた構造であることを示しています。すなわち、H4のリシンがアセチル化されていない時はH3末端のシグナル(青)は赤とピンクの中間にありDNAと結合した構造と結合していない構造を動的に揺らいでいるが、H4末端のリシンのアセチル化によって、H3末端のDNA結合型の構造がメインになったことを示しています。我々は、ヒストンH4末端のアセチル化によって、H4末端がDNAから離れやすくなり、その空いたDNAにH3の末端が結合できるようになったことで、H3末端のDNAへの結合能が変化したと考えています(図4)。
更に、ヒストンH4の末端にアセチル化が入ると、Gcn5という酵素によるH3の14番目のリシン残基のアセチル化の速度が早くなることも見出しました(図4)。よって、H4末端のアセチル化は、H3末端とDNAとの結合能を変化させるだけでなく、H3末端自身の翻訳後修飾も調節することが明らかになりました。
ヒストンH4のアセチル化は遺伝子を活性化させる修飾であり、転写活性化領域においてH3の14番目のアセチル化と強く相関があり、H4のアセチル化がH3のアセチル化を活性化させるという本研究結果とよく一致しています。
本研究において、1個のヌクレオソーム内においてヒストンの末端間の翻訳後修飾を調節する新しい機構を明らかにし、エピゲノムネットワークとして知られるヒストン末端の翻訳後修飾の構造的な意味を解明しました。
また、図3に示すようにH4のリシンのアセチル化によって、ヒストンH3末端のいくつかの残基のシグナルもメインのシグナル(赤)とマイナーなシグナル(ピンク)に分離しました。これらのシグナルがどのような状態を示しているのかを明らかにするために、塩強度を高くしてH3末端がDNAから離れたときのNMRを測定し、シグナルの位置を比較した結果、マイナーなシグナルは塩強度の高い時のシグナルの位置(黒)の近くでした。このことは、メインの赤のシグナルはDNAと結合した構造でマイナーのピンクのシグナルはDNAと離れた構造であることを示しています。すなわち、H4のリシンがアセチル化されていない時はH3末端のシグナル(青)は赤とピンクの中間にありDNAと結合した構造と結合していない構造を動的に揺らいでいるが、H4末端のリシンのアセチル化によって、H3末端のDNA結合型の構造がメインになったことを示しています。我々は、ヒストンH4末端のアセチル化によって、H4末端がDNAから離れやすくなり、その空いたDNAにH3の末端が結合できるようになったことで、H3末端のDNAへの結合能が変化したと考えています(図4)。
更に、ヒストンH4の末端にアセチル化が入ると、Gcn5という酵素によるH3の14番目のリシン残基のアセチル化の速度が早くなることも見出しました(図4)。よって、H4末端のアセチル化は、H3末端とDNAとの結合能を変化させるだけでなく、H3末端自身の翻訳後修飾も調節することが明らかになりました。
ヒストンH4のアセチル化は遺伝子を活性化させる修飾であり、転写活性化領域においてH3の14番目のアセチル化と強く相関があり、H4のアセチル化がH3のアセチル化を活性化させるという本研究結果とよく一致しています。
本研究において、1個のヌクレオソーム内においてヒストンの末端間の翻訳後修飾を調節する新しい機構を明らかにし、エピゲノムネットワークとして知られるヒストン末端の翻訳後修飾の構造的な意味を解明しました。
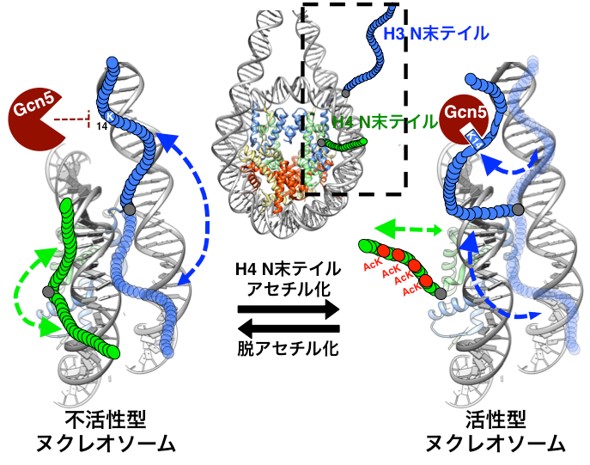
図4 ヒストンH4のN末端のアセチル化によるヒストンH3のN末端の動的な構造変化のモデル
今後の展開
今回の研究では、H3末端とH4 末端のDNAを介した相互作用を明らかにしましたが、H3末端とH2AのC末端も近い位置にあります。よって、この両者もDNAを介した相互作用が存在する可能性が考えられます。更には、アセチル化以外にも、メチル化、リン酸化、ユビキチン化など様々な翻訳後修飾が組み合わさって、遺伝子発現の活性化や抑制を行っています。これら翻訳後修飾の順序や残基レベレでの弱い相互作用の解析は、NMR分光器の得意とするところです。本研究の解析に用いた手法を援用することにより、ヌクレオソーム中でのヒストン末端間の翻訳後修飾のネットワークの解明が期待できます。
用語説明
*1 ゲノム: 遺伝情報の総体。遺伝子(gene)と染色体(chromosome)を組み合わせた用語。
*2 NMR分光器: 強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質などに対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。紐様にふらふらと揺らいでいるタンパク質部位の原子レベルでの同定が可能である。ヒトのような真核生物のタンパク質では、ある固まった構造を取らないでふらふらと動的に動いている領域が機能上重要であることが今世紀になって注目され、そのようなタンパク質を天然変性タンパク質と呼びNMRによる構造解析が行われるようになってきた。
*2 NMR分光器: 強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質などに対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。紐様にふらふらと揺らいでいるタンパク質部位の原子レベルでの同定が可能である。ヒトのような真核生物のタンパク質では、ある固まった構造を取らないでふらふらと動的に動いている領域が機能上重要であることが今世紀になって注目され、そのようなタンパク質を天然変性タンパク質と呼びNMRによる構造解析が行われるようになってきた。
掲載論文
Acetylated histone H4 tail enhances histone H3 tail acetylation by altering their mutual dynamics in the nucleosome
Ayako Furukawa, Masatoshi Wakamori, Yasuhiro Arimura, Hideaki Ohtomo, Yasuo Tsunaka,
Hitoshi Kurumizaka, Takashi Umehara, and Yoshifumi Nishimura
PNAS August 3, 2020 https://doi.org/10.1073/pnas.2010506117
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」、文部科学省「先端研究基盤共用促進事業(共用プラットフォーム形成支援プログラム) NMR共用プラットフォーム」の研究の一環で行われました。
Ayako Furukawa, Masatoshi Wakamori, Yasuhiro Arimura, Hideaki Ohtomo, Yasuo Tsunaka,
Hitoshi Kurumizaka, Takashi Umehara, and Yoshifumi Nishimura
PNAS August 3, 2020 https://doi.org/10.1073/pnas.2010506117
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」、文部科学省「先端研究基盤共用促進事業(共用プラットフォーム形成支援プログラム) NMR共用プラットフォーム」の研究の一環で行われました。
問い合わせ先
(本資料の内容に関するお問い合わせ)
大学院生命医科学研究科
特任助教 古川 亜矢子 E-mail: furukawa-a@yokohama-cu.ac.jp
特任教授 西村 善文 E-mail: nisimura@yokohama-cu.ac.jp
TEL:045-508-7211/7212
(取材対応窓口、資料請求など)
研究・産学連携推進課長 山﨑 理絵
E-Mail:kenkyupr@yokohama-cu.ac.jp
TEL:045-787-2510