2015.06.05
- プレスリリース
- 研究
生命医科学研究科 奥田昌彦特任助教らの研究グループが新しいがん治療薬開発に役立つタンパク質観察法を確立~皮ふがんの発症プロセス解明にもつながる~
平成27年6月4日
研究推進課
研究推進課
横浜市立大学大学院生命医科学研究科 奥田昌彦特任助教と西村善文学長補佐は、新たながん治療薬開発につながる、タンパク質のリン酸化反応観察法を確立しました。
上記の観察法は、特殊な分光器(NMR)を用いて化学反応観察をリアルタイムに行うもので、誤ったタンパク複製によるがん細胞発生プロセスを観ることができ、その情報を速やかに製薬の現場にフィードバックすることで、新薬開発に役立てることができます。
また本研究の過程では紫外線によるタンパク質損傷と、損傷タンパク質修復の様子を観察する事にも成功しており、皮ふがんの発症プロセス解明にもつながります。
本研究成果は、『Oncogenesis』誌(平成27年 6月1日付) にオンライン掲載されました。
※ 本研究は、文部科学省「創薬等支援技術基盤プラットフォーム事業」及び「先端研究基盤共用・プラットフォーム形成事業」の研究の一環で行われました。
研究成果のポイント
○ 新しいがん治療薬に貢献できる。
がん特有のリン酸化反応のリアルタイムな観察結果をもとに、新薬の開発と安全性確認のスピード向上が期待できる。
○ 新しい抗がん剤開発に応用できる。
○ 様々な有機物の反応を、リアルタイムで観察できる。
がん特有のリン酸化反応のリアルタイムな観察結果をもとに、新薬の開発と安全性確認のスピード向上が期待できる。
○ 新しい抗がん剤開発に応用できる。
○ 様々な有機物の反応を、リアルタイムで観察できる。
研究の内容と成果
ゲノムのガーディアン(守護者)と称されるp53は、DNA修復、細胞周期、アポトーシス(*1)、老化、代謝等の様々な生物学的過程に関与する転写因子(*2)です。悪性腫瘍の半分以上にp53遺伝子の異常が認められる大変重要なタンパク質です。 p53が多彩な機能を説明する要因の一つに様々な標的タンパク質と特異的、かつ柔軟に結合する能力が挙げられます。p53のアミノ末端にある転写活性化ドメインは多くのリン酸化をうけ、各々のリン酸化が標的タンパク質との相互作用を巧妙にコントロールします。特定のアミノ酸がリン酸化されると、基本転写因子との結合の力が4~25倍に強くなります。今回の実験では、p53のリン酸化をする酵素として報告されていた8種類の酵素を用いて、リン酸化される様子を観察したところ、ある特別のアミノ酸を特異的にリン酸化する酵素を同定する事ができました。しかも、リン酸化の様子をリアルタイムに追跡でき、同時にリン酸化によって陽的タンパク質に結合する様子もリアルタイムに追跡できました。
翻訳後修飾を通じて標的タンパク質との結合力をコントロールしているのはp53だけでなく、他の多くの重要なタンパク質でもみられることから、普遍的な相互作用制御メカニズムといえます。しかしながら、翻訳後修飾の進行とともに刻々と変化するタンパク質間の相互作用をリアルタイム、かつ原子レベルでモニタリングする方法は意外なことにあまりありません。今回私たちは、本学の高磁場NMR分光器(*5)を用いて、p53の転写活性化ドメインと基本転写因子p62のPHドメインとの複合体を例に、p53の46番のセリンと55番のトレオニンが特異的にリン酸化反応される過程とそれによりp62 PHドメインとの親和性が増加してゆく過程の両方をリアルタイムで同時にモニタリングすることに成功しました(図1A)。昨年、私たちは、この複合体の構造を解析し、p53のリン酸化した転写活性化ドメインの複合体として世界最初の構造を決定することに成功し、米国の化学会誌 『Journal of the American Chemical Society』に報告しました(参考文献1)。前回の研究では、タンパク質複合体の静的な構造を調べたのに対して、今回の研究では、動的な相互作用を捉えることができました。
また、DNA修復タンパク質XPCのリン酸化についても調べてみました。紫外線によってDNAが損傷されると、そこを含む周辺のヌクレオチドが除去修復されます。XPCは最初に損傷を見つけて修復を開始します。XPC遺伝子に異常が生じると色素性乾皮症(*6)となり、皮ふがんを非常に起こしやすくなります。XPC はDNA修復に必要なTFIIH複合体をp62 PHドメインとの結合を介して損傷箇所に呼び込みます。本研究では、XPCの129番のセリンがリン酸化酵素カゼインキナーゼ2(CK2)によって特異的にリン酸化され、p62 PHドメインとの強い結合をさらに強化することを明らかにし、その過程をNMRでリアルタイムモニタリングしました(図1B)。
翻訳後修飾を通じて標的タンパク質との結合力をコントロールしているのはp53だけでなく、他の多くの重要なタンパク質でもみられることから、普遍的な相互作用制御メカニズムといえます。しかしながら、翻訳後修飾の進行とともに刻々と変化するタンパク質間の相互作用をリアルタイム、かつ原子レベルでモニタリングする方法は意外なことにあまりありません。今回私たちは、本学の高磁場NMR分光器(*5)を用いて、p53の転写活性化ドメインと基本転写因子p62のPHドメインとの複合体を例に、p53の46番のセリンと55番のトレオニンが特異的にリン酸化反応される過程とそれによりp62 PHドメインとの親和性が増加してゆく過程の両方をリアルタイムで同時にモニタリングすることに成功しました(図1A)。昨年、私たちは、この複合体の構造を解析し、p53のリン酸化した転写活性化ドメインの複合体として世界最初の構造を決定することに成功し、米国の化学会誌 『Journal of the American Chemical Society』に報告しました(参考文献1)。前回の研究では、タンパク質複合体の静的な構造を調べたのに対して、今回の研究では、動的な相互作用を捉えることができました。
また、DNA修復タンパク質XPCのリン酸化についても調べてみました。紫外線によってDNAが損傷されると、そこを含む周辺のヌクレオチドが除去修復されます。XPCは最初に損傷を見つけて修復を開始します。XPC遺伝子に異常が生じると色素性乾皮症(*6)となり、皮ふがんを非常に起こしやすくなります。XPC はDNA修復に必要なTFIIH複合体をp62 PHドメインとの結合を介して損傷箇所に呼び込みます。本研究では、XPCの129番のセリンがリン酸化酵素カゼインキナーゼ2(CK2)によって特異的にリン酸化され、p62 PHドメインとの強い結合をさらに強化することを明らかにし、その過程をNMRでリアルタイムモニタリングしました(図1B)。
図1 部位特異的リン酸化と増加するパートナーとの相互作用の同時リアルタイムNMRモニタリング
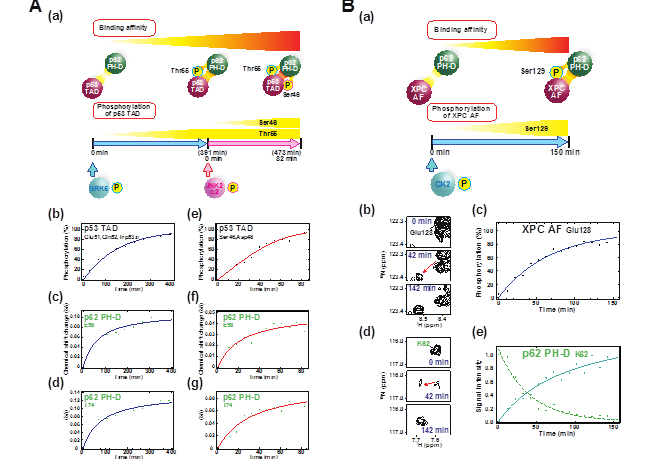
(A)
p53の転写活性化ドメイン(TAD)の部位特異的リン酸化と増加するp62 PHドメイン(PH-D)との相互作用の同時リアルタイムNMRモニタリング
(B)
XPCの酸性フラグメント(AF)の部位特異的リン酸化と増加するp62 PHドメイン(PH-D)との相互作用の同時リアルタイムNMRモニタリング
p53の転写活性化ドメイン(TAD)の部位特異的リン酸化と増加するp62 PHドメイン(PH-D)との相互作用の同時リアルタイムNMRモニタリング
(B)
XPCの酸性フラグメント(AF)の部位特異的リン酸化と増加するp62 PHドメイン(PH-D)との相互作用の同時リアルタイムNMRモニタリング
今後の展開
今回の研究ではリン酸化に焦点を絞って実験をデザインしましたが、この方法は、他の様々な翻訳後修飾にも応用可能であり、またタンパク質のみならず、核酸、他の生体分子、薬剤等との相互作用にも適用できます。本研究の成果は、新たな抗がん剤の設計、評価等に有益な情報を提供することが期待されます。
参考文献
(1)M. Okuda, Y. Nishimura, J. Am. Chem. Soc., 2014, 136, 14143−14152
プログラムされた細胞死。自ら積極的に引き起こす細胞死。
(*2)転写因子
遺伝子の転写(DNAを鋳型にしてRNAが合成される反応)をコントロールするタンパク質。
(*3)翻訳後修飾
生合成(翻訳)された後に受ける化学的な修飾。
(*4)基本転写因子
RNAポリメラーゼIIがタンパク質合成の鋳型であるメッセンジャーRNAの合成反応を開始する際に、それを補助する転写因子。
(*5)NMR分光器
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質等に対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。
(*6)色素性乾皮症
常染色体劣性遺伝性の光線過敏性皮膚疾患。
“Real-time and simultaneous monitoring of the phosphorylation and enhanced interaction of p53 and XPC acidic domains with the TFIIH p62 subunit”
用語説明
(*1)アポトーシスプログラムされた細胞死。自ら積極的に引き起こす細胞死。
(*2)転写因子
遺伝子の転写(DNAを鋳型にしてRNAが合成される反応)をコントロールするタンパク質。
(*3)翻訳後修飾
生合成(翻訳)された後に受ける化学的な修飾。
(*4)基本転写因子
RNAポリメラーゼIIがタンパク質合成の鋳型であるメッセンジャーRNAの合成反応を開始する際に、それを補助する転写因子。
(*5)NMR分光器
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質等に対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。
(*6)色素性乾皮症
常染色体劣性遺伝性の光線過敏性皮膚疾患。
論文著者、タイトル
Masahiko Okuda, Yoshifumi Nishimura“Real-time and simultaneous monitoring of the phosphorylation and enhanced interaction of p53 and XPC acidic domains with the TFIIH p62 subunit”
お問い合わせ先
(本資料の内容に関するお問合せ)
公立大学法人横浜市立大学大学院生命医科学研究科 特任助教 奥田 昌彦
公立大学法人横浜市立大学大学院生命医科学研究科 学長補佐 西村 善文
横浜市鶴見区末広町1‐7‐29
Tel:045-508-7211/7212
E-mail:
(奥田)
(西村)
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学 研究推進課長 竹内 紀充
Tel:045-787-2019
公立大学法人横浜市立大学大学院生命医科学研究科 特任助教 奥田 昌彦
公立大学法人横浜市立大学大学院生命医科学研究科 学長補佐 西村 善文
横浜市鶴見区末広町1‐7‐29
Tel:045-508-7211/7212
E-mail:
(奥田)
(西村)
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学 研究推進課長 竹内 紀充
Tel:045-787-2019