2013.07.04
- プレスリリース
- 研究
肝臓疾患の再生医療や、医薬品の開発研究を飛躍的に加速~英科学誌『Nature』に掲載~
横浜市立大学 大学院医学研究科 臓器再生医学 谷口 英樹教授、武部 貴則助手らの研究グループは、世界で初めてヒトiPS細胞から血管構造を持つ機能的なヒト臓器を創り出すことに成功しました。研究グループは、最終的に臓器を形成させるための第一段階として、まず臓器の原基(臓器の種)が胎内で形成される過程を模倣する新規の細胞培養操作技術を開発しました。この特殊な培養方法により、試験管内においてヒトiPS細胞から立体的な肝臓の原基(肝臓の種、肝芽)が自律的に誘導できること、さらにこのヒト肝臓の原基を生体内へ移植するとヒト血管網を持つ機能的な肝臓へと成長し、最終的に治療効果が発揮されることを明らかにしました。
本技術は、臓器移植の代替治療として多くの患者を救済する画期的な再生医療技術となるのみならず、創出された臓器を対象とした新たな医薬品開発の研究を飛躍的に加速することが期待されます。
※本研究は、独立行政法人科学技術振興機構 研究成果展開事業 戦略的イノベーション創出推進プログラム(S‐イノベ)における研究課題 「iPS細胞由来ヒト肝幹細胞ライブラリーの構築によるファーマコセロミクス基盤技術開発」(プロジェクトマネージャー:谷口 英樹)、文部科学省・科研費 新学術領域研究「バイオアセンブラ」(代表:武部 貴則)、科研費 若手研究(A)(代表:武部 貴則)、横浜市立大学先端医科学研究センター「研究開発プロジェクト」などの助成により行われました。
本技術は、臓器移植の代替治療として多くの患者を救済する画期的な再生医療技術となるのみならず、創出された臓器を対象とした新たな医薬品開発の研究を飛躍的に加速することが期待されます。
※本研究は、独立行政法人科学技術振興機構 研究成果展開事業 戦略的イノベーション創出推進プログラム(S‐イノベ)における研究課題 「iPS細胞由来ヒト肝幹細胞ライブラリーの構築によるファーマコセロミクス基盤技術開発」(プロジェクトマネージャー:谷口 英樹)、文部科学省・科研費 新学術領域研究「バイオアセンブラ」(代表:武部 貴則)、科研費 若手研究(A)(代表:武部 貴則)、横浜市立大学先端医科学研究センター「研究開発プロジェクト」などの助成により行われました。
研究の背景
現在、臓器の機能が損なわれてしまう末期臓器不全症という病気に対しては、機能を損なった臓器を健常な臓器へ置換する臓器移植が極めて有効な治療法として実施されています。しかしながら、年々増大する臓器移植のニーズに対し、ドナー臓器の供給は絶対的に不足しており、臓器移植に代わる治療法の開発は、多くの患者救済のために必須であると考えられています。また、臓器移植を受けるまでの待機期間に受ける治療に莫大なコストを要することから、医療経済学的観点からもその開発ニーズが非常に高まっているといえます。
そこで、すべての体細胞への分化が可能な「多能性」を有している多能性幹(ES、iPS)細胞を用いて、幹細胞から分化誘導した臓器の細胞を活用して傷害を受けた臓器の機能を回復させるための再生医療研究が進められています。しかし、多能性幹細胞の発見から四半世紀以上が経過した現在もなお、立体的な構造を持つ「臓器」の創出に成功したという報告はありません。
臓器を構成する細胞は、その機能を担う「細胞」(例えば、肝臓であれば「肝細胞」)だけではなく、血管の細胞や、それらを支持する間葉系の細胞など複数種類の細胞が共存し、秩序だった空間的配置をとって存在しています。複雑な臓器形成の過程を経て、様々な種類の細胞が協調的に相互作用を持つことで機能細胞の分化誘導が達成されます。したがって、充分な機能を発揮する「細胞」を得るためには、機能細胞のみの分化誘導ではなく、そもそも立体的な組織の再構築を伴う「臓器」を誘導することが必要と考えられます。
今回われわれは、「細胞の分化誘導」という従来の開発概念から脱却し、異なった細胞種の時空間的な相互作用を活用した、「臓器の再構成に基づく分化誘導」を実現することの可能な革新的な3次元培養技術を新たに開発しました。
そこで、すべての体細胞への分化が可能な「多能性」を有している多能性幹(ES、iPS)細胞を用いて、幹細胞から分化誘導した臓器の細胞を活用して傷害を受けた臓器の機能を回復させるための再生医療研究が進められています。しかし、多能性幹細胞の発見から四半世紀以上が経過した現在もなお、立体的な構造を持つ「臓器」の創出に成功したという報告はありません。
臓器を構成する細胞は、その機能を担う「細胞」(例えば、肝臓であれば「肝細胞」)だけではなく、血管の細胞や、それらを支持する間葉系の細胞など複数種類の細胞が共存し、秩序だった空間的配置をとって存在しています。複雑な臓器形成の過程を経て、様々な種類の細胞が協調的に相互作用を持つことで機能細胞の分化誘導が達成されます。したがって、充分な機能を発揮する「細胞」を得るためには、機能細胞のみの分化誘導ではなく、そもそも立体的な組織の再構築を伴う「臓器」を誘導することが必要と考えられます。
今回われわれは、「細胞の分化誘導」という従来の開発概念から脱却し、異なった細胞種の時空間的な相互作用を活用した、「臓器の再構成に基づく分化誘導」を実現することの可能な革新的な3次元培養技術を新たに開発しました。
研究の内容
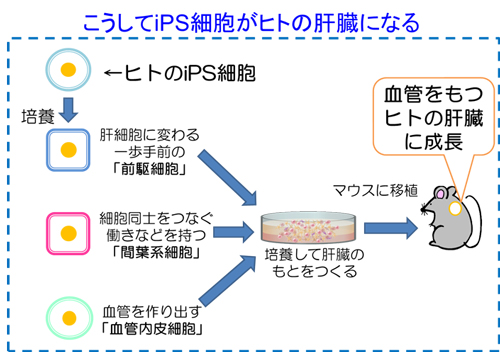
「臓器」を創出するための第一の目標として、われわれは臓器の原基(臓器の種、Organ bud)を誘導するという開発目標を設定しました。なぜならば、複雑な細胞間の相互作用を必要とする臓器形成のプロセスも、その初期段階であれば単純化できると考えたからです。実際、発生初期段階の肝臓原基は、単純なシート構造の内胚葉細胞(Hepatic endoderm)の集団より形成されることが知られています。これらが任意のタイミングで隣接する血管や間葉系の細胞と混ざり合いながら、3次元的な組織構造を持つ原基(臓器の種)が形成されます(図1)。このような立体組織形成プロセスは興味深いことに、血液の流入に先立って生じる現象です。この発生初期段階で3次元組織が形成される過程を模倣し、血管や間葉系細胞との相互作用を人為的に再現することにより、試験管内においても内胚葉細胞から立体的な肝臓の原基を誘導出来るものと仮説を立て、検証を行いました。
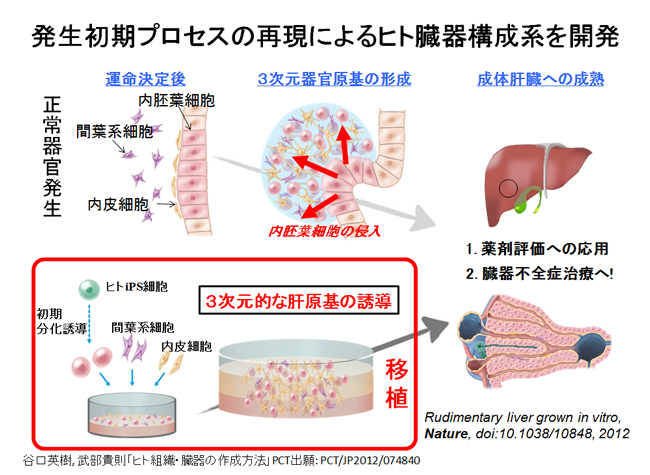 (図1)
(図1)
その結果、特別な条件下で未分化な3種類の細胞(内胚葉細胞、血管内皮細胞、間葉系細胞)を共培養することにより、培養48時間程度で立体的な肝臓の原基(肝芽、Liver Bud)が自律的に形成されることを見いだしました(図2上段)。このように、iPS細胞由来内胚葉細胞が効率的に肝臓の前駆細胞へと分化誘導されるとともに、血管の細胞はネットワーク様の構造を形成することが明らかとなりました(図2下段)。
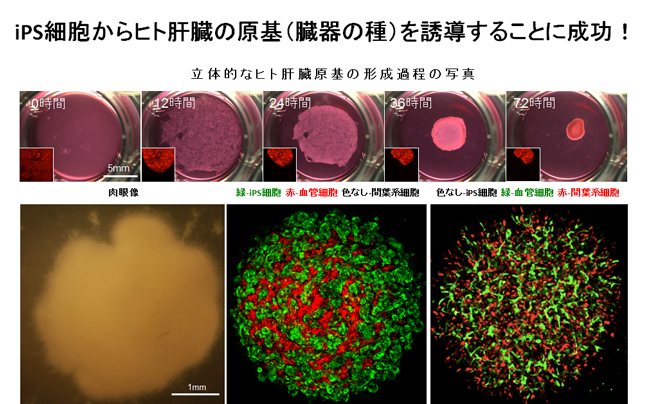 (図2)
(図2)
ヒトiPS細胞より誘導した肝芽は、免疫不全マウスへの移植により、早期(48時間)の段階に血流を持つヒト血管網を再構成し、最終的にたんぱく質の合成や薬物の代謝などヒトの肝臓に特徴的な機能を持つ組織へと成熟することが判明しました(図3左)。
さらに、ヒトiPS細胞由来肝芽が移植により肝臓の総合的な機能を代替することが可能か否かを検証する目的で、薬剤により肝不全を発症する免疫不全マウスへの移植実験を実施しました。非移植群のマウスと比較して、ヒトiPS細胞由来肝芽移植を施した群においては有意に生存率が改善したことから、生体内で分化誘導されたヒト肝細胞が肝臓の総合的な機能を発揮し、治療効果が発現していることが示唆されました(図3右)。
さらに、ヒトiPS細胞由来肝芽が移植により肝臓の総合的な機能を代替することが可能か否かを検証する目的で、薬剤により肝不全を発症する免疫不全マウスへの移植実験を実施しました。非移植群のマウスと比較して、ヒトiPS細胞由来肝芽移植を施した群においては有意に生存率が改善したことから、生体内で分化誘導されたヒト肝細胞が肝臓の総合的な機能を発揮し、治療効果が発現していることが示唆されました(図3右)。
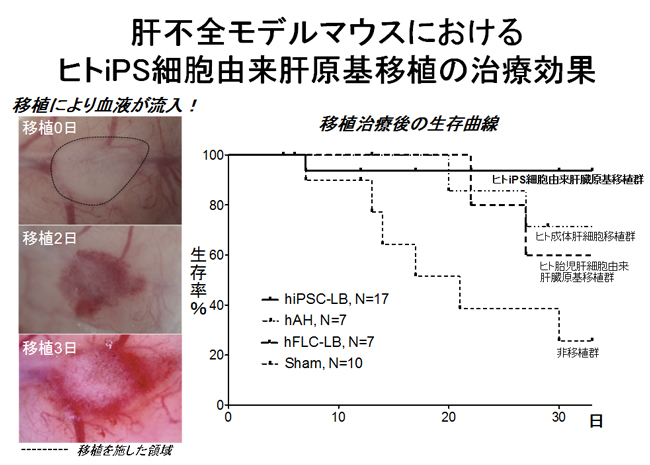 (図3)
(図3)
以上のことから、試験管内で誘導したヒトiPS細胞由来肝芽を誘導し、それらを移植することにより、血管網を持つ機能的なヒト肝臓を誘導することに世界で初めて成功しました。
今後の展開
本研究で開発した方法は、臓器不全症を対象として、臓器原基移植療法(Organ bud transplantation therapy)という新たな治療概念を提唱できるものと考えられます。全世界における肝移植の待機中死亡患者数が少なくとも年間25,000人超という現状を考慮すると、本技術に基づく肝疾患に対する再生医療を実現できれば、極めて莫大な医療ニーズに応える革新的な医療技術となるとともに、大きな経済的効果をもたらすことが期待されます。今後、3次元臓器原基の大量製造技術や、最適な移植手法などを検討することにより、肝疾患患者を対象としたiPS細胞を用いた再生医療実現化、さらには内胚葉に由来する肝臓以外の臓器(膵臓など)への応用の可能性検討へ向けて研究開発を加速します。
また、本研究成果は、新たな医薬品を開発する創薬産業への細胞供給を行う上での革新的な技術となる可能性があります。現在、医薬品開発においては、様々な種類の細胞が利用されていますが、中でもヒト肝細胞が最も重要で市場性の高い細胞であると考えられています。このヒト肝細胞は、代謝安定性試験・酵素誘導・肝毒性試験などに利用され、医薬品開発の早期に行う代謝スクリーニングに役立っていますが、残念ながらほぼ100%を米国・欧州に頼っており、我が国の創薬産業の国際競争力を著しく阻害する要因のひとつとなっています。われわれが開発したiPS細胞由来ヒト肝臓は、標準化された大量のヒト肝細胞とヒト肝組織を使用可能にし、代謝・酵素誘導・肝毒性試験などを医薬品開発の早期の段階でハイスループットスクリーニングに供するものと期待されます。これらの機能的なヒト肝細胞/肝組織を日本で製造することができれば、我が国の医薬品開発の国際競争力向上に大きく貢献すると考えられます。将来的に、これらを海外市場に輸出する、あるいは海外からの薬剤評価の受託試験を実施することにより、大きな新規国際市場の開拓が期待されます。
また、本研究成果は、新たな医薬品を開発する創薬産業への細胞供給を行う上での革新的な技術となる可能性があります。現在、医薬品開発においては、様々な種類の細胞が利用されていますが、中でもヒト肝細胞が最も重要で市場性の高い細胞であると考えられています。このヒト肝細胞は、代謝安定性試験・酵素誘導・肝毒性試験などに利用され、医薬品開発の早期に行う代謝スクリーニングに役立っていますが、残念ながらほぼ100%を米国・欧州に頼っており、我が国の創薬産業の国際競争力を著しく阻害する要因のひとつとなっています。われわれが開発したiPS細胞由来ヒト肝臓は、標準化された大量のヒト肝細胞とヒト肝組織を使用可能にし、代謝・酵素誘導・肝毒性試験などを医薬品開発の早期の段階でハイスループットスクリーニングに供するものと期待されます。これらの機能的なヒト肝細胞/肝組織を日本で製造することができれば、我が国の医薬品開発の国際競争力向上に大きく貢献すると考えられます。将来的に、これらを海外市場に輸出する、あるいは海外からの薬剤評価の受託試験を実施することにより、大きな新規国際市場の開拓が期待されます。
お問い合わせ先
(本資料の内容に関するお問い合わせ)
○公立大学法人横浜市立大学 大学院医学研究科 臓器再生医学 谷口 英樹、武部 貴則
TEL:045-787-2621 FAX:045-787-8963
E-mail:rtanigu@med.yokohama-cu.ac.jp(谷口)
ttakebe@med.yokohama-cu.ac.jp(武部)
(取材対応窓口、詳細の資料請求など)
○公立大学法人 横浜市立大学 先端医科学研究課長 立石 建
TEL:045-787-2527
(JST事業に関すること)
○独立行政法人 科学技術振興機構 産学基礎基盤推進部 松永 光正
TEL:03-5214-8475 FAX:03-5214-8496
E-mail:s-innova@jst.go.jp
○公立大学法人横浜市立大学 大学院医学研究科 臓器再生医学 谷口 英樹、武部 貴則
TEL:045-787-2621 FAX:045-787-8963
E-mail:rtanigu@med.yokohama-cu.ac.jp(谷口)
ttakebe@med.yokohama-cu.ac.jp(武部)
(取材対応窓口、詳細の資料請求など)
○公立大学法人 横浜市立大学 先端医科学研究課長 立石 建
TEL:045-787-2527
(JST事業に関すること)
○独立行政法人 科学技術振興機構 産学基礎基盤推進部 松永 光正
TEL:03-5214-8475 FAX:03-5214-8496
E-mail:s-innova@jst.go.jp