2013.02.25
- プレスリリース
- 研究
細胞内の“ごみ掃除”(自食)に関わる遺伝子の異常が知的障害を引き起こす ~患者における突然変異の発見から~
横浜市立大学 学術院医学群 遺伝学 才津 浩智准教授、松本 直通教授ら研究グループは、SENDAと呼ばれるまれな脳の病気の原因遺伝子を同定しました。この遺伝子は、細胞内で自食作用(細胞内の不要成分を自ら分解する働き)に関わっており、細胞内の自食作用の異常が脳内の細胞の異常が知的障害を引き起こす可能性が示されました。この研究は、東京大学大学院医学系研究科・西村多喜助教、水島昇教授(分子生物学分野)、群馬大学大学院医学系研究科・村松一洋助教(小児科学)を中心とする小児神経専門医グループらとの共同研究による成果であり、横浜市立大学先端医科学研究センターが推進している研究開発プロジェクトの成果のひとつです。
| ☆研究成果のポイント |
|---|
|
○全エクソーム1) 解析で、SENDA(static encephalopathy of childhood with neurodegeneration in adulthood)という知的障害を伴うまれな脳の病気の原因遺伝子を特定 |
研究概要
SENDAは、脳内鉄沈着神経変性症の一つであり、小児期早期からの非進行性の知的障害と、成人期に急速に進行する錐体外路症状(ジストニアやパーキンソン様症状)、認知症を呈する神経変性疾患です。淡蒼球(図1A)及び黒質の鉄沈着に加え、T1強調MRI画像で中心の低信号領域を伴う黒質の高信号(図1B)という特徴的な画像所見を呈します。
この病気は、まれで、家族歴もみられないため、従来の遺伝学的手法では原因遺伝子を解明することができませんでした。
共同研究グループは、全エクソーム解析という、新しい研究手法を2家系(患者1名ずつ)に応用し、両患者に共通してWDR45 遺伝子のデノボ変異を認めました。さらに3名の患者について変異解析を行い、すべての患者でWDR45 遺伝子変異を認めました。WDR45 遺伝子は、オートファジー(自食作用)に必須の分子である酵母Atg18のヒト相同遺伝子であるWIPI4タンパク質をコードしています。共同研究グループは、患者由来のリンパ芽球を用いた解析により、WIPI4タンパク質の発現が著しく減少しており、オートファジー活性の低下とオートファゴソームの形成異常が認められることを明らかにしました(図C, D)。
本研究は、脳内鉄沈着神経変性症の原因遺伝子を明らかにしたばかりでなく、オートファジーの異常と神経変性疾患の関連に関する直接的証明がなされた画期的な研究成果です。今後、オートファジー異常という観点から病態生理の理解がすすみ、本疾患の新しい治療法や効果的な進行抑制方法の開発に大きく寄与することが期待されると共に、他の神経変性疾患や知的障害の病態理解にも寄与するものと期待されます。
(注釈)
1) 全エクソーム解析:ゲノムの蛋白質を決める部分(エクソン)を全て解析する方法。
2) デノボ(新規突然)変異:両親には認められない変異で、患者で起こった突然変異。
3) オートファジー(自食作用):細胞内成分を自ら分解処理するはたらきで、細胞の新陳代謝、栄養飢餓適応反応などに重要。オートファジーではまず細胞質の一部が隔離膜によって取り囲まれてオートファゴソームが形成される。次にオートファゴソームの外膜がリソソーム膜と融合しオートリソソームとなり、内容物が分解される。
<図1>
この病気は、まれで、家族歴もみられないため、従来の遺伝学的手法では原因遺伝子を解明することができませんでした。
共同研究グループは、全エクソーム解析という、新しい研究手法を2家系(患者1名ずつ)に応用し、両患者に共通してWDR45 遺伝子のデノボ変異を認めました。さらに3名の患者について変異解析を行い、すべての患者でWDR45 遺伝子変異を認めました。WDR45 遺伝子は、オートファジー(自食作用)に必須の分子である酵母Atg18のヒト相同遺伝子であるWIPI4タンパク質をコードしています。共同研究グループは、患者由来のリンパ芽球を用いた解析により、WIPI4タンパク質の発現が著しく減少しており、オートファジー活性の低下とオートファゴソームの形成異常が認められることを明らかにしました(図C, D)。
本研究は、脳内鉄沈着神経変性症の原因遺伝子を明らかにしたばかりでなく、オートファジーの異常と神経変性疾患の関連に関する直接的証明がなされた画期的な研究成果です。今後、オートファジー異常という観点から病態生理の理解がすすみ、本疾患の新しい治療法や効果的な進行抑制方法の開発に大きく寄与することが期待されると共に、他の神経変性疾患や知的障害の病態理解にも寄与するものと期待されます。
(注釈)
1) 全エクソーム解析:ゲノムの蛋白質を決める部分(エクソン)を全て解析する方法。
2) デノボ(新規突然)変異:両親には認められない変異で、患者で起こった突然変異。
3) オートファジー(自食作用):細胞内成分を自ら分解処理するはたらきで、細胞の新陳代謝、栄養飢餓適応反応などに重要。オートファジーではまず細胞質の一部が隔離膜によって取り囲まれてオートファゴソームが形成される。次にオートファゴソームの外膜がリソソーム膜と融合しオートリソソームとなり、内容物が分解される。
<図1>
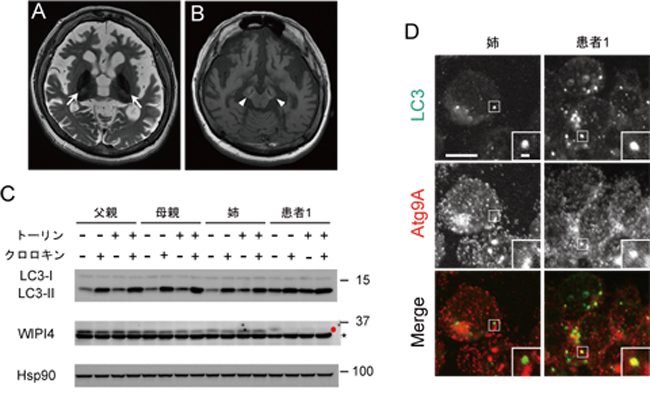
患者1のT2強調(A)およびT1強調(B)MRI像。淡蒼球に低吸収域(矢印)を認め、鉄沈着が示唆される。また、線状の低信号領域を伴う黒質の高信号(矢頭)が認められた。(C)患者1とそのご家族由来のリンパ芽球を用いたウエスターンブロット。(C、上段)オートファジーの誘導剤であるトーリンと、リソソーム阻害剤であるクロロキン処理(オートファジー依存的な分解が阻害される)による、LC-II(オートファゴソームのマーカー)の定量。患者1において、LC3-IIは非処理状態でも蓄積する傾向にあり、さらにクロロキン処理によるLC3-IIの蓄積が少ないことから、オートファジー活性が減少していることが分かる。また、患者ではWIPI4の発現が著しく減少していた(C、中段の赤丸;アスタリスクは非特異的なバンドを示す)。内部標準コントロールのHsp90の発現量には違いが認められない(C、下段)。(D)患者1とその姉由来のリンパ芽球の免疫細胞染色によるオートファゴソームの観察。コントロール細胞ではLC3とAtg9A(オートファゴソーム形成初期に一過性に発現)は共局在しないが、患者ではLC3とAtg9Aの共局在が頻繁に観察され(黄色)、多くのオートファゴソームが未完成の状態にあると考えられた。
※本研究成果は、英科学誌『Nature Genetics』オンライン版(米国2月24日午後1時:日本時間2月25日午前3時)に掲載されます。
※この研究は、文部科学省「脳科学研究戦略推進プログラム」の一環として、また、厚生労働省「難病・がん等の疾患分野の医療の実用化研究事業」、独立行政法人科学技術振興機構、日本学術振興会などの研究補助金により行われました。
※本研究成果は、英科学誌『Nature Genetics』オンライン版(米国2月24日午後1時:日本時間2月25日午前3時)に掲載されます。
※この研究は、文部科学省「脳科学研究戦略推進プログラム」の一環として、また、厚生労働省「難病・がん等の疾患分野の医療の実用化研究事業」、独立行政法人科学技術振興機構、日本学術振興会などの研究補助金により行われました。
お問い合わせ先
(本資料の内容に関するお問い合わせ)
○公立大学法人横浜市立大学 学術院医学群 遺伝学
TEL:045-787-2606 FAX:045-786-5219
准教授 才津 浩智 hsaitsu@yokohama-cu.ac.jp
教授 松本 直通 naomat@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
○公立大学法人横浜市立大学 先端医科学研究課 立石 建
TEL:045-787-2527 FAX:045-787-2509 sentan@yokohama-cu.ac.jp
○公立大学法人横浜市立大学 学術院医学群 遺伝学
TEL:045-787-2606 FAX:045-786-5219
准教授 才津 浩智 hsaitsu@yokohama-cu.ac.jp
教授 松本 直通 naomat@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
○公立大学法人横浜市立大学 先端医科学研究課 立石 建
TEL:045-787-2527 FAX:045-787-2509 sentan@yokohama-cu.ac.jp