2013.02.12
- プレスリリース
- 研究
概要
悪性のがん組織では、マトリックスメタロプロテアーゼ(MMPs)と呼ばれるタンパク質分解酵素が高発現しており、がん細胞の浸潤・転移を支えています。かつて、がんの抗転移剤開発をめざして多くのMMPs阻害剤が開発されましたが、残念ながら臨床試験の過程で確認された様々な副作用が原因となり、がん治療薬としての利用に至っていません。これは、20種以上存在するMMPsのうち、がん治療の標的となるMMPsのみに作用する選択的阻害剤の開発が困難であったことに起因します。
東准教授らはAPP-IPと命名したペプチドが標的MMPsの一つであるMMP-2に対し、選択的阻害活性を持つことを見出し、その阻害機構を解明しました(2008年および 2011年J Biol Chem 掲載)。今回、APP-IPと生理的MMPsインヒビタータンパク質であるTIMP-2を組み合わせることにより、MMP-2選択性、阻害活性および安定性を飛躍的に上昇させたインヒビタータンパク質の創出に成功しました。
本発明は国内(2008-262415)および国際特許(PCT/JP 2009/ 067320)申請中です。なお本研究は、本学戦略的研究推進費「標的蛋白質の構造解析に基づく合理的創薬」などの助成により行われました。
東准教授らはAPP-IPと命名したペプチドが標的MMPsの一つであるMMP-2に対し、選択的阻害活性を持つことを見出し、その阻害機構を解明しました(2008年および 2011年J Biol Chem 掲載)。今回、APP-IPと生理的MMPsインヒビタータンパク質であるTIMP-2を組み合わせることにより、MMP-2選択性、阻害活性および安定性を飛躍的に上昇させたインヒビタータンパク質の創出に成功しました。
本発明は国内(2008-262415)および国際特許(PCT/JP 2009/ 067320)申請中です。なお本研究は、本学戦略的研究推進費「標的蛋白質の構造解析に基づく合理的創薬」などの助成により行われました。
研究概要
東准教授らはアミロイド前駆体タンパク質(APP)分子内のISYGNDALMP配列(*3)にMMP-2選択的インヒビター活性があることを見出し、この配列をAPP-IPと命名しました (Higashi and Miyazaki J Biol Chem 2003)。一方、生理的MMPsインヒビタータンパク質であるTIMP-2は殆ど全てのMMPsを強力に阻害するインヒビター部位を分子のN-末端に持っていますが、この分子のC-末端側にはMMP-2の非触媒部位に特異的に結合する部位が存在します。東准教授らはインヒビター部位であるTIMP-2の主鎖のN-末端を化学修飾するとTIMP-2がMMP-2結合能を保持したまま、インヒビター活性を失うことを見出していました(Higashi and Miyazaki J Biol Chem 1999)。
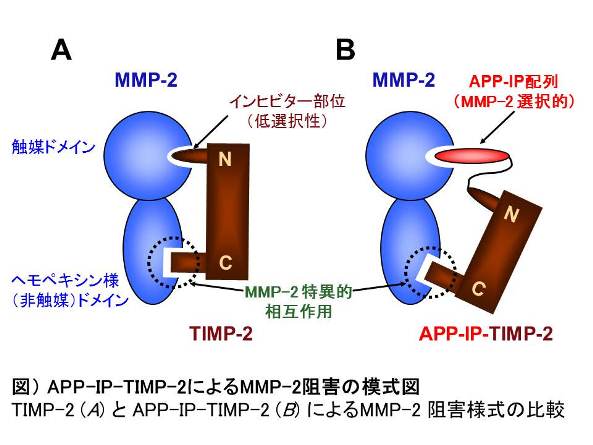
これらを踏まえ、今回、APP-IP配列をTIMP-2のN-末端に導入することで、APP-IPのMMP-2選択的阻害活性をさらに高める方法を考案しました。すなわち、MMP-2非触媒部位とTIMP-2のC-末端部位との特異的相互作用の補助により、TIMP-2のN-末端インヒビター部位がMMP-2酵素触媒部位に近づくことが予想されますが(図A)、このN-末端部分にAPP-IPを導入することにより、選択性の低いTIMP-2インヒビター部位が消失し、これに代わってAPP-IPが酵素触媒部位に呈示されるであろうと考えました(図B)。この融合タンパク質(APP-IP-TIMP-2と命名)を作製し、実際にMMP-2阻害活性を調べたところ、APP-IP (Ki = 30 nM)と比較してAPP-IP-TIMP-2 (Ki = 0.68 pM)は44,000倍高い阻害活性を持っていました。一方、他のMMPsに対する阻害活性は殆ど検出されず(Ki > 1 μM)、APP-IP-TIMP-2が極めて特異性の高いMMP-2インヒビターであることが判明しました。
これらを踏まえ、今回、APP-IP配列をTIMP-2のN-末端に導入することで、APP-IPのMMP-2選択的阻害活性をさらに高める方法を考案しました。すなわち、MMP-2非触媒部位とTIMP-2のC-末端部位との特異的相互作用の補助により、TIMP-2のN-末端インヒビター部位がMMP-2酵素触媒部位に近づくことが予想されますが(図A)、このN-末端部分にAPP-IPを導入することにより、選択性の低いTIMP-2インヒビター部位が消失し、これに代わってAPP-IPが酵素触媒部位に呈示されるであろうと考えました(図B)。この融合タンパク質(APP-IP-TIMP-2と命名)を作製し、実際にMMP-2阻害活性を調べたところ、APP-IP (Ki = 30 nM)と比較してAPP-IP-TIMP-2 (Ki = 0.68 pM)は44,000倍高い阻害活性を持っていました。一方、他のMMPsに対する阻害活性は殆ど検出されず(Ki > 1 μM)、APP-IP-TIMP-2が極めて特異性の高いMMP-2インヒビターであることが判明しました。
今後の期待
APP-IPをTIMP-2と融合させることで、MMP-2選択性と阻害活性が大きく上昇しただけでなく、培養細胞系における安定性も飛躍的に向上し、がん細胞とともに培養して少なくとも4日間はインヒビター活性が全く変化しないことが判明しました。このことは、MMP-2の生理的あるは病理的役割を簡便に調べる上でAPP-IP-TIMP-2が優れたツールとなることを示唆しています。近年、抗体等のタンパク質製剤が種々の疾患の治療薬として開発されつつありますが、APP-IP-TIMP-2は、がんをはじめとしたMMP-2が関与する疾患に対する治療薬として開発することが可能かも知れません。MMP-2が良好な標的MMPに分類されていることから、APP-IP-TIMP-2が利用できれば、副作用の極めて少ない治療薬となることが期待されます。
用語解説
(*1)標的酵素MMP-2:マトリックスメタロプロテアーゼ(MMPs)は動物細胞が分泌するタンパク質分解酵素であり、これらの酵素が細胞外に存在するコラーゲンなどの細胞外マトリックスタンパク質を分解することで細胞の組織内移動を可能にしている。正常な組織ではマトリックスタンパク質の分解と再構築、および細胞の移動は秩序立って起るが、悪性のがん組織では数種類のMMPsが高発現し、がん細胞の無秩序な組織内浸潤と転移を支えている。ヒトで見出されている24種類のMMPsは互いに良く似た構造をもつが、それらの機能は異なっており、がん転移には無関係であるが重要な生理機能を持つものや、がん転移に対し抑制的に働くものが存在することが近年の遺伝子機能解析から明らかになった。したがって、これらのMMPsを阻害すると機能障害やがん転移の助長につながることから、これらはがん治療の反標的酵素に分類された。
これに対し、がん組織内のMMP-2の活性発現はその転移能と高い相関を示す一方、この酵素の遺伝子を欠損した動物に重篤な機能障害が見られないことから、MMP-2はがん治療の良好な標的酵素に分類されている。
(*2)高特異性インヒビタータンパク質:生体内にはTissue inhibitor of metalloproteinases (TIMP)とよばれるMMPsのインヒビタータンパク質が存在し、これら酵素の活性制御を行っている。4種類存在するTIMPs(TIMP-1からTIMP-4)はいずれも個々のMMPに対する選択性が低く、殆ど全てのMMPsの活性を強く阻害する。今回、TIMPsの一つであるTIMP-2を修飾することにより、低選択性MMPsインヒビターからMMP-2特異的インヒビターへの変換に成功した。
(*3)アミロイド前駆体タンパク質(APP)分子内のISYGNDALMP配列:アルツハイマー病の原因物質であるアミロイドβタンパク質(Aβ)は約40アミノ酸残基からなるペプチドであるが、このペプチドはアミロイド前駆体タンパク質(APP)として生合成された細胞膜タンパク質がプロテアーゼ切断されて生じる断片の一つである。東准教授らは770アミノ酸残基から成るAPPの586から595番目のアミノ酸配列に相当するISYGNDALMP配列に、MMP-2に対して高い選択性をもつインヒビター活性があることを見出し、この10アミノ酸残基ペプチドをAPP-derived inhibitory peptide (APP-IP)と命名した。なお、APP-IPとAβはAPP分子内で異なる領域に存在し、それらのアミノ酸配列も全く異なっている。
これに対し、がん組織内のMMP-2の活性発現はその転移能と高い相関を示す一方、この酵素の遺伝子を欠損した動物に重篤な機能障害が見られないことから、MMP-2はがん治療の良好な標的酵素に分類されている。
(*2)高特異性インヒビタータンパク質:生体内にはTissue inhibitor of metalloproteinases (TIMP)とよばれるMMPsのインヒビタータンパク質が存在し、これら酵素の活性制御を行っている。4種類存在するTIMPs(TIMP-1からTIMP-4)はいずれも個々のMMPに対する選択性が低く、殆ど全てのMMPsの活性を強く阻害する。今回、TIMPsの一つであるTIMP-2を修飾することにより、低選択性MMPsインヒビターからMMP-2特異的インヒビターへの変換に成功した。
(*3)アミロイド前駆体タンパク質(APP)分子内のISYGNDALMP配列:アルツハイマー病の原因物質であるアミロイドβタンパク質(Aβ)は約40アミノ酸残基からなるペプチドであるが、このペプチドはアミロイド前駆体タンパク質(APP)として生合成された細胞膜タンパク質がプロテアーゼ切断されて生じる断片の一つである。東准教授らは770アミノ酸残基から成るAPPの586から595番目のアミノ酸配列に相当するISYGNDALMP配列に、MMP-2に対して高い選択性をもつインヒビター活性があることを見出し、この10アミノ酸残基ペプチドをAPP-derived inhibitory peptide (APP-IP)と命名した。なお、APP-IPとAβはAPP分子内で異なる領域に存在し、それらのアミノ酸配列も全く異なっている。
論文タイトル及び著者名
タイトル: Molecular design of a highly selective and strong protein inhibitor against matrix metalloproteinase-2 (MMP-2). (マトリックスメタロプロテアーゼ-2 (MMP-2) に対し、高い選択性と強い阻害活性をあわせ持つインヒビタータンパク質の分子設計)
著者名:Shouichi Higashi (東 昌市)*, Tomokazu Hirose (廣瀬 智一), Tomoka Takeuchi (竹内 友香), Kaoru Miyazaki (宮崎 香)
*責任著者
著者名:Shouichi Higashi (東 昌市)*, Tomokazu Hirose (廣瀬 智一), Tomoka Takeuchi (竹内 友香), Kaoru Miyazaki (宮崎 香)
*責任著者