2012.07.06
- プレスリリース
- 研究
本学大学院生命ナノシステム科学研究科の糖鎖生物学研究グループと東北薬科大学分子生体膜研究所の分子認識部門はSUEL型レクチンドメインがヒト・バーキットリンパ腫細胞の糖鎖に結合すると多剤耐性トランスポーターの遺伝子発現を抑制し、低濃度の抗がん剤で細胞死を誘発する低侵襲治療研究の可能性を見出しました。
概要
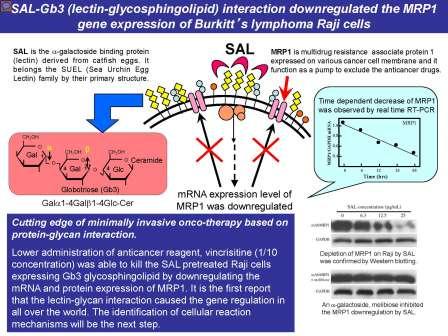
横浜市立大学客員研究員で現長崎国際大学薬学部専任助教藤井佑樹博士と大学院生命ナノシステム科学研究教授で元文科省学術調査官大関泰裕(糖鎖生物学)は、東北薬科大学分子生体膜研究所助教菅原栄紀博士、同仁田一雄所長、同大高柳元明学長(医学博士・内科学)、パシフィックノースウェスト糖尿病研究所部長で米国アカデミー会員箱守仙一郎博士(糖鎖腫瘍学)、および本学教授安光英太郎(分子生物学)、同准教授ロバート・カナリー(環境毒性学)らと、文部科学省共同利用・共同研究拠点事業「海洋生物学研究共同推進拠点(JAMBIO)」を通じ、SUELレクチンドメインを有す魚卵レクチンが、悪性リンパ腫の一種であるバーキットリンパ腫の細胞膜に存在するグロボトリオース糖鎖と結合すると、がん細胞が抗がん剤を排出させる時に働く多剤耐性トランスポーターMRP1の遺伝子発現が抑制され、通常の1/10の低濃度の抗がん剤で細胞死が起きることを見出した。
本研究成果は糖鎖結合性タンパク質と糖脂質糖鎖の相互作用による多剤耐性遺伝子抑制の最初の事例として、2012年6月25日付けで、文科省共同利用・共同研究拠点事業JAMBIOの「研究トピックス」、カナダの医学情報WebサイトGlobal Medical Discoveryより情報発信されました。
本研究成果は糖鎖結合性タンパク質と糖脂質糖鎖の相互作用による多剤耐性遺伝子抑制の最初の事例として、2012年6月25日付けで、文科省共同利用・共同研究拠点事業JAMBIOの「研究トピックス」、カナダの医学情報WebサイトGlobal Medical Discoveryより情報発信されました。
研究概要
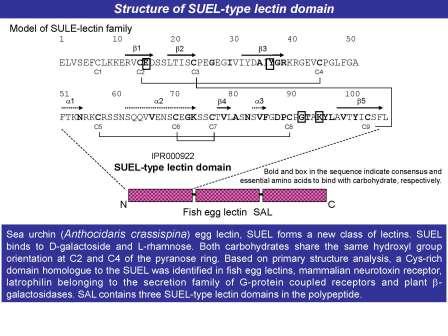
「レクチン」は生物に広く存在する糖鎖結合性タンパク質の総称で、特徴的なアミノ酸配列(一次構造)を持ち、糖鎖と結合して細胞増殖や自然免疫などの興味深い働きが報告されています。大関泰裕博士は1991年に、ウニ未受精卵からガラクトシド結合性レクチンSUELの一次構造を決定し、従来のタンパク質と全く類似性がない、新規な構造を世界に先駆け報告しました。本レクチン構造は、最近イギリスの生物学者により、オンライン百科事典ウィキペディア(英語版)にも特徴的なタンパク質の構造として紹介されています(http://en.wikipedia.org/wiki/Galactose_binding_lectin_domain)。
「SUEL型レクチンドメイン」 (IPR000922)は最初の構造決定以来20年を経て、ヒトやマウス脳の神経毒受容体、魚類卵レクチン、植物の糖分解酵素などの多くのタンパク質や遺伝子に見出され、2012年現在、ゲノムデータベースに登録されている数は1000種類以上にのぼりました(http://www.ebi.ac.uk/interpro/IEntry?ac=IPR000922)。
「糖鎖」は遺伝子やタンパク質に次ぐ第三の生命鎖とよばれ、細胞表面や血清、粘液中の糖タンパク質や糖脂質に存在し、がん化した細胞やiPS細胞で糖の配列、鎖の長さや枝分かれ数などの構造が変化することから、医学的に重要な分子です。タンパク質中に3回のSUEL型レクチンドメインの繰り返し配列を持つナマズ卵レクチンSALは、共同研究者で東北薬大准教授細野雅祐博士が発見し、O157細菌が分泌するベロ毒素の受容体としても有名なグロボトリオース(Gb3:Galα1-4Galβ1-4Glc)糖鎖への結合が証明されました。
このたび、細胞膜にGb3が発現しているヒトのバーキットリンパ腫Raji細胞にSALを加えると細胞が縮小したことから、レクチンの処理による膜タンパク質の消失が示唆されました。この結果に基づき、定量的PCR、FACS、siRNAによる解析を行うと、SALが細胞上のGb3に結合したのちに、抗がん剤を投与すると、がん細胞が薬物を排除して生き残るために働く多剤耐性トランスポーターMRP1タンパク質とそのmRNAが、レクチンの添加量と時間に依存して消失することが判明しました。さらに、SALの添加でMRP1が消失したバーキットリンパ腫細胞に、ビンクリスチンなどの抗がん剤を加えると、薬剤を単独で加えた時の致死量に比べ、1/10量もの低濃度で細胞死が起き、SUEL型レクチンとGb3糖鎖の結合による低侵襲治療研究への可能性が見出されました。
本研究は、文部科学省共同利用・共同研究拠点事業「海洋生物学研究共同推進拠点JAMBIO」公募研究配分金、JSPS科学研究費補助金「基盤研究(C)」、「特別研究員奨励費」により行われました。
「SUEL型レクチンドメイン」 (IPR000922)は最初の構造決定以来20年を経て、ヒトやマウス脳の神経毒受容体、魚類卵レクチン、植物の糖分解酵素などの多くのタンパク質や遺伝子に見出され、2012年現在、ゲノムデータベースに登録されている数は1000種類以上にのぼりました(http://www.ebi.ac.uk/interpro/IEntry?ac=IPR000922)。
「糖鎖」は遺伝子やタンパク質に次ぐ第三の生命鎖とよばれ、細胞表面や血清、粘液中の糖タンパク質や糖脂質に存在し、がん化した細胞やiPS細胞で糖の配列、鎖の長さや枝分かれ数などの構造が変化することから、医学的に重要な分子です。タンパク質中に3回のSUEL型レクチンドメインの繰り返し配列を持つナマズ卵レクチンSALは、共同研究者で東北薬大准教授細野雅祐博士が発見し、O157細菌が分泌するベロ毒素の受容体としても有名なグロボトリオース(Gb3:Galα1-4Galβ1-4Glc)糖鎖への結合が証明されました。
このたび、細胞膜にGb3が発現しているヒトのバーキットリンパ腫Raji細胞にSALを加えると細胞が縮小したことから、レクチンの処理による膜タンパク質の消失が示唆されました。この結果に基づき、定量的PCR、FACS、siRNAによる解析を行うと、SALが細胞上のGb3に結合したのちに、抗がん剤を投与すると、がん細胞が薬物を排除して生き残るために働く多剤耐性トランスポーターMRP1タンパク質とそのmRNAが、レクチンの添加量と時間に依存して消失することが判明しました。さらに、SALの添加でMRP1が消失したバーキットリンパ腫細胞に、ビンクリスチンなどの抗がん剤を加えると、薬剤を単独で加えた時の致死量に比べ、1/10量もの低濃度で細胞死が起き、SUEL型レクチンとGb3糖鎖の結合による低侵襲治療研究への可能性が見出されました。
本研究は、文部科学省共同利用・共同研究拠点事業「海洋生物学研究共同推進拠点JAMBIO」公募研究配分金、JSPS科学研究費補助金「基盤研究(C)」、「特別研究員奨励費」により行われました。
今後の期待
多剤耐性トランスポーターの制御は、がん化学療法分野で重要視され、レクチンとGb3の結合での制御を示した本研究やGb3合成酵素遺伝子のノックダウンが多剤耐性トランスポーターの転写を抑制した海外の研究者の結果など、近年、糖鎖と多剤耐性トランスポーターの関連性が明らかになってきました。SUEL型レクチンが直接薬になるものではありませんが、本レクチンを用いて糖鎖と糖鎖認識の観点から多剤耐性分子の発現調節の研究が進めば、将来、Gb3糖鎖結合抗体の作成や、糖鎖識別のできる化学分子の合成などから、創薬への可能性が期待されます。