2011.08.03
- プレスリリース
- 研究
概要
悪性のがん組織では、マトリックスメタロプロテアーゼ(MMPs)と呼ばれるタンパク質分解酵素が高発現しており、がん細胞の浸潤・転移に寄与しています。しかしながら、ヒトで見出されている20種以上のMMPsの全てが、がん転移を促進するわけではなく、特異性の低い阻害剤によって複数のMMPsが阻害されると様々な副作用が引き起こされます。
事実、現在までに開発された多くのMMPsインヒビターはいずれも特異性が低く、臨床試験の過程で確認された様々な副作用が原因となり、がん治療薬としての利用に至っていません。東 准教授らはβ-アミロイド前駆体タンパク質(APP)に、MMP-2に対し、高い選択性を持つインヒビター領域が存在することを見出し、その選択的阻害機構の解明を試みてきました。
今回、本学生体超分子システム科学専攻の橋本 博 助教および佐藤 衛 教授、ゲノムシステム科学専攻博士前期課程1年竹内 友香 氏、博士前期課程2年小松 恭子 氏(現卒業生)および宮崎 香 教授との共同研究により、このインヒビターとMMP-2触媒ドメインとの複合体の結晶構造解析に成功し、その阻害機構の詳細を明らかにしました。
この成果は伝統ある米国科学雑誌 Journal of Biological Chemistry に掲載されました。なお、本研究は、本学戦略的研究推進費「標的蛋白質の構造解析に基づく合理的創薬」などの助成により行われました。
事実、現在までに開発された多くのMMPsインヒビターはいずれも特異性が低く、臨床試験の過程で確認された様々な副作用が原因となり、がん治療薬としての利用に至っていません。東 准教授らはβ-アミロイド前駆体タンパク質(APP)に、MMP-2に対し、高い選択性を持つインヒビター領域が存在することを見出し、その選択的阻害機構の解明を試みてきました。
今回、本学生体超分子システム科学専攻の橋本 博 助教および佐藤 衛 教授、ゲノムシステム科学専攻博士前期課程1年竹内 友香 氏、博士前期課程2年小松 恭子 氏(現卒業生)および宮崎 香 教授との共同研究により、このインヒビターとMMP-2触媒ドメインとの複合体の結晶構造解析に成功し、その阻害機構の詳細を明らかにしました。
この成果は伝統ある米国科学雑誌 Journal of Biological Chemistry に掲載されました。なお、本研究は、本学戦略的研究推進費「標的蛋白質の構造解析に基づく合理的創薬」などの助成により行われました。
研究内容
MMP-2は、がんの浸潤・転移に対し促進的に作用することが示唆されており、がん治療の良好なターゲット分子です。東 准教授らは、アルツハイマー病の原因遺伝子の一つとしても知られるAPPがMMP-2に高い選択性を持つインヒビター領域を持ち、その領域が770アミノ酸残基から構成されるAPP分子内の586-594番目のアミノ酸残基に相当するISYGNDALMP配列(APP-IPと命名)に局在することを見出しました(Higashi and Miyazaki J Biol Chem 2003)。
今回、APP-IPによるMMP-2選択的阻害機構を原子レベルで解明する目的で、APP-IPとMMP-2触媒ドメインとの複合体の結晶構造解析を行い、この二分子間の結合様式を明らかにしました。その結果、APP-IPはそのNH2末端からCOOH末端への方向が基質ペプチドとは逆向きになるようにMMP-2の基質結合クレフトに結合するとともに、このインヒビターが、その7アミノ酸残基を介して、酵素側の基質結合クレフトと広い面で相互作用することが明らかになりました(図1)。この広域にわたる相互作用が高いMMP-2選択性に深く関わると考えられます。すなわち、鍵と鍵穴の形状が複雑であれば、セキュリティーが高まるのと同様に、鍵に相当するインヒビターが鍵穴に相当する酵素の基質結合クレフトと多数の相互作用を持つことで、その選択性が高まるのではないかと考えました(図2)。
今回、APP-IPによるMMP-2選択的阻害機構を原子レベルで解明する目的で、APP-IPとMMP-2触媒ドメインとの複合体の結晶構造解析を行い、この二分子間の結合様式を明らかにしました。その結果、APP-IPはそのNH2末端からCOOH末端への方向が基質ペプチドとは逆向きになるようにMMP-2の基質結合クレフトに結合するとともに、このインヒビターが、その7アミノ酸残基を介して、酵素側の基質結合クレフトと広い面で相互作用することが明らかになりました(図1)。この広域にわたる相互作用が高いMMP-2選択性に深く関わると考えられます。すなわち、鍵と鍵穴の形状が複雑であれば、セキュリティーが高まるのと同様に、鍵に相当するインヒビターが鍵穴に相当する酵素の基質結合クレフトと多数の相互作用を持つことで、その選択性が高まるのではないかと考えました(図2)。
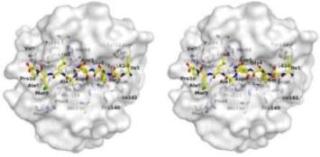
●図1.APP-IPとMMP-2触媒ドメインとの複合体の立体構造
MMP-2の分子表面構造(白色)とAPP-IP(黄色スティック)をステレオ図で表す。
また、APP-IPと相互作用するMMP-2側のアミノ酸残基を白色スティックで表す。
また、APP-IPと相互作用するMMP-2側のアミノ酸残基を白色スティックで表す。
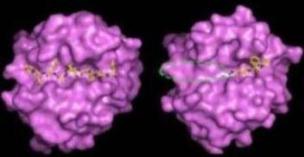
●図2.APP-IP(左)とヒドロキサム酸系阻害剤(右)とのMMP複合様式の比較
従来開発されてきたヒドロキサム酸系阻害剤とMMPとの相互作用(右)では点線で囲んだ部分が分子認識に利用されていない→選択性が低い。
今後の期待
今回明らかになったAPP-IPとMMP-2との選択的相互作用様式はMMP-2のみならず、他の疾患に関わるMMPの高特異性阻害剤を設計する上で重要なヒントになることが期待されます。
近年、MMP-2とMMP-7が、がん転移の促進以外に、血栓形成や心筋梗塞、高血圧などの心臓血管系の疾患にも関与することが示唆されています。また、MMP-1やMMP-13は関節リュウマチにおいて骨の構成成分であるコラーゲンを分解します。したがって、高特異性MMP阻害剤は、抗がん剤としてはもとより、それ以外の疾患の治療薬として開発することも可能かも知れません。
近年、MMP-2とMMP-7が、がん転移の促進以外に、血栓形成や心筋梗塞、高血圧などの心臓血管系の疾患にも関与することが示唆されています。また、MMP-1やMMP-13は関節リュウマチにおいて骨の構成成分であるコラーゲンを分解します。したがって、高特異性MMP阻害剤は、抗がん剤としてはもとより、それ以外の疾患の治療薬として開発することも可能かも知れません。