遺伝学 松本教授、三宅准教授ら研究グループが小児期早期発症神経変性脳症の責任遺伝子を明らかに
2016.09.23
- TOPICS
- 研究
遺伝学 松本教授、三宅准教授ら研究グループが小児期早期発症神経変性脳症の責任遺伝子を明らかに
本疾患における微小管コファクターTBCD遺伝子変異の同定 ~American Journal of Human Geneticsに掲載~
横浜市立大学 学術院医学群 三宅紀子准教授、松本直通教授(遺伝学教室)らは、小児期早期発症の神経変性脳症の責任遺伝子を解明しました。この研究は、東京大学・三浦正幸教授、広島大学・千原崇裕教授、新潟大学・柿田明美教授、清水宏助教、長野県立こども病院・奥野(湯口)慈雨医師、笛木昇医師、小木曽嘉文医師、独協医科大学小児科・鈴村宏准教授、今高城治准教授、渡部功之助教、Hospital Kuala Lumpur・Huey Yin Leong医師、Tel Aviv Sourasky Medical Center・Aviva Fattal-Valevski教授、Uri Kramer教授らとの共同研究による成果です。
研究成果のポイント
- 全エキソーム配列解析*1により、微小管を構成するα・βチューブリン2量体の形成に必要なシャペロン複合体の構成分子の一つであるTBCD 遺伝子の劣性変異が小児期早期発症の神経変性脳症を引き起こすことを明らかにした。
- タンパク質免疫沈降法により、TBCD変異体ではその結合パートナーであるβチューブリン、TBCE、ARL2との結合能が低下または消失していること、更にショウジョウバエの tbcd1 変異体を用いた解析で、軸索および樹状突起の形態異常がヒト変異TBCD ではレスキューされないことを示した。
- 症例の病理組織学的解析により、筋組織の未熟性、多系統神経系組織にわたる神経核の消失および細胞内ミトコンドリア異常を示唆する所見が観察され、TBCD 変異から生じる疾病病態を明らかにした。
研究概要
微小管はαチューブリンとβチューブリンの二量体が積み重なることで構成される筒状の構造物です。その重合と脱重合によりダイナミックな挙動を示し、細胞の分裂、形態、極性、移動、細胞内輸送など細胞機能に重要な役割を果たしています。そのもとになるα/βチューブリン二量体の形成には、tubulin folding co-factorと呼ばれる5つのシャペロン分子 (TBCA, TBCB, TBCC, TBCD, TBCE) が知られており、TBCD 遺伝子の異常はヒト疾患との関連が報告されていましたが、それ以外の遺伝子とヒト疾患の報告はありませんでした。
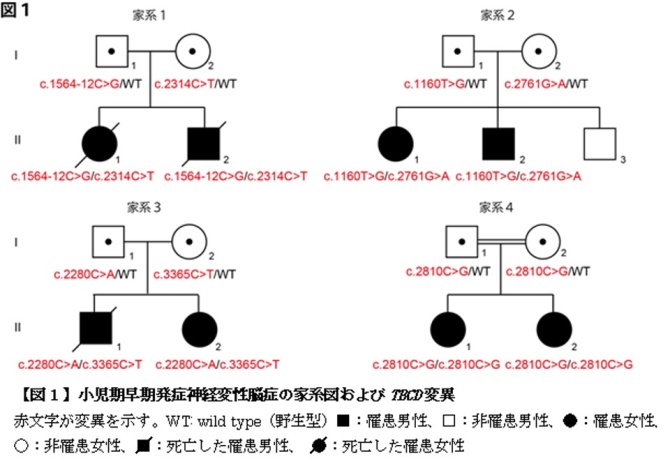
三宅准教授・松本教授らの研究グループは、小児期早期(1歳未満)に発症し、中枢神経系が進行性に変性する新しい臨床像を呈する4家系8症例を対象に全エキソーム解析を用いて遺伝子変異探索を行いました。その結果全8症例にTBCD 遺伝子の劣性変異(複合ヘテロ接合性変異またはホモ接合性変異)を同定しました(図1)。
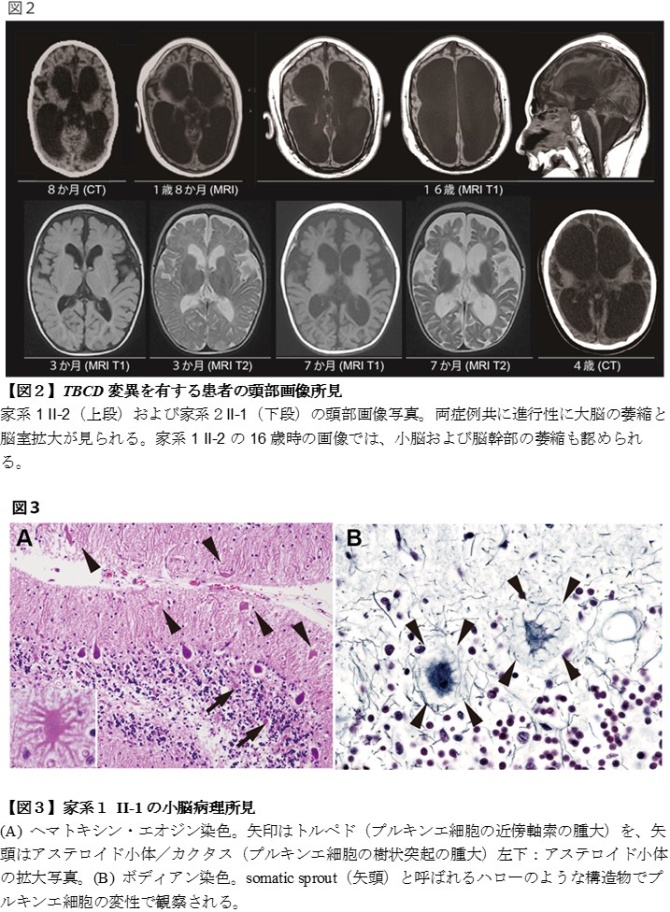
TBCD 変異を有する症例には、進行性の脳萎縮(図2)、退行、小頭症、成長障害、筋力低下・萎縮、呼吸障害が認められました。筋生検で得られた組織の解析からは、筋肉の未熟性が示唆されました。また、剖検例の脳組織学的検索により、少なくとも小脳の歯状核、脳幹および脊髄前角における下位運動神経核の消失と、小脳のプルキンエ細胞*2の変性所見(図3)が観察され、TBCD 変異に起因する変化と考えられました。後者の所見はミトコンドリア異常症で観察されること、また微小管が細胞内ミトコンドリア輸送に関わっていることから、TBCDの異常が微小管に依存する細胞内ミトコンドリア輸送を障害している可能性が示唆されました。
今回、ミスセンス変異5つ、ナンセンス変異1つ、スプライス部位の異常によるフレームシフト変異1つの計7変異が同定されました。それぞれの変異の影響を調べるために、TBCDと結合することが知られているTBCE、ARL2、βチューブリンとの結合能を免疫沈降で調べたところ、ほとんどの変異体においてTBCDとの結合能が低下していたことから、今回の変異が機能喪失型変異であることを証明しました。また、ショウジョウバエの tbcd1 変異体では、神経軸索が短縮したり正常の分岐が少なくなることが知られていましたが、ヒトTBCDを用いたレスキュー実験*3により、野生型の遺伝子を導入するとそれらの異常形態が改善しました。これに対し、患者に認められた変異体では、遺伝子導入による回復がほとんどないことがわかりました。
今回、新たな疾患遺伝子が解明されたことで小児期発症神経変性脳症の病態解明と、治療法の開発への大きな寄与が期待されます。
三宅准教授・松本教授らの研究グループは、小児期早期(1歳未満)に発症し、中枢神経系が進行性に変性する新しい臨床像を呈する4家系8症例を対象に全エキソーム解析を用いて遺伝子変異探索を行いました。その結果全8症例にTBCD 遺伝子の劣性変異(複合ヘテロ接合性変異またはホモ接合性変異)を同定しました(図1)。
TBCD 変異を有する症例には、進行性の脳萎縮(図2)、退行、小頭症、成長障害、筋力低下・萎縮、呼吸障害が認められました。筋生検で得られた組織の解析からは、筋肉の未熟性が示唆されました。また、剖検例の脳組織学的検索により、少なくとも小脳の歯状核、脳幹および脊髄前角における下位運動神経核の消失と、小脳のプルキンエ細胞*2の変性所見(図3)が観察され、TBCD 変異に起因する変化と考えられました。後者の所見はミトコンドリア異常症で観察されること、また微小管が細胞内ミトコンドリア輸送に関わっていることから、TBCDの異常が微小管に依存する細胞内ミトコンドリア輸送を障害している可能性が示唆されました。
今回、ミスセンス変異5つ、ナンセンス変異1つ、スプライス部位の異常によるフレームシフト変異1つの計7変異が同定されました。それぞれの変異の影響を調べるために、TBCDと結合することが知られているTBCE、ARL2、βチューブリンとの結合能を免疫沈降で調べたところ、ほとんどの変異体においてTBCDとの結合能が低下していたことから、今回の変異が機能喪失型変異であることを証明しました。また、ショウジョウバエの tbcd1 変異体では、神経軸索が短縮したり正常の分岐が少なくなることが知られていましたが、ヒトTBCDを用いたレスキュー実験*3により、野生型の遺伝子を導入するとそれらの異常形態が改善しました。これに対し、患者に認められた変異体では、遺伝子導入による回復がほとんどないことがわかりました。
今回、新たな疾患遺伝子が解明されたことで小児期発症神経変性脳症の病態解明と、治療法の開発への大きな寄与が期待されます。
(注釈)
*1 全エキソーム配列解析:ゲノム上のエキソン領域(遺伝子がタンパク質の配列を決定するゲノム中の領域)を網羅的に分画後、次世代シーケンサーを用いて塩基配列を決定する方法。
*2 プルキンエ細胞:小脳皮質の分子層と顆粒層の間(プルキンエ細胞層)に存在する大型の神経細胞で、伝達物質GABAを放出する抑制性ニューロン。
*3 レスキュー実験:遺伝子改変やノックダウン法により当該遺伝子の発現を消失もしくは低下させた個体もしくは細胞に現れた表現型が、野生型の遺伝子導入により正常に戻るか検討する実験のこと。機能を喪失している変異体を遺伝子導入しても表現型は正常に戻らない。
*本研究成果は、米国の科学雑誌『American Journal of Human Genetics』に掲載されました。(米国時間9月22日正午:日本時間9月23日午前1時オンライン)
*この研究は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業、厚生労働省、文部科学省、科学技術振興機構、日本学術振興会の研究補助金、横浜市立大学先端医科学研究センター「研究開発プロジェクト」によって行われました。
*本研究は、横浜市立大学神経内科・深井綾子医師、大場ちひろ医師、田中章景教授、横浜市立大学遺伝学・今川絵里博士研究員、横浜市立大学医学部生化学・椎名政昭助教、緒方一博教授、横浜市立大学附属病院遺伝子診療部・宮武聡子助教、昭和大学小児科・加藤光広講師、大阪府立母子保健総合医療センター・岡本伸彦医師、横浜市立大学大学院医学研究科分子細胞生物学・佐藤由典博士研究員、国立精神・神経医療研究センター・西野一三部長、三橋里美医師、横浜市立大学大学院医学研究科・免疫学教室・金子尚文氏、西山晃准教授、田村智彦教授、浜松医科大学医化学講座・才津浩智教授の協力を得て行われました。
*1 全エキソーム配列解析:ゲノム上のエキソン領域(遺伝子がタンパク質の配列を決定するゲノム中の領域)を網羅的に分画後、次世代シーケンサーを用いて塩基配列を決定する方法。
*2 プルキンエ細胞:小脳皮質の分子層と顆粒層の間(プルキンエ細胞層)に存在する大型の神経細胞で、伝達物質GABAを放出する抑制性ニューロン。
*3 レスキュー実験:遺伝子改変やノックダウン法により当該遺伝子の発現を消失もしくは低下させた個体もしくは細胞に現れた表現型が、野生型の遺伝子導入により正常に戻るか検討する実験のこと。機能を喪失している変異体を遺伝子導入しても表現型は正常に戻らない。
*本研究成果は、米国の科学雑誌『American Journal of Human Genetics』に掲載されました。(米国時間9月22日正午:日本時間9月23日午前1時オンライン)
*この研究は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業、厚生労働省、文部科学省、科学技術振興機構、日本学術振興会の研究補助金、横浜市立大学先端医科学研究センター「研究開発プロジェクト」によって行われました。
*本研究は、横浜市立大学神経内科・深井綾子医師、大場ちひろ医師、田中章景教授、横浜市立大学遺伝学・今川絵里博士研究員、横浜市立大学医学部生化学・椎名政昭助教、緒方一博教授、横浜市立大学附属病院遺伝子診療部・宮武聡子助教、昭和大学小児科・加藤光広講師、大阪府立母子保健総合医療センター・岡本伸彦医師、横浜市立大学大学院医学研究科分子細胞生物学・佐藤由典博士研究員、国立精神・神経医療研究センター・西野一三部長、三橋里美医師、横浜市立大学大学院医学研究科・免疫学教室・金子尚文氏、西山晃准教授、田村智彦教授、浜松医科大学医化学講座・才津浩智教授の協力を得て行われました。
お問い合わせ先
(本資料の内容に関するお問い合わせ)
公立大学法人横浜市立大学学術院医学群遺伝学
三宅紀子、松本直通
TEL:045-787-2606FAX:045-786-5219
E-mail:(三宅)
(松本)
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学先端研究推進課長
渡邊誠
TEL:045-787-2510FAX:045-787-2509
E-mail:
(事業に関するお問い合わせ)
日本医療研究開発機構戦略推進部難病研究課
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2223 Fax:03-6870-2243
E-mail:
公立大学法人横浜市立大学学術院医学群遺伝学
三宅紀子、松本直通
TEL:045-787-2606FAX:045-786-5219
E-mail:(三宅)
(松本)
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学先端研究推進課長
渡邊誠
TEL:045-787-2510FAX:045-787-2509
E-mail:
(事業に関するお問い合わせ)
日本医療研究開発機構戦略推進部難病研究課
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2223 Fax:03-6870-2243
E-mail: