2024.12.11
- TOPICS
- 学生の活躍
- 研究
- 理学部
デコイ核酸型PROTACの細胞内デリバリーに成功
生命医科学研究科の博士後期課程を修了した永沼美弥子さんらの研究グループは、デコイ核酸型PROTACの細胞内デリバリーに成功し、その研究成果が「RSC Medicinal Chemistry」に掲載されました。
 永沼さんがデザインしたアイキャッチ画像が、カバーアートとして選ばれました。
永沼さんがデザインしたアイキャッチ画像が、カバーアートとして選ばれました。
筆頭著者
生命医科学研究科 博士後期課程3年(2024年3月修了)
創薬有機化学研究室
永沼 美弥子 さん
指導教員
生命医科学研究科
創薬有機化学研究室 出水 庸介大学院客員教授
論文タイトル
「Hydrophobic CPP/HDO conjugates: a new frontier in oligonucleotide-warheaded PROTAC delivery」
(日本語訳:疎水性CPP/HDOコンジュゲート:オリゴヌクレオチドを標的リガンドとしたPROTAC送達の新しいフロンティア)
掲載雑誌
RSC Medicinal Chemistry
DOI:doi.org/10.1039/D4MD00546E
生命医科学研究科 博士後期課程3年(2024年3月修了)
創薬有機化学研究室
永沼 美弥子 さん
指導教員
生命医科学研究科
創薬有機化学研究室 出水 庸介大学院客員教授
論文タイトル
「Hydrophobic CPP/HDO conjugates: a new frontier in oligonucleotide-warheaded PROTAC delivery」
(日本語訳:疎水性CPP/HDOコンジュゲート:オリゴヌクレオチドを標的リガンドとしたPROTAC送達の新しいフロンティア)
掲載雑誌
RSC Medicinal Chemistry
DOI:doi.org/10.1039/D4MD00546E
今回の研究内容について永沼さんに解説していただきました。
PROTACは、生体内のタンパク質分解機構であるユビキチン-プロテアソーム*1システムを利用することで、標的タンパク質をプロテアソームによって強制的に分解誘導することが可能です。生体内で異常に発現し疾患の原因となるタンパク質などを分解し、疾病にアプローチできることから、既存の医薬品では治療が困難な疾病に対する革新的な創薬戦略の一つとして期待されています。PROTACは、E3リガーゼリガンド、リンカー、標的タンパク質リガンドの3要素から構成される2機能性の分子です。近年、PROTACの標的タンパク質のリガンドに20塩基前後の核酸オリゴマーを用いたPROTAC(デコイ核酸型PROTAC)が開発され、最適なリガンドが存在しない転写因子*2などのタンパク質の分解を達成しています。現在までに約1,600種類のヒト転写因子が報告されており、そのうちおよそ96%のDNA結合領域の配列が明らかとなっており、データベース化されています。そこで、転写因子のDNA結合領域に結合し囮として転写を阻害するデコイ核酸を標的リガンドとして活用できれば、データベースの配列を基にPROTACの設計が容易になると考えました。また、ここ数年でデコイ核酸型PROTAC、既存の分子では標的にできなかった転写因子の分解を達成した報告があることからもにより転写因子分解誘導剤としての有用性が期待されています。
私達はこれまでに、エストロゲン受容体α(ERα)を転写因子のモデルとしたデコイ核酸型PROTACとして、LCL-ER(dec)の開発に成功しています。しかしながら、これまでに開発されているデコイ核酸型のPROTACは、標的タンパク質が発現している細胞内への送達が困難でした。そのため、細胞内へ導入するための試薬を必要としており、臨床応用にはドラッグデリバリーシステム(DDS)*3との組み合わせが必須です。そこで、本研究では細胞内導入戦略の一つとして、ヘテロ2本鎖核酸(HDO)に着目し、HDO核酸型PROTAC、CPP/HDO-PROTACの開発に成功しました。
設計・合成したCPP/HDO-PROTACについて、ERα分解活性を評価した結果、10 µMでERαを分解できることが明らかとなりました。疎水性CPPとHDOを組み合わせることにより、細胞内導入試薬に依存しないPROTACの細胞内導入が初めて可能になりました。今後、RNA鎖の安定性や、輸送効率と組織特異性を向上させることにより核酸型PROTACの臨床応用が期待できると考えています。
PROTACは、生体内のタンパク質分解機構であるユビキチン-プロテアソーム*1システムを利用することで、標的タンパク質をプロテアソームによって強制的に分解誘導することが可能です。生体内で異常に発現し疾患の原因となるタンパク質などを分解し、疾病にアプローチできることから、既存の医薬品では治療が困難な疾病に対する革新的な創薬戦略の一つとして期待されています。PROTACは、E3リガーゼリガンド、リンカー、標的タンパク質リガンドの3要素から構成される2機能性の分子です。近年、PROTACの標的タンパク質のリガンドに20塩基前後の核酸オリゴマーを用いたPROTAC(デコイ核酸型PROTAC)が開発され、最適なリガンドが存在しない転写因子*2などのタンパク質の分解を達成しています。現在までに約1,600種類のヒト転写因子が報告されており、そのうちおよそ96%のDNA結合領域の配列が明らかとなっており、データベース化されています。そこで、転写因子のDNA結合領域に結合し囮として転写を阻害するデコイ核酸を標的リガンドとして活用できれば、データベースの配列を基にPROTACの設計が容易になると考えました。また、ここ数年でデコイ核酸型PROTAC、既存の分子では標的にできなかった転写因子の分解を達成した報告があることからもにより転写因子分解誘導剤としての有用性が期待されています。
私達はこれまでに、エストロゲン受容体α(ERα)を転写因子のモデルとしたデコイ核酸型PROTACとして、LCL-ER(dec)の開発に成功しています。しかしながら、これまでに開発されているデコイ核酸型のPROTACは、標的タンパク質が発現している細胞内への送達が困難でした。そのため、細胞内へ導入するための試薬を必要としており、臨床応用にはドラッグデリバリーシステム(DDS)*3との組み合わせが必須です。そこで、本研究では細胞内導入戦略の一つとして、ヘテロ2本鎖核酸(HDO)に着目し、HDO核酸型PROTAC、CPP/HDO-PROTACの開発に成功しました。
設計・合成したCPP/HDO-PROTACについて、ERα分解活性を評価した結果、10 µMでERαを分解できることが明らかとなりました。疎水性CPPとHDOを組み合わせることにより、細胞内導入試薬に依存しないPROTACの細胞内導入が初めて可能になりました。今後、RNA鎖の安定性や、輸送効率と組織特異性を向上させることにより核酸型PROTACの臨床応用が期待できると考えています。
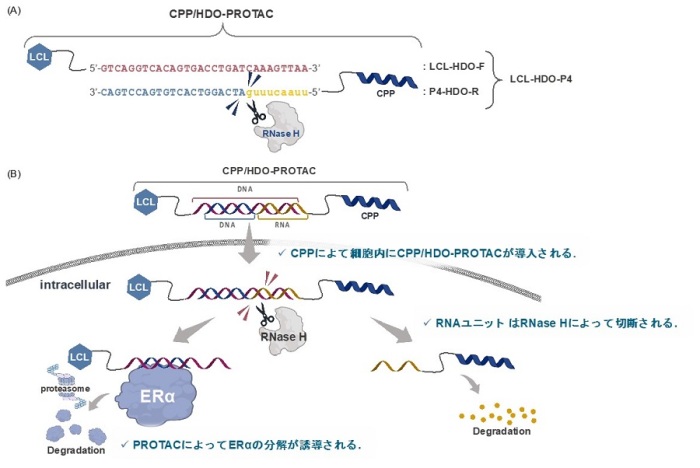 図1 本研究で開発したPROTACの分子設計とCPP/HDO-PROTACによるERαの分解
図1 本研究で開発したPROTACの分子設計とCPP/HDO-PROTACによるERαの分解(A)CPP/HDO-PROTACは、LCL161誘導体に結合した30merのDNA(LCL-HDO-F)と、疎水性CPPに結合した9merのRNAを持つ30merのDNA(P4-HDO-R)を組み合わせた2本鎖のオリゴ核酸。
(B)CPP/HDO-PROTACは疎水性CPPを介して細胞に入り、RNaseHを介したRNA鎖の切断とCPPの剥離によってデコイ核酸型PROTACが放出され、PROTACがERαを分解誘導することを期待してデザインした。
永沼 美弥子さんのコメント
本研究は、近年盛んに研究されているタンパク質分解誘導剤「PROTAC」と核酸医薬のHDOを組み合わせた新規核酸型PROTACの研究です。これまで開発した核酸型PROTACに対してデリバリー機能を持たせるために面白いことはできないかと考え、自身で立案することができたテーマです。博士課程のメインの研究と並行しながらのデータ集めは大変さもありましたが、研究室の強みでもあるペプチドと自身の研究を組み合わせた研究を実現し、コンセプトを実証できた時の感動は今も鮮明に覚えています。また、今回の論文においても、Inside Front Coverに採択していただきとても光栄です。
改めまして、本研究の遂行にあたり、いつも熱心にご指導いただきました出水先生をはじめ、国立医薬品食品衛生研究所有機化学部の皆さま、共同研究者としてお世話になりました国立医薬品食品衛生研究所 遺伝子医薬部の大岡先生の他、ご支援頂いた皆様に深く感謝申し上げます。いつも楽しくディスカッションをしてくれていた平野くん、追加実験をしてくれた渡邊くん、本当にありがとうございました!
指導教員 出水 庸介 大学院客員教授のコメント
永沼さん、論文アクセプトおめでとうございます!
今回の研究では、細胞膜透過性ペプチド*4を活用することで、トランスフェクションを必要としないデコイ核酸PROTACの開発を報告しました。この研究は、学位申請論文(10.1021/acs.bioconjchem.3c00332)をまとめている多忙な時期に永沼さんが自ら立案し、卒業間際まで粘り強く実験を続け、就職後も論文執筆を完遂してくれたものです。永沼さんが卒業に向けて奮闘している姿を傍らで見ながら「何か面白いことをしているなぁ」と感じていたのを思い出します。
今回の研究で自らデザインしたアイキャッチ画像がカバーアートに選ばれたこと(「永沼3部作」と呼んでいます。10.1021/acsmedchemlett.1c00629)も、永沼さんの創造力と独創性を示す素晴らしい成果です。
現在、勤務先でも非常に活躍していると聞いており、永沼さんは今後も社会において大いに貢献できる人材だと確信しています。
用語説明
*1プロテアソーム:細胞質や核内の不要なタンパク質を分解する約2.5MDaの巨大な酵素複合体。ポリユビキチン鎖により標識されたタンパク質を選択的に分解することでさまざまな生命現象を制御する。
*2 転写因子:DNAに配列特異的に結合するタンパク質で、プロモーターやエンハンサーといった転写制御領域に結合し、RNAポリメラーゼによる遺伝子の転写を活性化あるいは不活性化する。
*3 ドラッグデリバリーシステム(DDS):治療薬の薬物動態や薬力学を改善し、適切な時間と速度で目的の部位に必要量を送達するための分子やデバイス。受容体結合リガンドや細胞膜透過性ペプチド、ナノ粒子、マイクロ粒子などの分子に加え、経皮吸収パッチ、吸入器などのデバイスも含まれる。
*4 細胞膜透過性ペプチド(CPP): 細胞膜を通過し細胞内に移行可能なポリペプチドのこと。多くは10から100程度のアミノ酸で構成される。
本研究は、近年盛んに研究されているタンパク質分解誘導剤「PROTAC」と核酸医薬のHDOを組み合わせた新規核酸型PROTACの研究です。これまで開発した核酸型PROTACに対してデリバリー機能を持たせるために面白いことはできないかと考え、自身で立案することができたテーマです。博士課程のメインの研究と並行しながらのデータ集めは大変さもありましたが、研究室の強みでもあるペプチドと自身の研究を組み合わせた研究を実現し、コンセプトを実証できた時の感動は今も鮮明に覚えています。また、今回の論文においても、Inside Front Coverに採択していただきとても光栄です。
改めまして、本研究の遂行にあたり、いつも熱心にご指導いただきました出水先生をはじめ、国立医薬品食品衛生研究所有機化学部の皆さま、共同研究者としてお世話になりました国立医薬品食品衛生研究所 遺伝子医薬部の大岡先生の他、ご支援頂いた皆様に深く感謝申し上げます。いつも楽しくディスカッションをしてくれていた平野くん、追加実験をしてくれた渡邊くん、本当にありがとうございました!
指導教員 出水 庸介 大学院客員教授のコメント
永沼さん、論文アクセプトおめでとうございます!
今回の研究では、細胞膜透過性ペプチド*4を活用することで、トランスフェクションを必要としないデコイ核酸PROTACの開発を報告しました。この研究は、学位申請論文(10.1021/acs.bioconjchem.3c00332)をまとめている多忙な時期に永沼さんが自ら立案し、卒業間際まで粘り強く実験を続け、就職後も論文執筆を完遂してくれたものです。永沼さんが卒業に向けて奮闘している姿を傍らで見ながら「何か面白いことをしているなぁ」と感じていたのを思い出します。
今回の研究で自らデザインしたアイキャッチ画像がカバーアートに選ばれたこと(「永沼3部作」と呼んでいます。10.1021/acsmedchemlett.1c00629)も、永沼さんの創造力と独創性を示す素晴らしい成果です。
現在、勤務先でも非常に活躍していると聞いており、永沼さんは今後も社会において大いに貢献できる人材だと確信しています。
用語説明
*1プロテアソーム:細胞質や核内の不要なタンパク質を分解する約2.5MDaの巨大な酵素複合体。ポリユビキチン鎖により標識されたタンパク質を選択的に分解することでさまざまな生命現象を制御する。
*2 転写因子:DNAに配列特異的に結合するタンパク質で、プロモーターやエンハンサーといった転写制御領域に結合し、RNAポリメラーゼによる遺伝子の転写を活性化あるいは不活性化する。
*3 ドラッグデリバリーシステム(DDS):治療薬の薬物動態や薬力学を改善し、適切な時間と速度で目的の部位に必要量を送達するための分子やデバイス。受容体結合リガンドや細胞膜透過性ペプチド、ナノ粒子、マイクロ粒子などの分子に加え、経皮吸収パッチ、吸入器などのデバイスも含まれる。
*4 細胞膜透過性ペプチド(CPP): 細胞膜を通過し細胞内に移行可能なポリペプチドのこと。多くは10から100程度のアミノ酸で構成される。


