遺伝子の抑制にかかわるヒストンネットワークの動的構造を初めて解明
2023.01.24
- プレスリリース
- 研究
- 理学部
遺伝子の抑制にかかわるヒストンネットワークの動的構造を初めて解明
横浜市立大学大学院生命医科学研究科の大友秀明特任助教、古川亜矢子特任助教、津中康央特任助教と西村善文特任教授(広島大学大学院統合生命科学研究科長兼任)らは、理化学研究所の伊藤伸介研究員、古関明彦チームリーダー、江原晴彦研究員、関根俊一チームリーダー、梅原崇史チームリーダーやオーストラリアのMonash大学のChen Davidovich教授との共同研究で、核磁気共鳴装置(NMR*1)やクライオ電子顕微鏡(Cryo-EM*2)と生化学実験を用いて、遺伝子の発現抑制にかかわるクロマチンの基本構造であるヌクレオソーム中のヒストンネットワークの動的な構造を初めて解明しました。
本研究は、『Journal of Molecular Biology』に掲載されました。
本研究は、『Journal of Molecular Biology』に掲載されました。
研究成果のポイント
|
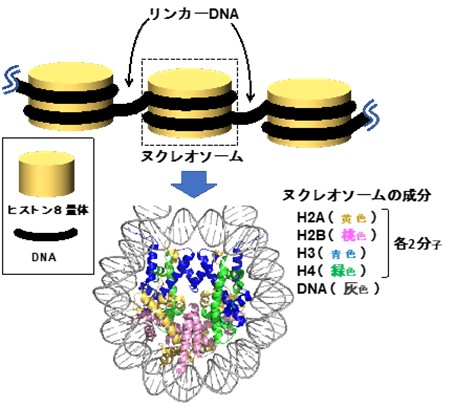 図1 クロマチン構造の一部とヌクレオソームのコア構造
図1 クロマチン構造の一部とヌクレオソームのコア構造
研究背景
真核生物のDNAは様々な因子によって折りたたまれ、クロマチン構造と呼ばれる形をとっています。遺伝子の発現(オン)や抑制(オフ)はクロマチン構造の変化によって制御されています。DNAの配列情報をゲノムと呼びますが、ゲノムの発現や抑制などの機能を制御しているクロマチンの構造を含めてエピゲノム*3と呼びます。クロマチンは、ヒストンタンパク質にDNAが巻き付いたヌクレオソームという構造体がリンカーDNAで繋がれた繰り返し構造を基本とし、コアの構造はX線結晶構造解析やクライオ電子顕微鏡(Cryo-EM)によって決定されています(図1)。
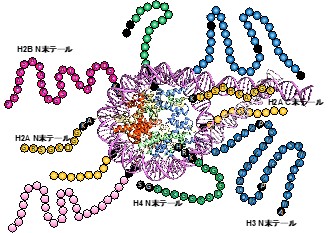 図2 ヌクレオソームのヒストンテールの模式図
図2 ヌクレオソームのヒストンテールの模式図
ヌクレオソームには4種類のヒストン(H2A、H2B、H3、H4)が含まれており、H2AはN末端とC末端、H2B、H3、H4はN末端にそれぞれテールという領域をもっており、コアの構造から突き出て揺らいでいてX線結晶構造解析やCryo-EMでは見えていません。
図2では各々のテールを模式的に示しています。これまではヒストンテール間の相互作用に関して、ほとんど分かっていませんでしたが、H4のN末テール、H3のN末テール、H2AのC末テールの間及びH2AとH2BのN末テールの間に相関があることが図から想像できます。しかし、その実態の多くは不明でした。
図2では各々のテールを模式的に示しています。これまではヒストンテール間の相互作用に関して、ほとんど分かっていませんでしたが、H4のN末テール、H3のN末テール、H2AのC末テールの間及びH2AとH2BのN末テールの間に相関があることが図から想像できます。しかし、その実態の多くは不明でした。
ヌクレオソームの機能上テールの翻訳後修飾がエピゲノムでは非常に重要であることが分かっており、ヒストンテールの翻訳後修飾としてはアセチル化やメチル化やユビキチン化*4が知られています。ヒストンのテールがアセチル化されると遺伝子は発現しヒストンのテールがメチル化やユビキチン化されると遺伝子が抑制される機構が存在します。
本研究グループは既にヒストンH4のN末テールがアセチル化されるとヒストンH3のN末テールのアセチル化が促進される機構を解明し、遺伝子の発現が加速的に制御されている事を解明しています(1,2)。またヒストンシャペロンというタンパク質(FACT)がヌクレオソームに結合すると同じくヒストンH3のN末テールがより溶媒に露出しアセチル化される機構も解明しました(3)。またH2AとH2BのN末テールの動的構造間に相関があることを解明し(4)、さらにFACTはH2AとH2Bの各N末テールの動的構造を変化する事によりヌクレオソームからH2A-H2Bを剥がしてヌクレオソームを緩める機構も解明しました(5)。これらの機構が協調して遺伝子は発現すると考えられます(6,7)。
今回は新たに遺伝子が抑制される機構の一つを解明しました。細胞の運命を決定する時にポリコーム抑制複合体がヌクレオソームに結合し遺伝子の発現を抑制します。ポリコーム抑制複合体にはPRC1とPRC2の2種類が存在します。PRC1はヒストンH2AのC末テールをユビキチン化し、PRC2はヒストンH3のN末テールをメチル化します。この両者の動的な協調関係は今まで不明でした。
今回NMRによりH2Aがユビキチン化されるとH3の動的構造が変化しH3のメチル化を促進する機構を発見し遺伝子抑制に関与する協調機構を解明しました。
本研究グループは既にヒストンH4のN末テールがアセチル化されるとヒストンH3のN末テールのアセチル化が促進される機構を解明し、遺伝子の発現が加速的に制御されている事を解明しています(1,2)。またヒストンシャペロンというタンパク質(FACT)がヌクレオソームに結合すると同じくヒストンH3のN末テールがより溶媒に露出しアセチル化される機構も解明しました(3)。またH2AとH2BのN末テールの動的構造間に相関があることを解明し(4)、さらにFACTはH2AとH2Bの各N末テールの動的構造を変化する事によりヌクレオソームからH2A-H2Bを剥がしてヌクレオソームを緩める機構も解明しました(5)。これらの機構が協調して遺伝子は発現すると考えられます(6,7)。
今回は新たに遺伝子が抑制される機構の一つを解明しました。細胞の運命を決定する時にポリコーム抑制複合体がヌクレオソームに結合し遺伝子の発現を抑制します。ポリコーム抑制複合体にはPRC1とPRC2の2種類が存在します。PRC1はヒストンH2AのC末テールをユビキチン化し、PRC2はヒストンH3のN末テールをメチル化します。この両者の動的な協調関係は今まで不明でした。
今回NMRによりH2Aがユビキチン化されるとH3の動的構造が変化しH3のメチル化を促進する機構を発見し遺伝子抑制に関与する協調機構を解明しました。
研究内容
本研究では、リンカーDNAを含む193bpの長さのDNAを用いたヌクレオソームとリンカーDNAの無い145bpのDNAを用いたヌクレオソームコア粒子(NCP)を調製しました。各々H2AのC末をPRC1によりユビキチン化し、4種類の試料NCP、ユビキチン化NCP、ヌクレオソーム、ユビキチン化ヌクレオソームを用意し、各々のヒストンH3テールの動的構造をNMRで解析しました。なおユビキチン化ヌクレオソームのCryo-EM構造ではユビキチン化しても、今まで報告されているNCPの構造などと比較してコアの構造には全く変化が無いことを確認しました(図3)。
図3のAに示した構造は、たまたまユビキチン分子が見えた構造でH2Aubと書いた部分がユビキチン分子ですが、ほとんどのCryo-EM構造では図3のBで示すように恐らくユビキチン分子が揺らいでいるため、見えていません。いずれにしてもコアの構造は変化していなくてヒストンテールは見えていません。
図3のAに示した構造は、たまたまユビキチン分子が見えた構造でH2Aubと書いた部分がユビキチン分子ですが、ほとんどのCryo-EM構造では図3のBで示すように恐らくユビキチン分子が揺らいでいるため、見えていません。いずれにしてもコアの構造は変化していなくてヒストンテールは見えていません。
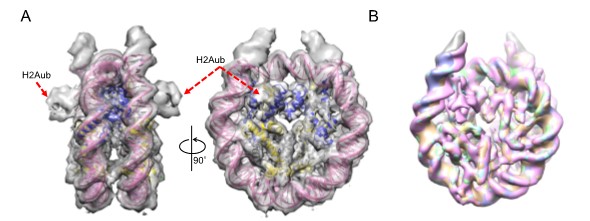 図3 ユビキチン化ヌクレオソームのCryo-EM構造 A:ユビキチンが観測されたユビキチン化ヌクレオソーム構造、B:全ユビキチン化ヌクレオソーム構造
図3 ユビキチン化ヌクレオソームのCryo-EM構造 A:ユビキチンが観測されたユビキチン化ヌクレオソーム構造、B:全ユビキチン化ヌクレオソーム構造
一方NMRの測定ではユビキチン化していないNCPとヌクレオソームではH3テールのシグナルに変化があり、その変化はNCPではヒストンH3テールはよりDNAに結合している方向でした。NCPではDNAはコアに2巻きしていますが2巻きの間に動的に結合している構造が考えられます。しかしヌクレオソームではリンカーDNAがコアから突き出ていてそこに動的に結合できます。コアのDNAは固定化されそこにH3テールが動的に結合する構造とリンカーDNAはコアから突き出て揺らいでいてH3テールが動的に結合する構造の2種類があることが分かりました。
図4B、Cに示すようにユビキチン化NCPではNCPと比べてほとんどヒストンテールのシグナルの変化が無かったのでコアのDNAに動的に結合している構造はH2Aのユビキチン化により変化していないと考えられます。一方図4A、Cに示すようにヌクレオソームはユビキチン化によりH3テールのシグナルが大きく変化しました。その変化はユビキチン化によりDNAに動的により強く結合している方向でした。ただしシグナルはNCP型の構造とは違っていました。これらのヒストンH3テールの動的構造の違いがPRC2によるH3テールのメチル化にどのように影響するかを次に検討しました。
図4B、Cに示すようにユビキチン化NCPではNCPと比べてほとんどヒストンテールのシグナルの変化が無かったのでコアのDNAに動的に結合している構造はH2Aのユビキチン化により変化していないと考えられます。一方図4A、Cに示すようにヌクレオソームはユビキチン化によりH3テールのシグナルが大きく変化しました。その変化はユビキチン化によりDNAに動的により強く結合している方向でした。ただしシグナルはNCP型の構造とは違っていました。これらのヒストンH3テールの動的構造の違いがPRC2によるH3テールのメチル化にどのように影響するかを次に検討しました。
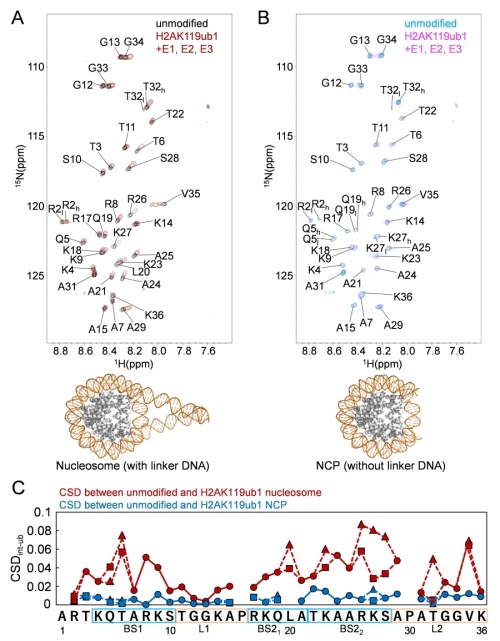 図4.H2AのC末テールのユビキチン化によるH3のN末テールのNMRシグナル変化 A:ヌクレオソームとユビキチン化ヌクレオソームのNMRシグナルの変化、B:NCPとユビキチン化NCPのNMRのシグナル変化は殆ど見られない。、C:ヌクレオソームとユビキチン化ヌクレオソームのシグナル変化の大きさ(赤)をH3テールのアミノ酸毎に示し、NCPとユビキチン化NCPのシグナル変化の大きさ(青)との比較
図4.H2AのC末テールのユビキチン化によるH3のN末テールのNMRシグナル変化 A:ヌクレオソームとユビキチン化ヌクレオソームのNMRシグナルの変化、B:NCPとユビキチン化NCPのNMRのシグナル変化は殆ど見られない。、C:ヌクレオソームとユビキチン化ヌクレオソームのシグナル変化の大きさ(赤)をH3テールのアミノ酸毎に示し、NCPとユビキチン化NCPのシグナル変化の大きさ(青)との比較
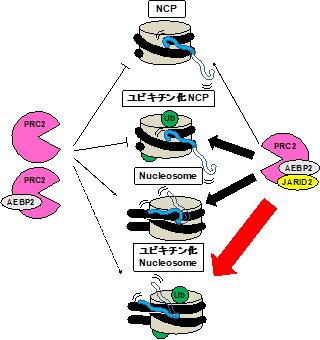 図5 H3テールの27番目のリシン残基へのメチル化活性の違い
図5 H3テールの27番目のリシン残基へのメチル化活性の違い
図5に示したようにメチル化の程度はNCPで一番弱く、続いてヌクレオソームとユビキチン化NCPが同程度で、一番強くメチル化されるのがユビキチン化ヌクレオソームでした。NCPでH3テールの動的構造は同じなのにメチル化が促進されたのはユビキチンがPRC2のサブユニットのJARID2と結合してより親和性が増したためです。ヌクレオソームではユビキチン化されてなくてもNCPに比べてH3テールのリンカーDNAとの動的な結合構造がPRC2の酵素活性を促進したためであると考えられます。
ユビキチン化ヌクレオソームではPRC2のサブユニットとユビキチンの親和性の増加とH3テールのリンカーDNA との動的結合の構造変化が相乗的に働き酵素反応を活性化させたためです。よってユビキチン化とリンカーDNAの相乗的な効果により遺伝子抑制に関わるヌクレオソームのメチル化が促進されていることが判明しました。
これまでヌクレオソーム間でヒストンテールがネットワークを形成していることが多数報告されてきましたが、私達は単独のヌクレオソーム内でヒストンテールがネットワークを形成していることを初めて明らかにし、遺伝子発現におけるネットワークに加えて遺伝子抑制におけるネットワークを解明できました。
これまでヌクレオソーム間でヒストンテールがネットワークを形成していることが多数報告されてきましたが、私達は単独のヌクレオソーム内でヒストンテールがネットワークを形成していることを初めて明らかにし、遺伝子発現におけるネットワークに加えて遺伝子抑制におけるネットワークを解明できました。
今後の展開
本研究では遺伝子の抑制に関与するH2Aテールのユビキチン化とH3テールのメチル化がリンカーDNA上で相乗的に働いている事を解明しました。本研究グループでは既に遺伝子発現に関与するH4テールのアセチル化がH3テールのリンカーDNAへの動的結合を変化させアセチル化を促進する遺伝子発現の相乗効果を見出しています。今回発見した遺伝子抑制に関与するH3テールのリンカーDNAへの動的結合と遺伝子発現に関与するH3テールの動的結合の差異が発現と抑制の差を反映していると考えられるので、エピゲノムで重要な様々なヒストンテールの動的結合の変化によるH3テールの動的結合の変化を調べることにより遺伝子発現と抑制に関与する特徴的な動的結合が解明されることが期待されます。特にPRC2の機能異常は様々ながんに関与している事が報告され、PRC2のインヒビターが抗がん剤として開発がなされています。本研究によりヌクレオソームのリンカーDNAがPRC2の機能に果たす役割を解明したことはPRC2のインヒビターの開発に於いて重要な観点を与えると期待されます。
研究費
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」、文部科学省「先端研究基盤共用促進事業(共用プラットフォーム形成支援プログラム) NMR共用プラットフォーム」の一環で行われました。
論文情報
H2A ubiquitination alters H3-tail dynamics on linker-DNA to enhance H3K27 methylation.
Hideaki Ohtomo, Shinsuke Ito, Nicholas J. McKenzie, Michael Uckelmann,Masatoshi Wakamori, Haruhiko Ehara, Ayako Furukawa, Yasuo Tsunaka, Marika Shibata, Shun-ichi Sekine, Takashi Umehara, Chen Davidovich,Haruhiko Koseki, Yoshifumi Nishimura
DOI:https://doi.org/10.1016/j.jmb.2022.167936
Hideaki Ohtomo, Shinsuke Ito, Nicholas J. McKenzie, Michael Uckelmann,Masatoshi Wakamori, Haruhiko Ehara, Ayako Furukawa, Yasuo Tsunaka, Marika Shibata, Shun-ichi Sekine, Takashi Umehara, Chen Davidovich,Haruhiko Koseki, Yoshifumi Nishimura
DOI:https://doi.org/10.1016/j.jmb.2022.167936
用語説明
*1 NMR:
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質などに対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。ふらふらと揺らいでいるタンパク質部位の原子レベルでの同定が可能である。
*2 Cryo-EM:
解析試料を氷の中に分散し、電子顕微鏡で分散した各々の試料を個別に解析し、多数の電子顕微鏡像から3次元構造を再構築する。通常の電子顕微鏡では試料が真空中で干からびた構造になるが、Cryo-EMでは水溶液中の試料の3次元構造を氷に中に固めた状態で測定できるのでより機能構造が判る。最近の技術的な進歩により原子レベルでタンパク質やDNAとの複合体構造が解析できるようになった。
*3 エピゲノム:
ゲノムを超えてという意味で、同じゲノムDNAを持っていても、例えばヒトでは心臓や肝臓や神経など約250種類の細胞に分化するのは、細胞ごとにDNAがとるクロマチン構造が変化しているためで、その変化にヒストンテールの翻訳後修飾が非常に重要な役割を果たしている。エピゲノムの変化は細胞の発生や分化や老化に関わるだけではなく、エピゲノムの異常はがん化や神経疾患など様々な疾病に関与している。
*4 ユビキチン:
アミノ酸が76個からなる小さなタンパク質で、他のタンパク質の修飾に用いられ、タンパク質分解やエピゲノムなど様々な生命現象に関与している。
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質などに対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。ふらふらと揺らいでいるタンパク質部位の原子レベルでの同定が可能である。
*2 Cryo-EM:
解析試料を氷の中に分散し、電子顕微鏡で分散した各々の試料を個別に解析し、多数の電子顕微鏡像から3次元構造を再構築する。通常の電子顕微鏡では試料が真空中で干からびた構造になるが、Cryo-EMでは水溶液中の試料の3次元構造を氷に中に固めた状態で測定できるのでより機能構造が判る。最近の技術的な進歩により原子レベルでタンパク質やDNAとの複合体構造が解析できるようになった。
*3 エピゲノム:
ゲノムを超えてという意味で、同じゲノムDNAを持っていても、例えばヒトでは心臓や肝臓や神経など約250種類の細胞に分化するのは、細胞ごとにDNAがとるクロマチン構造が変化しているためで、その変化にヒストンテールの翻訳後修飾が非常に重要な役割を果たしている。エピゲノムの変化は細胞の発生や分化や老化に関わるだけではなく、エピゲノムの異常はがん化や神経疾患など様々な疾病に関与している。
*4 ユビキチン:
アミノ酸が76個からなる小さなタンパク質で、他のタンパク質の修飾に用いられ、タンパク質分解やエピゲノムなど様々な生命現象に関与している。
参考文献
1.Furukawa A, Wakamori M, Arimura Y, Ohtomo H, Tsunaka Y, Kurumizaka H, Umehara T, Nishimura Y. Acetylated histone H4 tail enhances histone H3 tail acetylation by altering their mutual dynamics in the nucleosome. Proc. Natl. Acad. Sci. U S A; 117, 19661-19663 (2020). doi: 10.1073/pnas.2010506117.
2.Furukawa A, Wakamori M, Arimura Y, Ohtomo H, Tsunaka Y, Kurumizaka H, Umehara T, Nishimura Y. Characteristic H3 N-tail dynamics in the nucleosome core particle, nucleosome, and chromatosome. iScience; 25,103937. (2022). doi: 10.1016/j.isci.2022.103937.
3.Tsunaka Y, Ohtomo H, Morikawa K, Nishimura Y. Partial Replacement of Nucleosomal DNA with Human FACT Induces Dynamic Exposure and Acetylation of Histone H3 N-Terminal Tails. iScience. 23, 101641 (2020). doi: 10.1016/j.isci.2020.101641.
4.Ohtomo H, Kurita JI, Sakuraba S, Li Z, Arimura Y, Wakamori M, Tsunaka Y, Umehara T, Kurumizaka H, Kono H, Nishimura Y. The N-terminal Tails of Histones H2A and H2B Adopt Two Distinct Conformations in the Nucleosome with Contact and Reduced Contact to DNA. J Mol Biol.;433,167110 (2021). doi: 10.1016/j.jmb.2021.167110.
5.Tsunaka Y, Ohtomo H, Nishimura Y. FACT modulates the conformations of histone H2A and H2B N-terminal tails within nucleosomes. Commun Biol. 5, 814. (2022). doi: 10.1038/s42003-022-03785-z.
6.Tsunaka Y, Furukawa A, Nishimura Y. Histone tail network and modulation in a nucleosome. Curr Opin Struct Biol. 75, 102436. (2022). doi: 10.1016/j.sbi.2022.102436.
7.Okuda M, Tsunaka Y, Nishimura Y. Dynamic structures of intrinsically disordered proteins related to the general transcription factor TFIIH, nucleosomes, and histone chaperones. Biophysical Reviews 14, (2022). doi.org/10.1007/s12551-022-01014-9
2.Furukawa A, Wakamori M, Arimura Y, Ohtomo H, Tsunaka Y, Kurumizaka H, Umehara T, Nishimura Y. Characteristic H3 N-tail dynamics in the nucleosome core particle, nucleosome, and chromatosome. iScience; 25,103937. (2022). doi: 10.1016/j.isci.2022.103937.
3.Tsunaka Y, Ohtomo H, Morikawa K, Nishimura Y. Partial Replacement of Nucleosomal DNA with Human FACT Induces Dynamic Exposure and Acetylation of Histone H3 N-Terminal Tails. iScience. 23, 101641 (2020). doi: 10.1016/j.isci.2020.101641.
4.Ohtomo H, Kurita JI, Sakuraba S, Li Z, Arimura Y, Wakamori M, Tsunaka Y, Umehara T, Kurumizaka H, Kono H, Nishimura Y. The N-terminal Tails of Histones H2A and H2B Adopt Two Distinct Conformations in the Nucleosome with Contact and Reduced Contact to DNA. J Mol Biol.;433,167110 (2021). doi: 10.1016/j.jmb.2021.167110.
5.Tsunaka Y, Ohtomo H, Nishimura Y. FACT modulates the conformations of histone H2A and H2B N-terminal tails within nucleosomes. Commun Biol. 5, 814. (2022). doi: 10.1038/s42003-022-03785-z.
6.Tsunaka Y, Furukawa A, Nishimura Y. Histone tail network and modulation in a nucleosome. Curr Opin Struct Biol. 75, 102436. (2022). doi: 10.1016/j.sbi.2022.102436.
7.Okuda M, Tsunaka Y, Nishimura Y. Dynamic structures of intrinsically disordered proteins related to the general transcription factor TFIIH, nucleosomes, and histone chaperones. Biophysical Reviews 14, (2022). doi.org/10.1007/s12551-022-01014-9