2021.11.30
- TOPICS
- 大学
- 学生の活躍
生命医科学研究科 博士前期課程 2年の伊藤 朱里さんが、情報計算科学生物(CBI)学会2021年大会でベストポスター賞を受賞しました。
大学院 生命医科学研究科 博士前期課程 2年の伊藤 朱里さん(指導教員:池口 満徳教授)は、2021年10月26日(火)〜28日(木)にオンラインで開催された情報計算科学生物(CBI)学会2021年大会においてポスター発表を行い、ベストポスター賞を受賞しました。
受賞者
生命医科学研究科 博士前期課程 2年
伊藤 朱里(いとう あかり)さん
発表演題
「Comparison of molecular dynamics of cyclosporin A and cyclosporin E」
(シクロスポリンAとシクロスポリンEの分子ダイナミクスの比較)
受賞者
生命医科学研究科 博士前期課程 2年
伊藤 朱里(いとう あかり)さん
発表演題
「Comparison of molecular dynamics of cyclosporin A and cyclosporin E」
(シクロスポリンAとシクロスポリンEの分子ダイナミクスの比較)

伊藤 朱里さんのコメント
この度は名誉ある賞を頂戴し、大変光栄に思います。発表準備にあたり、親切にご指導くださった池口教授をはじめ、多くのアドバイスをくださった浴本助教、理化学研究所の山根上級研究員 、生命情報科学研究室の皆様に心より感謝申し上げます。
会期中は、多くの専門家の方々に質問やアドバイスをいただきました。自分の研究について多角的な視点を持つことができ、私の研究生活において非常に意義深いものとなりました。今回の経験を活かして、より一層精進していきたいと思います。
会期中は、多くの専門家の方々に質問やアドバイスをいただきました。自分の研究について多角的な視点を持つことができ、私の研究生活において非常に意義深いものとなりました。今回の経験を活かして、より一層精進していきたいと思います。
指導教員 池口 満徳 教授のコメント
学部時代からがんばって研究を行ってきた成果だと思います。研究を行う過程では、いろいろな問題が起きましたが、グループのメンバーで相談しながら一つ一つ解決していったことが、この成果につながったように思います。今後の社会生活でも、そのような試行錯誤はとても重要だと思いますので、今回の成果を励みにぜひがんばって欲しいと思います。
発表内容
免疫抑制剤シクロスポリンA (CsA)は、非天然アミノ酸を含む環状ペプチド分子です。CsAは経口投与できる薬の中では、比較的大きな分子量をもった中分子医薬品であり、なぜ、大きな分子なのに高い膜透過性をもっているのか、そのメカニズムの解明が望まれています。これまでに、水中/膜中に適した構造へ、CsAが自身の形をダイナミックに変えながら膜透過するモデルが提唱されていますが、実際の生体内では具体的にどのような構造をしているのか、膜水界面ではどうなのか等、原子レベルでの検証が求められていました。また、CsAにはシクロスポリンE (CsE)という代謝物が存在します。CsEとCsAとの構造の違いは、1つのアミノ酸がもつNメチル基の有無という1箇所のみです。しかしながら、1箇所のみの違いにもかかわらずCsAよりも10倍膜透過性が低いことが知られています。些細な構造の違いが、なぜ、膜透過性まで影響してしまうのか、その原因が明らかになれば、中分子医薬品の膜透過性デザインへつながると期待されます。本研究では、膜透過メカニズムに迫るために、CsAとCsEの水中・膜水界面・膜中における構造分布を、分子動力学シミュレーションによる大規模サンプリングによって明らかにしました。多くの動的な構造を得ることができるgREST法をスーパーコンピュータで実行することで、ダイナミックな分子の構造変化を捉えることができました。その結果、CsAでは、水中では開いた形、膜中では閉じた形をとることが多く、界面ではその両方の形が出現しやすいことがわかりました。CsEの構造分布では、特に、膜中の分布がCsAと大きく異なることもわかってきました。今後は、膜透過シミュレーションへ展開し、分子の形が変化していく途中の様子まで明らかにしていきたいと思います。
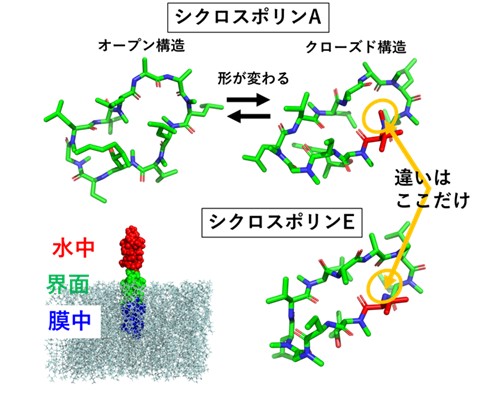
Cyclosporin A (CsA) is a naturally derived cyclic peptide used as an immunosuppressant drug. CsA has high cell-membrane permeability despite its large molecular size. In addition, compared to cyclosporin E (CsE), which is a metabolite of CsA, CsA has 10 times higher membrane permeability than CsE, although the only difference between them is in one amino acid: N-methylated VAL in CsA just changes to VAL in CsE [1]. To understand the mechanism of the membrane permeation of CsA and the difference in the membrane permeability between CsA and CsE, structural samplings during the membrane permeation event were executed using all-atom conventional molecular dynamics (cMD) simulations and the generalized replica-exchange with solute tempering (gREST) simulations [2]. In cMD simulations, several initial structures of CsA or CsE embedded in the membrane-water systems were used. Although no membrane-permeation events occurred during the timescale of several micro-seconds, we found that CsA and CsE tended to be located at the regions of lipid tail groups. In addition to the open and closed forms that observed in crystal structure, intermediate forms were also sampled during the cMD simulations. To further sample the structural distribution of CsA, gREST simulations were performed with the center of mass of CsA fixed in water, at the membrane-water interface, and in the membrane near the lipid tail groups, which are characteristic locations found in the cMD results. In each location, the variety of conformations that CsA adopted was different, and the popular conformations appeared more frequently were also different. In water, the conformation of CsA showed a wide range of the structural distribution from open to closed-like forms. By contrast, in the interface and membrane, the variety of the conformation was restricted to the closed-like form.
[1] Ahlbach L C, Lexa W K, Bockus T A, Chen V, Crews P, Jacobson P M, Lokey S R, Future Med. Chem. 7, 2121-30 (2015).
[2] Motoshi Kamiya, Yuji Sugita, J Chem Phys, 149, 072304 (2018).