2021.10.14
- プレスリリース
- 研究
- 理学部
世界初!微小管がメカノセンサーであることを実証 ~微小管の構造変化がモータータンパク質のダイナミクスを変調させることを解明~
研究のポイント
|
概要
横浜市立大学大学院生命医科学研究科の池口満徳教授,北海道大学大学院理学研究院のシエダ・ルバイヤ・ナスリン博士研究員,自然科学研究機構生命創成探究センターのクリスチャン・ガンサー特任助教,東京大学先端科学技術研究センターの山下雄史特任准教授,名古屋大学の内橋貴之教授(兼任 自然科学研究機構生命創成探究センター客員教授),北海道大学大学院理学研究院の角五 彰准教授らの研究グループは,細胞骨格である微小管*1が,力学ストレスを感知しモータータンパク質*2の運動性を変調するメカノセンサー*3として機能することを明らかにしました。
微小管は,細胞内では細胞骨格として機能するだけでなく,細胞活動に必要な物質を輸送するレールとしての役割も果たしています。物質輸送にはモータータンパク質であるキネシンやダイニンなどが関わり,微小管上を移動することで物質が運ばれます。このように様々な細胞活動に携わる微小管は常に力学的なストレスに晒されることになります。さらに微小管は最も剛直な細胞骨格でもあるため,力学ストレスの影響を真っ先に受けることになります。
そのため微小管は,力学的な情報を生化学的な情報へと変換するメカノセンサーとしても機能しているのではないかと考えられてきました。このような仮説を支持する実験結果もこれまでに幾つか報告されてきましたが,メカノセンサーとしての直接的な証拠は得られておりませんでした。
研究グループは,微小管のメカノセンサーとしての機能をモータータンパク質であるキネシンの運動性を高解像度の観察システムである高速原子間力顕微鏡*4を用いて分子レベルで解明しました。
その結果,微小管に沿って運動するキネシンは,微小管の屈曲等の構造的な変形により運動性を変化させるということを明らかにしました。また全原子分子動力学シミュレーション研究によって,運動速度を変化させる機構は,微小管の微小な構造変化がキネシンと微小管の結合親和性を変化させることによるものであることも明らかにしました。これらの結果は,微小管が,力学ストレスを感知しモータータンパク質の運動性を変調するメカノセンサーとして機能するという直接的な証拠であり,世界初の報告になります。
本研究成果は,日本時間2021年10月14日(木)公開のScience Advances誌に掲載されました。
微小管は,細胞内では細胞骨格として機能するだけでなく,細胞活動に必要な物質を輸送するレールとしての役割も果たしています。物質輸送にはモータータンパク質であるキネシンやダイニンなどが関わり,微小管上を移動することで物質が運ばれます。このように様々な細胞活動に携わる微小管は常に力学的なストレスに晒されることになります。さらに微小管は最も剛直な細胞骨格でもあるため,力学ストレスの影響を真っ先に受けることになります。
そのため微小管は,力学的な情報を生化学的な情報へと変換するメカノセンサーとしても機能しているのではないかと考えられてきました。このような仮説を支持する実験結果もこれまでに幾つか報告されてきましたが,メカノセンサーとしての直接的な証拠は得られておりませんでした。
研究グループは,微小管のメカノセンサーとしての機能をモータータンパク質であるキネシンの運動性を高解像度の観察システムである高速原子間力顕微鏡*4を用いて分子レベルで解明しました。
その結果,微小管に沿って運動するキネシンは,微小管の屈曲等の構造的な変形により運動性を変化させるということを明らかにしました。また全原子分子動力学シミュレーション研究によって,運動速度を変化させる機構は,微小管の微小な構造変化がキネシンと微小管の結合親和性を変化させることによるものであることも明らかにしました。これらの結果は,微小管が,力学ストレスを感知しモータータンパク質の運動性を変調するメカノセンサーとして機能するという直接的な証拠であり,世界初の報告になります。
本研究成果は,日本時間2021年10月14日(木)公開のScience Advances誌に掲載されました。

概要図:屈曲した微小管のレールを走るモータータンパク質キネシン1分子の高速原子間力顕微鏡イメージ。 屈曲した微小管上ではキネシンは減速走行する。
背景
細胞の分化,発生,疾患などにおいて,力学的なストレスが大きな影響をもたらすことが近年の様々な研究から明らかとなってきています。例えば,無重力空間で活動する宇宙飛行士は重力によるストレスがなく筋肉や骨が衰えてしまうことが知られています。逆に脳などの軟組織に過度の力学的ストレスが印加されると,神経軸索の機能が不全となり,記憶や認知障害,アルツハイマー病などの発症に繋がる恐れがあります。
このような役割を果たしている力学的ストレスを感知する細胞内のセンサーであるメカノセンサーとしては,イオンなどの透過する開閉式のタンパク質や,細胞骨格の一つであるアクチンのような非開閉式のタンパク質の存在が知られています。
近年,最も剛直な細胞骨格であり,細胞の形態形成や細胞内物質輸送などにおいて重要な役割を果たしている「微小管」にも,メカノセンサーとして機能が備わっているのではないかという仮説を支持する研究結果が相次いで報告されてきました。
しかし,メカノセンサーであることの直接的な証拠や機構に関する知見は得られていませんでした。
このような役割を果たしている力学的ストレスを感知する細胞内のセンサーであるメカノセンサーとしては,イオンなどの透過する開閉式のタンパク質や,細胞骨格の一つであるアクチンのような非開閉式のタンパク質の存在が知られています。
近年,最も剛直な細胞骨格であり,細胞の形態形成や細胞内物質輸送などにおいて重要な役割を果たしている「微小管」にも,メカノセンサーとして機能が備わっているのではないかという仮説を支持する研究結果が相次いで報告されてきました。
しかし,メカノセンサーであることの直接的な証拠や機構に関する知見は得られていませんでした。
研究手法
研究グループは,微小管のメカノセンサーとしての機能を調べるため,モータータンパク質であるキネシンの運動性に着目しました。キネシンは人間のように細胞骨格である微小管上を二足歩行することが知られています。キネシンは細胞分裂や神経軸索などの細胞内物質輸送において重要な役割を果たすだけでなく,神経回路の形成や記憶・学習などの脳の機能,腫瘍形成の抑制などにも係わることが明らかになってきています。そこで,高解像度の観察システムである高速原子間力顕微鏡を用いて,キネシンの運動性を分子レベルで解明することとしました。
微小管は,ブタの脳細胞から精製したチューブリンを重合して得ました。キネシンは大腸菌により発現させ,カラム等で精製しました。次にマイカ表面に脂質二重膜を海島状に担持し,その表面に微小管を吸着させることで,微小管を屈曲させました。アデノシン三リン酸(ATP)存在下で屈曲した微小管に沿って移動するキネシンのダイナミクスは,蛍光顕微鏡ならびに高速原子間力顕微鏡を用いて解明しました。
力学ストレスがどのようにキネシンの運動性を変調しているのかを調べるため,微小管の構造変化が引き起こすキネシンとの相互作用への影響を,全原子分子動力学計算で解明しました。
微小管は,ブタの脳細胞から精製したチューブリンを重合して得ました。キネシンは大腸菌により発現させ,カラム等で精製しました。次にマイカ表面に脂質二重膜を海島状に担持し,その表面に微小管を吸着させることで,微小管を屈曲させました。アデノシン三リン酸(ATP)存在下で屈曲した微小管に沿って移動するキネシンのダイナミクスは,蛍光顕微鏡ならびに高速原子間力顕微鏡を用いて解明しました。
力学ストレスがどのようにキネシンの運動性を変調しているのかを調べるため,微小管の構造変化が引き起こすキネシンとの相互作用への影響を,全原子分子動力学計算で解明しました。
研究成果
上記の手法により研究グループは,微小管は圧縮,引っ張り,曲げなど力学的ストレスに応じて構造変化することで,微小管に沿って運動するモータータンパク質キネシンの運動速度を変化させることを明らかにしました。運動速度の変化は,変形の度合いに依存することも明らかにしました。
全原子分子動力学シミュレーション研究によって,この運動速度を変化させる機構は,微小管の微小な構造変化がキネシンと微小管の結合親和性を変化させることが原因であることも明らかにしました。
本研究結果は,微小管の構造変化がモータータンパク質のダイナミクスを変調させることを分子レベルで見出した世界初の報告となります。
全原子分子動力学シミュレーション研究によって,この運動速度を変化させる機構は,微小管の微小な構造変化がキネシンと微小管の結合親和性を変化させることが原因であることも明らかにしました。
本研究結果は,微小管の構造変化がモータータンパク質のダイナミクスを変調させることを分子レベルで見出した世界初の報告となります。
今後への期待
本研究では,微小管が細胞内物質輸送を調整するメカノセンサーとして機能しうるということを初めて実証しました。この成果は,1)細胞を取り巻く力学環境を研究対象としたバイオメカニクスやメカノバイオロジーなどの学術分野への波及効果や,2)細胞内物質輸送の障害に起因する神経疾患研究への波及効果や,3)力学センサーなどの開発を目指す材料科学分野なども含め様々な分野への波及効果が期待されます。
謝辞
本研究でのシミュレーションは,文部科学省「富岳」成果創出加速プログラム(hp200129、hp210172)を通じスーパーコンピュータ「富岳」/スーパーコンピュータTSUBAMEの計算資源の提供を受け,実施されました。
論文情報
論文名: Deformation of microtubules regulates translocation dynamics of kinesin
(微小管の変形がキネシンの並進運動ダイナミクスを変調する)
著者名: Syeda Rubaiya Nasrin1,Christian Ganser2,西川聖二3,Arif Md. Rashedul Kabir1, 佐田和己1,3,山下雄史4, 池口満徳5, 内橋貴之2,6, Henry Hess7, 角五 彰1,3(1北海道大学大学院理学研究院,2自然科学研究機構生命創成探究センター,3北海道大学大学院総合化学院,4東京大学先端科学技術研究センター,5横浜市立大学生命医科学研究科,6名古屋大学大学院理学研究科,7コロンビア大学医用生体工学部)。
雑誌名: Science Advances(米国科学振興協会(AAAS)が刊行するオープンアクセス雑誌)
DOI: 10.1126/sciadv.abf2211
公表日: 日本時間2021年10月14日(木)午前4時(米国東部時間2021年10月13日(水)午後2時)
(オンライン公開)
(微小管の変形がキネシンの並進運動ダイナミクスを変調する)
著者名: Syeda Rubaiya Nasrin1,Christian Ganser2,西川聖二3,Arif Md. Rashedul Kabir1, 佐田和己1,3,山下雄史4, 池口満徳5, 内橋貴之2,6, Henry Hess7, 角五 彰1,3(1北海道大学大学院理学研究院,2自然科学研究機構生命創成探究センター,3北海道大学大学院総合化学院,4東京大学先端科学技術研究センター,5横浜市立大学生命医科学研究科,6名古屋大学大学院理学研究科,7コロンビア大学医用生体工学部)。
雑誌名: Science Advances(米国科学振興協会(AAAS)が刊行するオープンアクセス雑誌)
DOI: 10.1126/sciadv.abf2211
公表日: 日本時間2021年10月14日(木)午前4時(米国東部時間2021年10月13日(水)午後2時)
(オンライン公開)
参考図
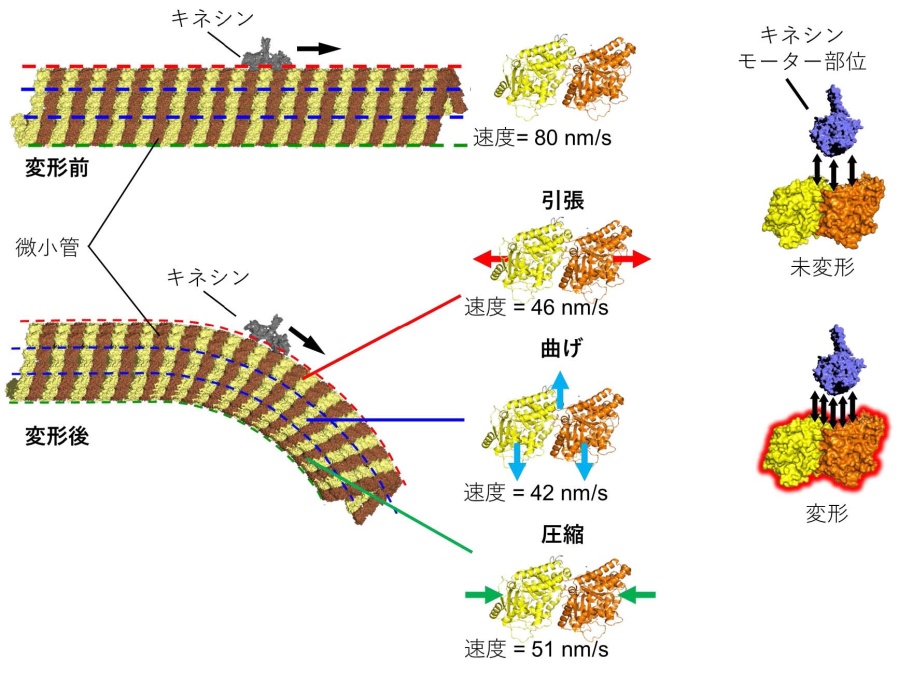 図 1. 圧縮,引っ張り,曲げなど力学的ストレスを受けて変形した微小管は,微小管に沿って運動するモータータンパク質キネシンの運動性を変調する。モータータンパク質キネシンの運動性の変調は,微小管の構造変化に伴う微小管‐キネシン間の親和性の変化によりもたらされる。
図 1. 圧縮,引っ張り,曲げなど力学的ストレスを受けて変形した微小管は,微小管に沿って運動するモータータンパク質キネシンの運動性を変調する。モータータンパク質キネシンの運動性の変調は,微小管の構造変化に伴う微小管‐キネシン間の親和性の変化によりもたらされる。
用語解説
*1 微小管 … 細胞中に存在する直径約25 nmの管状の構造体で,チューブリンと呼ばれるタンパク質からなる。細胞の形態を維持する骨格としての役割や,モータータンパク質による物質輸送のレールとしての機能など,様々な細胞活動に関わっている。
*2 モータータンパク質 … アデノシン三リン酸(ATP)の加水分解によって生じる化学エネルギーを 運動に変換するタンパク質。生物のほとんどすべての細胞に存在しており,物質の輸送や細胞分裂に 関わっている。アクチン上を動くミオシン,微小管上を動くキネシンやダイニンが知られている。 本研究では微小管とキネシンを使用。
*3 メカノセンサー … 力学的な情報を感知し,電気的なシグナルや化学的シグナルへ変換する素子。生体内にも力学的な情報を生化学的な情報へと変換するチャネルタイプのメカノセンサーが存在することが知られている。
*4 高速原子間力顕微鏡 … 柔らかい板バネの先に付いた針の先端で試料に触れ、試料の表面形状を可視化する顕微鏡。針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより、試料の表面形状を可視化する。試料の表面を高速(最速16フレーム/秒)にスキャンすることにより試料の動きを可視化することができる。
*2 モータータンパク質 … アデノシン三リン酸(ATP)の加水分解によって生じる化学エネルギーを 運動に変換するタンパク質。生物のほとんどすべての細胞に存在しており,物質の輸送や細胞分裂に 関わっている。アクチン上を動くミオシン,微小管上を動くキネシンやダイニンが知られている。 本研究では微小管とキネシンを使用。
*3 メカノセンサー … 力学的な情報を感知し,電気的なシグナルや化学的シグナルへ変換する素子。生体内にも力学的な情報を生化学的な情報へと変換するチャネルタイプのメカノセンサーが存在することが知られている。
*4 高速原子間力顕微鏡 … 柔らかい板バネの先に付いた針の先端で試料に触れ、試料の表面形状を可視化する顕微鏡。針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより、試料の表面形状を可視化する。試料の表面を高速(最速16フレーム/秒)にスキャンすることにより試料の動きを可視化することができる。