2020.03.12
- プレスリリース
- 研究
細胞記憶継承をDNA複製と協調するメカニズムの解明
~DNAメチル化酵素をDNA複製部位に正確に配置する新たな仕組み~
横浜市立大学大学院生命医科学研究科構造生物学研究室の有田恭平准教授、郡 聡実(博士後期課程1年)、横山 遥(生命医科学コース 2017年度卒業)と、東京大学医科学研究所癌防御シグナル分野の中西真教授、西山敦哉准教授、ミュンヘン大学Heinrich Leonhardt博士らの共同研究グループはDNAメチル化*1を制御する新たな仕組みを発見しました。
ヒトの体を形成する個々の細胞は全て同じ遺伝情報を持っていますが、各細胞の特性は大きく異なり、その数は300種類を超えると言われています。それぞれの細胞の特性は、DNAにおこる化学修飾であるDNAメチル化によって決まっています。DNAメチル化は細胞内の遺伝子の使い方を示す目印であり、細胞の記憶として働きます。細胞記憶として働くDNAメチル化が正確に継承されることは細胞の正常な増殖に必要ですが、その仕組みは明らかでありませんでした。
今回、共同研究グループはPAF15*2タンパク質のユビキチン化が、DNAメチル化の継承に重要であることを発見しました。さらに、PAF15がユビキチン化される仕組みや、その生物学的意義について示すことにも成功し、細胞の記憶が引き継がれていく基本的な原理を明らかにしました。
本研究の成果は、細胞記憶維持のメカニズムを明らかにしたとともに、新たなDNAメチル化酵素の阻害剤の開発など、この分野の応用にも大きく寄与するものと期待されます。
ヒトの体を形成する個々の細胞は全て同じ遺伝情報を持っていますが、各細胞の特性は大きく異なり、その数は300種類を超えると言われています。それぞれの細胞の特性は、DNAにおこる化学修飾であるDNAメチル化によって決まっています。DNAメチル化は細胞内の遺伝子の使い方を示す目印であり、細胞の記憶として働きます。細胞記憶として働くDNAメチル化が正確に継承されることは細胞の正常な増殖に必要ですが、その仕組みは明らかでありませんでした。
今回、共同研究グループはPAF15*2タンパク質のユビキチン化が、DNAメチル化の継承に重要であることを発見しました。さらに、PAF15がユビキチン化される仕組みや、その生物学的意義について示すことにも成功し、細胞の記憶が引き継がれていく基本的な原理を明らかにしました。
本研究の成果は、細胞記憶維持のメカニズムを明らかにしたとともに、新たなDNAメチル化酵素の阻害剤の開発など、この分野の応用にも大きく寄与するものと期待されます。
|
研究成果のポイント
|
研究の内容
DNAのメチル化はヒストン修飾とともに古くから知られるエピジェネティック修飾*5で、遺伝子発現制御をはじめ様々な生命現象に重要な役割を果たします。DNAメチル化は遺伝子発現のオン、オフを決めることで、細胞の特性を決める細胞記憶として働きます。従って、細胞増殖に伴うメチル化パターンの正確な継承は、その細胞の特性を維持するために不可欠であり、DNAが複製される際には、DNAメチル化パターンも同時に正確に継承される必要があります。この仕組みの破綻は異常な発生・分化に加えて、細胞のがん化や染色体不安定化を引き起こす原因となると考えられています。このような背景のもとDNAメチル化継承の分子機構の全貌を明らかにすることは重要な課題となっています。
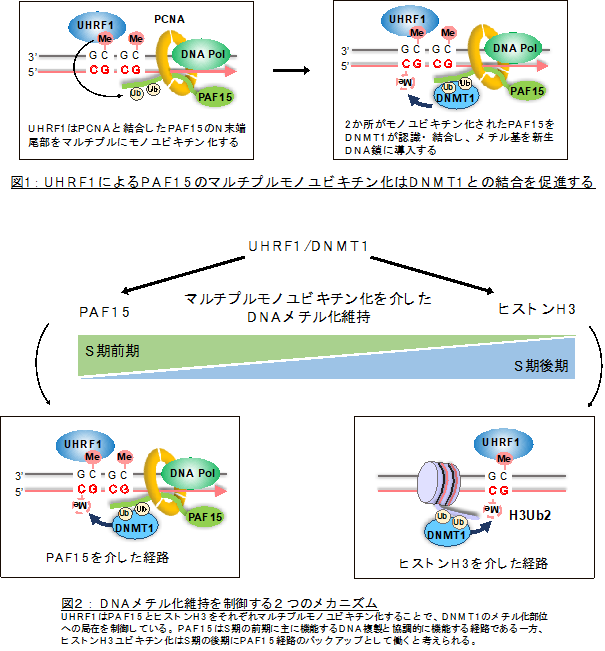
DNAメチル化継承にはDNAメチル化酵素DNMT1とUHRF1 (Ubiquitin-like containing PHD and Ring finger 1) *6 の二つのタンパク質が重要な働きをしています。UHRF1は複製時に一時的に生じる片鎖メチル化DNAに特異的に結合するタンパク質で、DNMT1のDNAメチル化部位局在に不可欠な役割を果たします。これまでにUHRF1を介したヒストンH3*7 のマルチプルモノユビキチン化 *8が、DNMT1によるDNAメチル化継承に重要であることが分かっていましたが、DNMT1を複製装置に局在させるメカニズムや、UHRF1がそれをどのように制御するのかは明らかでありませんでした。
今回、研究グループはアフリカツメガエルの未受精卵の抽出液に脱膜処理をした精子の核を加えた無細胞系を用いました。この実験系は、通常細胞内でしか起こらない染色体の複製を試験管内で再現することが可能なので、生化学的な解析に優れています。この抽出液から得たDNMT1複合体を質量分析で網羅的に解析したところ、DNMT1と特異的に結合する因子としてPAF15を新たに発見しました。さらに、無細胞系を用いた詳細な解析の結果、PAF15がDNA複製時にPCNA *9を介して染色体に結合すること、UHRF1によってPAF15のN末ドメインに保存された2つのリジン残基がモノユビキチン化を受けることが、PAF15とDNMT1の相互作用に不可欠であることが分かりました。
また、通常時は染色体上のDNMT1のほとんどはユビキチン化PAF15と結合していましたが、ヒストンH3のユビキチン化レベルの上昇やDNMT1とユビキチン化H3との相互作用がPAF15の機能阻害に伴い観察されました。このことは、PAF15のユビキチン化がDNMT1のDNAメチル化部位への局在を制御する主要経路であり、ヒストンH3のユビキチン化はバックアップシステムとして働いている可能性を示唆するものです。重要なことに、マウスES細胞において、PAF15のユビキチン化部位のアミノ酸に変異を導入したところ、ゲノム全体のDNAメチル化レベルが大きく低下し、PAF15がDNAメチル化維持を保証する因子であることが明らかとなりました。
さらに研究グループは、UHRF1によるPAF15のユビキチン化の分子機構を解明するために、大型放射光施設Photon Factoryの強力なX線源を用いてPAF15とUHRF1の複合体構造をX線結晶構造解析法で決定しました。その結果、PAF15のN末端配列が、UHRF1のもつPHDドメイン *10によって特異的に認識され、この相互作用がPAF15のユビキチン化に重要であることが分かりました。UHRF1のPHDドメインはヒストンH3のN末端配列も認識・結合することが知られており、UHRF1による基質認識に共通性があることが初めて明らかになりました。
DNAメチル化酵素は抗がん剤の作用点としても注目を集めており、本研究成果はDNAメチル化継承の新たなメカニズムを明らかとした学術的な意義に加えて、DNAメチル化酵素阻害剤の開発推進に大きく寄与する可能性を示しています。今後、PAF15を標的とする脱ユビキチン化酵素の探索、またDNMT1とユビキチン化PAF15/ヒストンH3の結合を阻害する小分子化合物のスクリーニングなど行うことにより、さらなる研究の発展を図る予定です。また、PAF15は様々ながん細胞で高発現していることが報告されており、PAF15の高発現がDNAメチル化制御に与える影響を明らかにすることは今後の重要な課題と考えられます。
DNAメチル化継承にはDNAメチル化酵素DNMT1とUHRF1 (Ubiquitin-like containing PHD and Ring finger 1) *6 の二つのタンパク質が重要な働きをしています。UHRF1は複製時に一時的に生じる片鎖メチル化DNAに特異的に結合するタンパク質で、DNMT1のDNAメチル化部位局在に不可欠な役割を果たします。これまでにUHRF1を介したヒストンH3*7 のマルチプルモノユビキチン化 *8が、DNMT1によるDNAメチル化継承に重要であることが分かっていましたが、DNMT1を複製装置に局在させるメカニズムや、UHRF1がそれをどのように制御するのかは明らかでありませんでした。
今回、研究グループはアフリカツメガエルの未受精卵の抽出液に脱膜処理をした精子の核を加えた無細胞系を用いました。この実験系は、通常細胞内でしか起こらない染色体の複製を試験管内で再現することが可能なので、生化学的な解析に優れています。この抽出液から得たDNMT1複合体を質量分析で網羅的に解析したところ、DNMT1と特異的に結合する因子としてPAF15を新たに発見しました。さらに、無細胞系を用いた詳細な解析の結果、PAF15がDNA複製時にPCNA *9を介して染色体に結合すること、UHRF1によってPAF15のN末ドメインに保存された2つのリジン残基がモノユビキチン化を受けることが、PAF15とDNMT1の相互作用に不可欠であることが分かりました。
また、通常時は染色体上のDNMT1のほとんどはユビキチン化PAF15と結合していましたが、ヒストンH3のユビキチン化レベルの上昇やDNMT1とユビキチン化H3との相互作用がPAF15の機能阻害に伴い観察されました。このことは、PAF15のユビキチン化がDNMT1のDNAメチル化部位への局在を制御する主要経路であり、ヒストンH3のユビキチン化はバックアップシステムとして働いている可能性を示唆するものです。重要なことに、マウスES細胞において、PAF15のユビキチン化部位のアミノ酸に変異を導入したところ、ゲノム全体のDNAメチル化レベルが大きく低下し、PAF15がDNAメチル化維持を保証する因子であることが明らかとなりました。
さらに研究グループは、UHRF1によるPAF15のユビキチン化の分子機構を解明するために、大型放射光施設Photon Factoryの強力なX線源を用いてPAF15とUHRF1の複合体構造をX線結晶構造解析法で決定しました。その結果、PAF15のN末端配列が、UHRF1のもつPHDドメイン *10によって特異的に認識され、この相互作用がPAF15のユビキチン化に重要であることが分かりました。UHRF1のPHDドメインはヒストンH3のN末端配列も認識・結合することが知られており、UHRF1による基質認識に共通性があることが初めて明らかになりました。
DNAメチル化酵素は抗がん剤の作用点としても注目を集めており、本研究成果はDNAメチル化継承の新たなメカニズムを明らかとした学術的な意義に加えて、DNAメチル化酵素阻害剤の開発推進に大きく寄与する可能性を示しています。今後、PAF15を標的とする脱ユビキチン化酵素の探索、またDNMT1とユビキチン化PAF15/ヒストンH3の結合を阻害する小分子化合物のスクリーニングなど行うことにより、さらなる研究の発展を図る予定です。また、PAF15は様々ながん細胞で高発現していることが報告されており、PAF15の高発現がDNAメチル化制御に与える影響を明らかにすることは今後の重要な課題と考えられます。
用語説明
*1 DNAメチル化
DNAのシトシンの炭素原子にメチル基 (-CH3) が共有結合で付加される化学反応。メチル化されたDNAはメチル化DNA結合タンパク質を呼び込み、遺伝子発現の抑制など様々な生命現象に重要な役割を果たす。DNAメチル化の仕組みの破綻は、細胞のがん化や染色体不安定を引き起こす原因となると考えられている。
*2 PAF15
PCNA-associated factor 15の略称。DNA複製因子であるPCNAと相互作用することや、がん細胞で高発現を示すことが分かっていたが、その機能や制御については不明であった。今回、UHRF1によってユビキチン化されることで、DNMT1と相互作用する新たなDNAメチル化制御因子であることが明らかとなった。
*3 ユビキチン化修飾
ユビキチンは76アミノ酸からなる小型のタンパク質で、基質となるタンパク質のリジン残基に共有結合で付加される。タンパク質のユビキチン化は、タンパク質の安定性や機能を大きく変化させるシグナルとして重要な役割を果たす。
*4 DNMT1
DNAメチル化酵素1の略称。非メチル化DNAをメチル化するDNMT3A/3Bに対して、DNMT1はDNA複製部位に特異的に局在し、DNA複製時に生じる片鎖メチル化DNAを好んでメチル化する活性を持つ。
*5 エピジェネティック修飾
DNAおよびその足場として働くヒストンタンパク質に起こる化学修飾であり、遺伝子発現のON、OFFを決めたり、特定のタンパク質を呼び寄せる目印として働く。近年、DNAの配列情報への直接的な変異と合わせて(突然変異)、エピジェネティック修飾の制御機構の破綻(エピジェネティック変異)が様々な疾患に関わることが明らかとなってきた。
*6 UHRF1
Ubiquitin-like containing PHD and Ring finger 1の略称。DNMT1をメチル化DNA部位に集積するために必要なタンパク質。片鎖メチル化DNAや特殊なヒストンの化学修飾状態を読み取ることで、DNAメチル化部位特異的に結合し、ヒストンH3をユビキチン化する役割を担うことが知られていたE3ユビキチン化酵素である。
*7 ヒストンH3
細胞内のDNAを巻き付けているヒストンタンパク質の一つ。UHRF1によってユビキチン化されると、DNMT1との結合能を獲得する。
*8 マルチプルモノユビキチン化
ユビキチン化には、ポリマー化ユビキチンが基質タンパク質に付加されるポリユビキチン化(タンパク質分解、DNA損傷応答、免疫応答におけるシグナルとして働く)と、1個のユビキチンが付加されるモノユビキチン化の2つの様式が存在する。その中でも、UHRF1によるユビキチン化は複数のリジン残基を標的としてモノユビキチン化するマルチプルモノユビキチン化であることが分かってきている。
*9 PCNA
DNA複製の中心的因子で、DNAポリメラーゼをはじめ様々なDNA複製因子と相互作用することが報告されている。
*10 PHDドメイン
UHRF1中央部に存在する機能ドメイン。UHRF1によるヒストンH3の認識やユビキチン化に必須であり、ヒストンH3のN末配列を読み取ることが分かっていた。
DNAのシトシンの炭素原子にメチル基 (-CH3) が共有結合で付加される化学反応。メチル化されたDNAはメチル化DNA結合タンパク質を呼び込み、遺伝子発現の抑制など様々な生命現象に重要な役割を果たす。DNAメチル化の仕組みの破綻は、細胞のがん化や染色体不安定を引き起こす原因となると考えられている。
*2 PAF15
PCNA-associated factor 15の略称。DNA複製因子であるPCNAと相互作用することや、がん細胞で高発現を示すことが分かっていたが、その機能や制御については不明であった。今回、UHRF1によってユビキチン化されることで、DNMT1と相互作用する新たなDNAメチル化制御因子であることが明らかとなった。
*3 ユビキチン化修飾
ユビキチンは76アミノ酸からなる小型のタンパク質で、基質となるタンパク質のリジン残基に共有結合で付加される。タンパク質のユビキチン化は、タンパク質の安定性や機能を大きく変化させるシグナルとして重要な役割を果たす。
*4 DNMT1
DNAメチル化酵素1の略称。非メチル化DNAをメチル化するDNMT3A/3Bに対して、DNMT1はDNA複製部位に特異的に局在し、DNA複製時に生じる片鎖メチル化DNAを好んでメチル化する活性を持つ。
*5 エピジェネティック修飾
DNAおよびその足場として働くヒストンタンパク質に起こる化学修飾であり、遺伝子発現のON、OFFを決めたり、特定のタンパク質を呼び寄せる目印として働く。近年、DNAの配列情報への直接的な変異と合わせて(突然変異)、エピジェネティック修飾の制御機構の破綻(エピジェネティック変異)が様々な疾患に関わることが明らかとなってきた。
*6 UHRF1
Ubiquitin-like containing PHD and Ring finger 1の略称。DNMT1をメチル化DNA部位に集積するために必要なタンパク質。片鎖メチル化DNAや特殊なヒストンの化学修飾状態を読み取ることで、DNAメチル化部位特異的に結合し、ヒストンH3をユビキチン化する役割を担うことが知られていたE3ユビキチン化酵素である。
*7 ヒストンH3
細胞内のDNAを巻き付けているヒストンタンパク質の一つ。UHRF1によってユビキチン化されると、DNMT1との結合能を獲得する。
*8 マルチプルモノユビキチン化
ユビキチン化には、ポリマー化ユビキチンが基質タンパク質に付加されるポリユビキチン化(タンパク質分解、DNA損傷応答、免疫応答におけるシグナルとして働く)と、1個のユビキチンが付加されるモノユビキチン化の2つの様式が存在する。その中でも、UHRF1によるユビキチン化は複数のリジン残基を標的としてモノユビキチン化するマルチプルモノユビキチン化であることが分かってきている。
*9 PCNA
DNA複製の中心的因子で、DNAポリメラーゼをはじめ様々なDNA複製因子と相互作用することが報告されている。
*10 PHDドメイン
UHRF1中央部に存在する機能ドメイン。UHRF1によるヒストンH3の認識やユビキチン化に必須であり、ヒストンH3のN末配列を読み取ることが分かっていた。
発表雑誌
雑誌名:「Nature communications」(2020年3月6日オンライン版)
論文タイトル: Two distinct modes of DNMT1 recruitment ensure stable maintenance DNA methylation
著者:
Atsuya Nishiyama*, Christopher B. Mulholland, Sebastian Bultmann, Satomi Kori, Akinori Endo, Yasushi Saeki, Weihua Qin, Carina Trummer, Yoshie Chiba, Haruka Yokoyama, Soichiro Kumamoto, Toru Kawakami, Hironobu Hojo, Genta Nagae, Hiroyuki Aburatani, Keiji Tanaka, Kyohei Arita*, Heinrich Leonhardt* and Makoto Nakanishi*(*corresponding author)
論文URL(オープンアクセス): https://www.nature.com/articles/s41467-020-15006-4
論文タイトル: Two distinct modes of DNMT1 recruitment ensure stable maintenance DNA methylation
著者:
Atsuya Nishiyama*, Christopher B. Mulholland, Sebastian Bultmann, Satomi Kori, Akinori Endo, Yasushi Saeki, Weihua Qin, Carina Trummer, Yoshie Chiba, Haruka Yokoyama, Soichiro Kumamoto, Toru Kawakami, Hironobu Hojo, Genta Nagae, Hiroyuki Aburatani, Keiji Tanaka, Kyohei Arita*, Heinrich Leonhardt* and Makoto Nakanishi*(*corresponding author)
論文URL(オープンアクセス): https://www.nature.com/articles/s41467-020-15006-4
問い合わせ先
(研究内容に関するお問合せ)
大学院生命医科学研究科 構造生物学
准教授 有田 恭平
TEL:045-508-7301 FAX: 045-508-7365
E-mail: aritak@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510
E-mail: kenkyupr@yokohama-cu.ac.jp
大学院生命医科学研究科 構造生物学
准教授 有田 恭平
TEL:045-508-7301 FAX: 045-508-7365
E-mail: aritak@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510
E-mail: kenkyupr@yokohama-cu.ac.jp