2020.02.27
- プレスリリース
- 研究
メディエーター複合体による新たな遺伝子発現制御機構の解明

~『Nature Communications』に掲載~
横浜市立大学大学院医学研究科 分子生物学分野の高橋 秀尚教授、北海道大学大学院医学研究院・生理系部門・生化学分野・医化学教室の畠山 鎮次教授、米国ストワーズ医学研究所のJoan Conaway教授らの研究グループは、メディエーター複合体*1のサブユニットMED26が、転写伸長因子複合体Super elongation complex(SEC)とLittle elongation complex(LEC)を異なる遺伝子領域へと呼び寄せ、 RNAポリメラーゼII*2(以下Pol IIと呼ぶ)による“ポリA”のあるmRNAと“ポリA”のないmRNAの合成(転写)をそれぞれ制御する機構を明らかにし、英科学誌Nature Communicationsに発表しました。
近年、メディエーター複合体は腫瘍性疾患や子宮筋腫、知能障害などのさまざまな疾患の発症に関与していることが明らかとなってきています。本研究でメディエーター複合体の新機能が解明されたことから、今後の関連疾患の発症メカニズムの解明も期待されます。
近年、メディエーター複合体は腫瘍性疾患や子宮筋腫、知能障害などのさまざまな疾患の発症に関与していることが明らかとなってきています。本研究でメディエーター複合体の新機能が解明されたことから、今後の関連疾患の発症メカニズムの解明も期待されます。
研究成果のポイント
|
研究の背景
DNAからなる遺伝子は、Pol IIという酵素によってRNAに情報が写し取られ(転写)、RNAの成熟化を経て、伝令RNA(messenger RNA: mRNA)が合成されます。さらにmRNAの情報がタンパク質に変換(翻訳)されることによって、遺伝子は機能を発揮します。
近年、ゲノムワイドな解析によって、非常に多くのヒトの遺伝子で、転写開始直後にPol IIが転写開始点から20~50塩基下流で一時停止していることが明らかになり、遺伝子発現の制御において転写開始の後のプロセス(転写伸長、転写終結)が非常に重要な役割を果たしていることがわかってきました。Pol IIの一時停止は、原がん遺伝子c-MycやFos、熱ショック遺伝子Hsp70において最初に発見されました。Pol IIの一時停止が解除されPol IIがRNAの合成を再開するためにはP-TEFbやELL/EAFなどの転写伸長因子の働きが必要です。これまでに、高橋教授らはメディエーター複合体と呼ばれる31種類のタンパク質から構成される転写複合体が、その構成因子のMED26によって、転写伸長因子を含む複合体“Super elongation complex(SEC)”をc-MycやHsp70などの遺伝子領域に呼び寄せ、それらの遺伝子の転写伸長を促進することを明らかにしました【Takahashi H, et al. Cell 2011】。さらに、高橋教授らはMED26に結合するもう一つの転写伸長因子複合体“Little elongation complex(LEC)”も同定し、MED26がLECを核内低分子RNA(small nuclear RNA: snRNA)などの遺伝子領域に呼び寄せ、転写伸長を促進することを明らかにしました【Takahashi H, et al. Nat Commun 2015】。
このように、高橋教授らはメディエーター複合体のサブユニットMED26が、2つの異なる転写伸長因子複合体“Super elongation complex”(SEC)と“Little elongation complex”(LEC)を、それぞれ異なる遺伝子領域に呼び寄せることによって、それらの遺伝子の転写伸長を促進することを解明してきました。しかし、なぜMED26がSECとLECを使い分け、遺伝子発現を制御するのかに関して、その機能的な意義に関しては不明でした。
近年、ゲノムワイドな解析によって、非常に多くのヒトの遺伝子で、転写開始直後にPol IIが転写開始点から20~50塩基下流で一時停止していることが明らかになり、遺伝子発現の制御において転写開始の後のプロセス(転写伸長、転写終結)が非常に重要な役割を果たしていることがわかってきました。Pol IIの一時停止は、原がん遺伝子c-MycやFos、熱ショック遺伝子Hsp70において最初に発見されました。Pol IIの一時停止が解除されPol IIがRNAの合成を再開するためにはP-TEFbやELL/EAFなどの転写伸長因子の働きが必要です。これまでに、高橋教授らはメディエーター複合体と呼ばれる31種類のタンパク質から構成される転写複合体が、その構成因子のMED26によって、転写伸長因子を含む複合体“Super elongation complex(SEC)”をc-MycやHsp70などの遺伝子領域に呼び寄せ、それらの遺伝子の転写伸長を促進することを明らかにしました【Takahashi H, et al. Cell 2011】。さらに、高橋教授らはMED26に結合するもう一つの転写伸長因子複合体“Little elongation complex(LEC)”も同定し、MED26がLECを核内低分子RNA(small nuclear RNA: snRNA)などの遺伝子領域に呼び寄せ、転写伸長を促進することを明らかにしました【Takahashi H, et al. Nat Commun 2015】。
このように、高橋教授らはメディエーター複合体のサブユニットMED26が、2つの異なる転写伸長因子複合体“Super elongation complex”(SEC)と“Little elongation complex”(LEC)を、それぞれ異なる遺伝子領域に呼び寄せることによって、それらの遺伝子の転写伸長を促進することを解明してきました。しかし、なぜMED26がSECとLECを使い分け、遺伝子発現を制御するのかに関して、その機能的な意義に関しては不明でした。
研究の内容
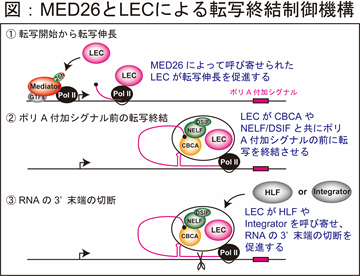
MED26によるSECとLECの使い分けの細胞機能における意義を追求すべく、さらなる解析を行ったところ、MED26はLECを核内低分子RNA遺伝子だけではなく、複製依存性ヒストン遺伝子*3領域にも呼び寄せることがわかりました。ここで、Pol IIによって合成されるほとんどのmRNAの末端には “ポリA”(ポリアデニル基)という配列が付加され(ポリアデニル化)、ポリAはmRNAを安定化する役割を果たすことが知られています。興味深いことに、SECが呼び寄せられるc-Myc遺伝子やHsp70遺伝子からは、Pol II によってポリAがあるmRNAが産生されますが、LECが呼び寄せられる複製依存性ヒストン遺伝子や核内低分子RNA遺伝子からは、ポリAのないmRNAが産生されることがわかっていました。このことから、MED26はLECを核内低分子RNA遺伝子や複製依存性ヒストン遺伝子領域に呼び寄せることによって、ポリAのないmRNAの産生に関わっている可能性が浮上しました。
詳細な解析を行ったところ、MED26によって呼び寄せられたLECは、核内低分子RNA遺伝子や複製依存性ヒストン遺伝子の転写終結領域において、転写終結を促進するようなDSIF/NELF複合体やCap-binding(CBCA)複合体を呼び寄せ、ポリA付加シグナル*4の前に転写を終結させることがわかりました。さらにLECは、Integrator複合体やHeat labile factor(HLF)複合体を呼び寄せ、複製依存性ヒストン遺伝子や核内低分子RNA遺伝子のRNAの3’ 末端部分を切断し、ポリAのないmRNAの産生を促進することがわかりました(図参照)。
これらの結果より、MED26はSECとLECを使い分けることによって、それぞれポリAのあるmRNAとポリAのないmRNAの合成を促進することが明らかとなりました。
詳細な解析を行ったところ、MED26によって呼び寄せられたLECは、核内低分子RNA遺伝子や複製依存性ヒストン遺伝子の転写終結領域において、転写終結を促進するようなDSIF/NELF複合体やCap-binding(CBCA)複合体を呼び寄せ、ポリA付加シグナル*4の前に転写を終結させることがわかりました。さらにLECは、Integrator複合体やHeat labile factor(HLF)複合体を呼び寄せ、複製依存性ヒストン遺伝子や核内低分子RNA遺伝子のRNAの3’ 末端部分を切断し、ポリAのないmRNAの産生を促進することがわかりました(図参照)。
これらの結果より、MED26はSECとLECを使い分けることによって、それぞれポリAのあるmRNAとポリAのないmRNAの合成を促進することが明らかとなりました。
今後の展開
興味深いことに、複製依存性ヒストン遺伝子のmRNAにポリAが付加されてしまうと、細胞周期のDNA複製期以降もmRNAが安定してしまい、ヒストンタンパク質が過剰に産生され、染色体の不安定性や腫瘍性疾患発症の引き金となることが明らかとなってきています。このようなことから、MED26とLECによるポリA付加の抑制機構の解明は、腫瘍性疾患の発症メカニズムのさらなる解明につながることが期待されます。
さらに、近年メディエーター複合体は腫瘍性疾患に加えて、子宮筋腫、知能障害、遺伝性疾患などのさまざまな疾患の発症メカニズムに関連していることがわかってきています。本研究によってメディエーター複合体の新たな転写制御機構が明らかとなり、今後、メディエーター複合体が関連する疾患の発症メカニズムの解明も期待されます。
さらに、近年メディエーター複合体は腫瘍性疾患に加えて、子宮筋腫、知能障害、遺伝性疾患などのさまざまな疾患の発症メカニズムに関連していることがわかってきています。本研究によってメディエーター複合体の新たな転写制御機構が明らかとなり、今後、メディエーター複合体が関連する疾患の発症メカニズムの解明も期待されます。
用語説明
*1 メディエーター複合体
メディエーター複合体は31種類のコンポーネントから構成されるタンパク質複合体で、RNAポリメラーゼIIによる転写の補助因子として重要な役割を果たします。
*2 RNAポリメラーゼII
遺伝子(DNA)の情報を基にRNAを合成する酵素で、Pol IIと呼ばれる。タンパク質をコードする全ての遺伝子とタンパク質をコードしないnon-coding RNA遺伝子もPol IIによって転写され、mRNAが合成されます。
*3 複製依存性ヒストン遺伝子
複製依存性ヒストン遺伝子は、細胞周期の複製期に転写・翻訳され、ヒストンタンパク質が産生されます。ヒストンタンパク質はDNAを細胞核内に染色体としてコンパクトに収納させる役割を果たします。
*4 ポリA付加シグナル
mRNAの末端に起こるポリA付加は、ポリA付加シグナル(代表的なポリA付加シグナルはAAUAAA配列)から10~30 塩基下流において生じます。
メディエーター複合体は31種類のコンポーネントから構成されるタンパク質複合体で、RNAポリメラーゼIIによる転写の補助因子として重要な役割を果たします。
*2 RNAポリメラーゼII
遺伝子(DNA)の情報を基にRNAを合成する酵素で、Pol IIと呼ばれる。タンパク質をコードする全ての遺伝子とタンパク質をコードしないnon-coding RNA遺伝子もPol IIによって転写され、mRNAが合成されます。
*3 複製依存性ヒストン遺伝子
複製依存性ヒストン遺伝子は、細胞周期の複製期に転写・翻訳され、ヒストンタンパク質が産生されます。ヒストンタンパク質はDNAを細胞核内に染色体としてコンパクトに収納させる役割を果たします。
*4 ポリA付加シグナル
mRNAの末端に起こるポリA付加は、ポリA付加シグナル(代表的なポリA付加シグナルはAAUAAA配列)から10~30 塩基下流において生じます。
※本研究は、『Nature Communications誌』に掲載されました。
掲載論文
The role of Mediator and Little Elongation Complex in transcription termination
*Takahashi H, Ranjan A, Chen S, Suzuki H, Shibata M, Hirose T, Hirose H, Sasaki K, Abe R, Chen K, He Y, Zhang Y, Takigawa I, Tsukiyama T, Watanabe M, Fujii S, Iida M, Yamamoto J, Yamaguchi Y, Suzuki Y, Matsumoto M, Nakayama I. K, Washburn P. M, Saraf A, Florens L, Sato S, Tomomori-Sato C, Conaway C.R, *Conaway W.J, *Hatakeyama S.
Nature Communications, DOI:10.1038/s41467-020-14849-1
*Takahashi H, Ranjan A, Chen S, Suzuki H, Shibata M, Hirose T, Hirose H, Sasaki K, Abe R, Chen K, He Y, Zhang Y, Takigawa I, Tsukiyama T, Watanabe M, Fujii S, Iida M, Yamamoto J, Yamaguchi Y, Suzuki Y, Matsumoto M, Nakayama I. K, Washburn P. M, Saraf A, Florens L, Sato S, Tomomori-Sato C, Conaway C.R, *Conaway W.J, *Hatakeyama S.
Nature Communications, DOI:10.1038/s41467-020-14849-1
※本研究は、文部科学省科学研究費補助金(高橋秀尚:15H04701, 16H06279, 17K19578, 18H02378, 19K22401)の研究費、ゲノム支援(221S0002)・先進ゲノム支援(16H06279)による支援、武田科学振興財団、寿原記念財団、高松宮妃癌研究基金、日本白血病研究基金、金原一郎記念医学医療振興財団、小野がん研究助成基金、小林がん学術振興会、MSD生命科学財団、内藤記念科学振興財団、上原記念生命科学財団、東京生化学研究会、横浜総合医学振興財団による助成金により行われました。
※本研究は、横浜市立大学大学院医学研究科 分子生物学 鈴木 秀文助教、廣瀬 智威講師、廣瀬 博子氏、佐々木 和教助教、阿部 竜太氏、ストワーズ医学研究所のAmol Ranjan博士、Shiyuan Chen博士、Kai Chen博士、Yanfeng He博士、Ying Zhang博士、Michael Washburn教授、Anita Saraf博士、Laurence Florens博士、佐藤 茂生博士、佐藤 チエリ博士、Ronald Conaway教授、京都大学大学院医学研究科・附属ゲノム医学センターの柴田 美音氏、北海道大学大学院医学研究院・生化学分野・医化学教室の築山 忠維助教、渡部 昌講師、九州工業大学・情報工学研究院の藤井 聡助教、飯田 緑博士、東京工業大学・生命理工学院の山口 雄輝教授、山本 淳一助教、東京大学大学院新領域創成科学研究科・メディカル情報生命専攻生命システム観測分野の鈴木 穣教授、北海道大学・化学反応創成研究拠点の瀧川 一学准教授、新潟大学・医歯学系・分子遺伝学分野の松本 雅記教授、九州大学生体防御医学研究所・分子医科学分野の中山 敬一教授のご協力を得て行われました。
※本研究は、横浜市立大学大学院医学研究科 分子生物学 鈴木 秀文助教、廣瀬 智威講師、廣瀬 博子氏、佐々木 和教助教、阿部 竜太氏、ストワーズ医学研究所のAmol Ranjan博士、Shiyuan Chen博士、Kai Chen博士、Yanfeng He博士、Ying Zhang博士、Michael Washburn教授、Anita Saraf博士、Laurence Florens博士、佐藤 茂生博士、佐藤 チエリ博士、Ronald Conaway教授、京都大学大学院医学研究科・附属ゲノム医学センターの柴田 美音氏、北海道大学大学院医学研究院・生化学分野・医化学教室の築山 忠維助教、渡部 昌講師、九州工業大学・情報工学研究院の藤井 聡助教、飯田 緑博士、東京工業大学・生命理工学院の山口 雄輝教授、山本 淳一助教、東京大学大学院新領域創成科学研究科・メディカル情報生命専攻生命システム観測分野の鈴木 穣教授、北海道大学・化学反応創成研究拠点の瀧川 一学准教授、新潟大学・医歯学系・分子遺伝学分野の松本 雅記教授、九州大学生体防御医学研究所・分子医科学分野の中山 敬一教授のご協力を得て行われました。
問い合わせ先
(内容に関するお問い合わせ)
医学群 分子生物学 教授 高橋 秀尚
TEL:045-787-2596 E-mail:hide0213@yokohama-cu.ac.jp
(取材対応窓口、資料請求等)
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510 E-mail:kenkyupr@yokohama-cu.ac.jp