2019.04.15
- プレスリリース
- 研究
乏突起膠腫(ぼうとっきこうしゅ)(オリゴデンドログリオーマ)の進展・悪性化の 機序と分子標的治療の効果をマウスモデルで解明
~米国癌学会誌 Clinical Cancer Researchに報告~
横浜市立大学学術院医学群 脳神経外科学 立石健祐助教、山本哲哉教授らの研究グループは、ヒト由来乏突起膠腫 (オリゴデンドログリオーマ)細胞株に対する独自の樹立経験と臨床情報をもとに、神経膠腫の一種であるオリゴデンドログリオーマの進展・悪性化には癌のシグナル伝達経路であるPI3キナーゼ経路の活性化につながる活性型遺伝子変異が関与することを見出しました。またこれらの遺伝子異常に対する分子標的治療が有効であることを、細胞、動物モデルを用いて明らかにしました。
本研究は国立がん研究センター研究所 脳腫瘍連携研究部門、横浜市立大学 微生物学、ニューヨーク大学、ハーバード大学等との共同研究で行われました。
本研究は国立がん研究センター研究所 脳腫瘍連携研究部門、横浜市立大学 微生物学、ニューヨーク大学、ハーバード大学等との共同研究で行われました。
|
研究成果のポイント
・ PI3キナーゼ経路の活性型変異がオリゴデンドログリオーマの進展、悪性化に重要な役割を果たすことを臨床情報とともに動物モデルを通じて明らかにした。
|
研究の背景
神経膠腫は脳腫瘍の中で高頻度に発生し、最も悪性度の高い神経膠芽腫から低悪性度神経膠腫まで広い疾患が含まれます。低悪性度神経膠腫は星細胞腫(アストロサイトーマ)と 乏突起膠腫(オリゴデンドログリオーマ)に大別され、後者は一般的に化学療法や放射線治療への感受性が高く、比較的予後良好な疾患とされています。しかし他の神経膠腫と同様、オリゴデンドログリオーマの多くは再発や悪性化などにより不幸な転機をたどることから、悪性化や腫瘍の進展につながる機序の解明は治療成績改善の観点からも極めて重要であると考えられてきました。
これまでの研究から、低悪性度神経膠腫の発生にはIDH1遺伝子変異の存在が極めて重要で、この遺伝子変異に伴うDNAやヒストンのメチル化が腫瘍発生に大きく関わることが知られています。また、TERTプロモーター領域の変異、染色体1番、19番の共欠失が加わるとオリゴデンドログリオーマが誘導されることも判明しています。更に、初発、再発の検体を用いた比較解析からは、PIK3CAをはじめとしたいくつかの遺伝子変異が再発時にみられることが明らかになっており、これらの遺伝子変異がオリゴデンドログリオーマの進展、悪性化に関わるドライバーである可能性が示唆されてきました。ただし、この仮説の立証には明確な根拠が必要で、特に動物モデルを通じた再現が重要と考えられてきました。
これまでにヒト由来神経膠腫細胞株の樹立は、我々の研究グループを含め世界の数多くの研究機関で試みてきました。これらの細胞株は患者さんの腫瘍の表現型、遺伝型を高レベルで再現することから、患者さんの病態を反映する再現性の高いモデルとして、腫瘍形成メカニズムや治療法の開発などの研究に活用されてきました。一般的に細胞株の樹立は患者さんの腫瘍の悪性度に依存する為、悪性度の高い神経膠腫(特に神経膠芽腫)ほど細胞株の樹立の可能性が高まります。一方でオリゴデンドログリオーマは比較的予後良好な疾患であることからも、臨床経過を反映するようにモデル樹立は極めて困難であり、その結果オリゴデンドログリオーマ細胞株を用いた研究成果もほとんど存在しません。このため、オリゴデンドログリオーマの病態には不明な点が数多く残っています。
これまでの研究から、低悪性度神経膠腫の発生にはIDH1遺伝子変異の存在が極めて重要で、この遺伝子変異に伴うDNAやヒストンのメチル化が腫瘍発生に大きく関わることが知られています。また、TERTプロモーター領域の変異、染色体1番、19番の共欠失が加わるとオリゴデンドログリオーマが誘導されることも判明しています。更に、初発、再発の検体を用いた比較解析からは、PIK3CAをはじめとしたいくつかの遺伝子変異が再発時にみられることが明らかになっており、これらの遺伝子変異がオリゴデンドログリオーマの進展、悪性化に関わるドライバーである可能性が示唆されてきました。ただし、この仮説の立証には明確な根拠が必要で、特に動物モデルを通じた再現が重要と考えられてきました。
これまでにヒト由来神経膠腫細胞株の樹立は、我々の研究グループを含め世界の数多くの研究機関で試みてきました。これらの細胞株は患者さんの腫瘍の表現型、遺伝型を高レベルで再現することから、患者さんの病態を反映する再現性の高いモデルとして、腫瘍形成メカニズムや治療法の開発などの研究に活用されてきました。一般的に細胞株の樹立は患者さんの腫瘍の悪性度に依存する為、悪性度の高い神経膠腫(特に神経膠芽腫)ほど細胞株の樹立の可能性が高まります。一方でオリゴデンドログリオーマは比較的予後良好な疾患であることからも、臨床経過を反映するようにモデル樹立は極めて困難であり、その結果オリゴデンドログリオーマ細胞株を用いた研究成果もほとんど存在しません。このため、オリゴデンドログリオーマの病態には不明な点が数多く残っています。
研究の内容と成果
本研究ではまずオリゴデンドログリオーマと診断された患者さんから得られた腫瘍検体を細胞処理後、腫瘍細胞を免疫不全マウスの脳内に移植(異種同所性モデル)して経過を長期間観察しました。非常に興味深いことに、同一の患者さんの別の再発部位から得られた検体をそれぞれマウス脳に移植したところ、1つの腫瘍は腫瘍形成せず、もう一方の腫瘍は脳腫瘍に伴う関連症状が早期に発現しました。
これら両検体を解析したところ、どちらも化学療法に伴う遺伝子変化がありましたが、マウスで腫瘍形成した方の腫瘍ではPIK3CA変異が検出されました。この変異は活性型変異で知られているコドン542に存在し、またマウスで形成された脳腫瘍からも同様の部位にPIK3CA変異が検出されました。一方、マウスで腫瘍を形成しなかった部位の腫瘍からは、PIK3CA変異を含めたPI3キナーゼ経路に関連する遺伝子異常は指摘されませんでした。
更に興味深いことに、マウスで脳腫瘍を形成しなかった部位の腫瘍はその後2年以上再発なく経過したのに対して、形成した部位の腫瘍は急速に再発を呈し、再発病変からもPIK3CA(コドン542)が検出されました。
腫瘍組織のPI3キナーゼ経路の活性化を評価するために、PI3キナーゼ経路に関連するAKT やmTOR下流のタンパク質のリン酸化を検討したところ、マウス脳腫瘍を形成した患者さんの腫瘍、マウス脳腫瘍ともに強いリン酸化像が観察されました。このことから、このPIK3CA遺伝子異常は悪性化に直接関連したものと推察されました。
次にPIK3CA変異などのPI3キナーゼ経路に関連する遺伝子異常のマウス脳腫瘍形成への関与を検証するため、研究者らは全14症例から得られたオリゴデンドログリオーマを免疫不全マウス脳内に移植しました。その結果、PIK3CA、PIK3R1, mTOR遺伝子の活性型変異を有する腫瘍では全例でマウス脳腫瘍を形成、一方これらの遺伝子異常が認められない腫瘍からは一例も腫瘍形成所見は観察されませんでした。興味深いことにデータベース上に登録されていないパッセンジャー変異(非活性型)のPIK3CA変異を有するオリゴデンドログリオーマでも同様に腫瘍形成は観察されませんでした。
また活性型変異を有さない腫瘍と比較して、活性型変異を有する腫瘍ではPI3キナーゼ経路の活性化につながるAKTのリン酸化などが亢進しており、同様の所見はマウス脳腫瘍でも認められました。これらの結果からPI3キナーゼの活性化を引き起こすタイプの遺伝子変異が加わることで腫瘍の進展や悪性化を引き起こすことが動物モデル及び臨床経過から明らかになりました。
重要な点として本研究グループはこの研究を通じて世界最多レベルの数のオリゴデンドログリオーマ細胞株を樹立することに成功しました。
さらに、PI3キナーゼ経路の活性型遺伝子変異を有するオリゴデンドログリオーマの治療効果を、今回樹立した細胞株で検討しました。従来の標準的な化学療法にはテモゾロミド(TMZ)あるいはプロカルバジン、ビンクリスチン、ロムスチン(日本ではニムスチン)によるPCV(PAV)併用療法が挙げられますが、まずTMZの感受性を調べたところPI3キナーゼ経路に関連する遺伝子異常はTMZの感受性に影響せず、既知の薬剤耐性機序として知られるMGMT遺伝子の非メチル化やミスマッチ修復遺伝子の変異が感受性に関わることが判明しました。
次いで薬剤併用療法の感受性について検討したところ、TMZが耐性の場合でもロムスチンやニムスチンといったアルキル化剤への高い反応性が認められました。この現象は細胞株の起源となる患者さんでも同様に確認されたことから、PI3キナーゼの活性化を引き起こす活性型の遺伝子変異はオリゴデンドログリオーマの標準治療剤への耐性にはつながらないことが明らかになりました。
また研究者らはこれまでにIDH1変異神経膠芽腫でNAD+合成酵素NAMPTの阻害が遺伝子変異特異的な治療法であり、上述のTMZとの併用により相乗効果が発揮されることも報告していますが (Tateishi K et al. Cancer Cell. 2015, Tateishi K et al. Cancer Res. 2017)、PIK3CA活性型変異を有したオリゴデンドログリオーマ細胞株(IDH1変異)でも同様の細胞毒性効果が発揮されることが判明しました。
さらに、PI3キナーゼ阻害剤やAKT阻害剤、mTOR阻害剤などのPI3キナーゼ経路に対する分子標的薬による薬剤効果は、PIK3CA活性型変異を有する細胞株でより強いことが明らかになりました。またPI3キナーゼ阻害剤の投与によりマウス脳腫瘍の形成が遅延することが判明しました。これらの結果より、PI3キナーゼの活性型変異を有するオリゴデンドログリオーマにおいても、従来の化学療法は有効であることが明らかになったとともに、化学療法後の再発時などに対しては分子標的治療やIDH1変異を標的とした治療法は将来の有力な治療法になりうることが示唆されました。
これら両検体を解析したところ、どちらも化学療法に伴う遺伝子変化がありましたが、マウスで腫瘍形成した方の腫瘍ではPIK3CA変異が検出されました。この変異は活性型変異で知られているコドン542に存在し、またマウスで形成された脳腫瘍からも同様の部位にPIK3CA変異が検出されました。一方、マウスで腫瘍を形成しなかった部位の腫瘍からは、PIK3CA変異を含めたPI3キナーゼ経路に関連する遺伝子異常は指摘されませんでした。
更に興味深いことに、マウスで脳腫瘍を形成しなかった部位の腫瘍はその後2年以上再発なく経過したのに対して、形成した部位の腫瘍は急速に再発を呈し、再発病変からもPIK3CA(コドン542)が検出されました。
腫瘍組織のPI3キナーゼ経路の活性化を評価するために、PI3キナーゼ経路に関連するAKT やmTOR下流のタンパク質のリン酸化を検討したところ、マウス脳腫瘍を形成した患者さんの腫瘍、マウス脳腫瘍ともに強いリン酸化像が観察されました。このことから、このPIK3CA遺伝子異常は悪性化に直接関連したものと推察されました。
次にPIK3CA変異などのPI3キナーゼ経路に関連する遺伝子異常のマウス脳腫瘍形成への関与を検証するため、研究者らは全14症例から得られたオリゴデンドログリオーマを免疫不全マウス脳内に移植しました。その結果、PIK3CA、PIK3R1, mTOR遺伝子の活性型変異を有する腫瘍では全例でマウス脳腫瘍を形成、一方これらの遺伝子異常が認められない腫瘍からは一例も腫瘍形成所見は観察されませんでした。興味深いことにデータベース上に登録されていないパッセンジャー変異(非活性型)のPIK3CA変異を有するオリゴデンドログリオーマでも同様に腫瘍形成は観察されませんでした。
また活性型変異を有さない腫瘍と比較して、活性型変異を有する腫瘍ではPI3キナーゼ経路の活性化につながるAKTのリン酸化などが亢進しており、同様の所見はマウス脳腫瘍でも認められました。これらの結果からPI3キナーゼの活性化を引き起こすタイプの遺伝子変異が加わることで腫瘍の進展や悪性化を引き起こすことが動物モデル及び臨床経過から明らかになりました。
重要な点として本研究グループはこの研究を通じて世界最多レベルの数のオリゴデンドログリオーマ細胞株を樹立することに成功しました。
さらに、PI3キナーゼ経路の活性型遺伝子変異を有するオリゴデンドログリオーマの治療効果を、今回樹立した細胞株で検討しました。従来の標準的な化学療法にはテモゾロミド(TMZ)あるいはプロカルバジン、ビンクリスチン、ロムスチン(日本ではニムスチン)によるPCV(PAV)併用療法が挙げられますが、まずTMZの感受性を調べたところPI3キナーゼ経路に関連する遺伝子異常はTMZの感受性に影響せず、既知の薬剤耐性機序として知られるMGMT遺伝子の非メチル化やミスマッチ修復遺伝子の変異が感受性に関わることが判明しました。
次いで薬剤併用療法の感受性について検討したところ、TMZが耐性の場合でもロムスチンやニムスチンといったアルキル化剤への高い反応性が認められました。この現象は細胞株の起源となる患者さんでも同様に確認されたことから、PI3キナーゼの活性化を引き起こす活性型の遺伝子変異はオリゴデンドログリオーマの標準治療剤への耐性にはつながらないことが明らかになりました。
また研究者らはこれまでにIDH1変異神経膠芽腫でNAD+合成酵素NAMPTの阻害が遺伝子変異特異的な治療法であり、上述のTMZとの併用により相乗効果が発揮されることも報告していますが (Tateishi K et al. Cancer Cell. 2015, Tateishi K et al. Cancer Res. 2017)、PIK3CA活性型変異を有したオリゴデンドログリオーマ細胞株(IDH1変異)でも同様の細胞毒性効果が発揮されることが判明しました。
さらに、PI3キナーゼ阻害剤やAKT阻害剤、mTOR阻害剤などのPI3キナーゼ経路に対する分子標的薬による薬剤効果は、PIK3CA活性型変異を有する細胞株でより強いことが明らかになりました。またPI3キナーゼ阻害剤の投与によりマウス脳腫瘍の形成が遅延することが判明しました。これらの結果より、PI3キナーゼの活性型変異を有するオリゴデンドログリオーマにおいても、従来の化学療法は有効であることが明らかになったとともに、化学療法後の再発時などに対しては分子標的治療やIDH1変異を標的とした治療法は将来の有力な治療法になりうることが示唆されました。
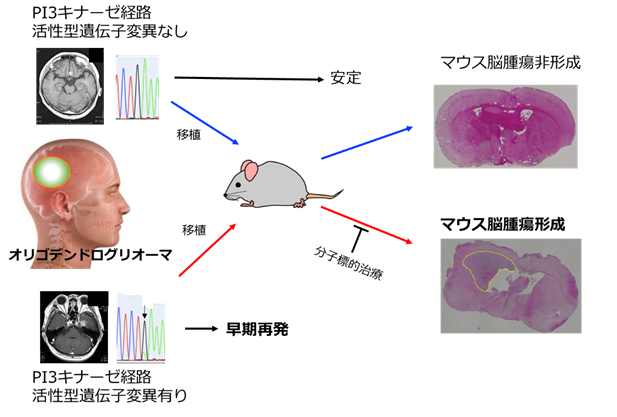
図: PI3 キナーゼ経路活性型遺伝子異常とマウス脳腫瘍形成能、及び臨床経過
今後の展開
本研究によりオリゴデンドログリオーマの進展・悪性化の一翼が明確に解明されたこと、同時にこれらの腫瘍に対する有効な治療法が見出されたことは、今後のオリゴデンドログリオーマの治療成績向上に寄与しうる研究成果と考えます。今回の知見を如何に臨床応用するか、今後さらに研究を進める必要があります。
※本研究は文部科学省科学研究費、高松宮妃癌研究基金、武田科学振興財団医学系研究助成、安田記念医学財団若手癌研究助成、がん集学的治療研究財団、横浜総合医学振興財団推進研究助成、SGH財団がん研究助成、ブリストル・マイヤーズスクイブ株式会社研究助成及び米国NIH 研究グラント (R01) からの助成を受けています。
※本研究は文部科学省科学研究費、高松宮妃癌研究基金、武田科学振興財団医学系研究助成、安田記念医学財団若手癌研究助成、がん集学的治療研究財団、横浜総合医学振興財団推進研究助成、SGH財団がん研究助成、ブリストル・マイヤーズスクイブ株式会社研究助成及び米国NIH 研究グラント (R01) からの助成を受けています。
掲載論文
PI3K/AKT/mTOR pathway alterations promote malignant progression and xenograft formation in oligodendroglial tumors
Kensuke Tateishi, Taishi Nakamura, Tareq A. Juratli, Erik A. Williams, Yuko Matsushita, Shigeta Miyake, Mayuko Nishi, Julie J. Miller, Shilpa S. Tummala, Alexandria L. Fink, Nina Lelic, Mara V. A. Koerner, Yohei Miyake, Jo Sasame, Kenji Fujimoto, Takahiro Tanaka, Ryogo Minamimoto, Shigeo Matsunaga, Shigeo Mukaihara, Takashi Shuto, Hiroki Taguchi, Naoko Udaka, Hidetoshi Murata, Akihide Ryo, Shoji Yamanaka, William T. Curry, Dora Dias-Santagata, Tetsuya Yamamoto, Koichi Ichimura, Tracy Batchelor, Andrew S Chi, A. John Iafrate, Hiroaki Wakimoto and Daniel P. Cahill
Clinical Cancer Research 2019, DOI: 10.1158/1078-0432.CCR-18-4144
Kensuke Tateishi, Taishi Nakamura, Tareq A. Juratli, Erik A. Williams, Yuko Matsushita, Shigeta Miyake, Mayuko Nishi, Julie J. Miller, Shilpa S. Tummala, Alexandria L. Fink, Nina Lelic, Mara V. A. Koerner, Yohei Miyake, Jo Sasame, Kenji Fujimoto, Takahiro Tanaka, Ryogo Minamimoto, Shigeo Matsunaga, Shigeo Mukaihara, Takashi Shuto, Hiroki Taguchi, Naoko Udaka, Hidetoshi Murata, Akihide Ryo, Shoji Yamanaka, William T. Curry, Dora Dias-Santagata, Tetsuya Yamamoto, Koichi Ichimura, Tracy Batchelor, Andrew S Chi, A. John Iafrate, Hiroaki Wakimoto and Daniel P. Cahill
Clinical Cancer Research 2019, DOI: 10.1158/1078-0432.CCR-18-4144
問い合わせ先
(本資料の内容に関するお問い合わせ)
学術院医学群 脳神経外科学 助教 立石 健祐
TEL:045-787-2663
E-mail: ktate12@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510 Fax : 045-787-2509
E-mail: kenkyupr@yokohama-cu.ac.jp
学術院医学群 脳神経外科学 助教 立石 健祐
TEL:045-787-2663
E-mail: ktate12@yokohama-cu.ac.jp
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510 Fax : 045-787-2509
E-mail: kenkyupr@yokohama-cu.ac.jp