2020.02.18
- プレスリリース
- 研究
ヘモグロビンによるガス分子運搬の直接観察に成功~PNASに掲載~
横浜市立大学大学院生命医科学研究科の朴三用教授、自治医科大学医学部生理学講座生物物理学部門の柴山修哉教授、英国Research Complex at Harwell の大木規央博士らの共同研究グループは、ヘモグロビンが酸素などのガス分子を自らの分子内で移動させる様子を独自の構造解析法で直接観察することに初めて成功しました。当研究は、赤血球中のヘモグロビンが酸素を迅速に受け渡しする仕組みの解明につながると期待され、その研究成果は米国科学アカデミー紀要 『PNAS』(Proceedings of the National Academy of Sciences of the United States of America)のオンライン版で公開発表されました。
概要
ヘモグロビンは血液中の酸素運搬タンパク質であり、肺で受け取った酸素を全身の細胞に届ける役割を担っています。ヘモグロビンは、世界で初めて原子レベルの立体構造が決定されたタンパク質の一つとして有名ですが、酸素などのガス分子がその結合部位である鉄から外部溶液へ出ていくまでの道筋や様子は今まで知られていませんでした。研究グループは、長年培ってきたヘモグロビンの結晶化技術と低温X線結晶解析法およびレーザー光解離法*1を組み合わせて、ヒトのヘモグロビンから切り離された後のガス分子の動きを原子レベルで追跡することに世界で初めて成功しました。
本研究成果は、文部科学省科学研究費助成事業で採択されている研究(基盤研究(C)「働く最中のヘモグロビン分子内動態の原子レベル追跡」研究代表者:自治医科大学医学部 柴山修哉)(新学術領域研究「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用」研究代表者:横浜市立大学 朴三用)により得られた成果です。
本研究成果は、文部科学省科学研究費助成事業で採択されている研究(基盤研究(C)「働く最中のヘモグロビン分子内動態の原子レベル追跡」研究代表者:自治医科大学医学部 柴山修哉)(新学術領域研究「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用」研究代表者:横浜市立大学 朴三用)により得られた成果です。
研究成果について
ヘモグロビンは、αサブユニットとβサブユニットを2個ずつ含む4量体(α2β2)であり(添付図1(中))、各サブユニット中に1個ずつ存在する鉄が酸素を脱着する仕組みになっています。酸素の4個結合したヘモグロビンのサブユニット配置と、酸素が完全に解離したときの配置の違いについてはX線結晶解析法でよく研究されており、その成果は広く知られています。しかし、未解決の問題も残されており、その一つが酸素などのガス分子の出入りです。結晶構造を見る限り、鉄は各サブユニットの内部に完全に埋もれており、酸素が外部溶液から鉄に至る通路は見当たりません。実際には、酸素はタンパク質の熱揺らぎ*2によって瞬間的に生じた隙間をぬって鉄に達すると考えられていますが、どこをどのように通っているのかがいまだ未解明でした。
今回、研究チームは、酸素(O2)と同等の性質を持つ一酸化炭素(CO)の結合したヒトのヘモグロビンの結晶をガスの付きやすいサブユニット配置(R状態*3)と付きにくい配置(T状態*3)の両方で作製し、光解離後のCOが各サブユニット内を移動する様子を低温下のX線結晶解析法で直接観察しました(添付図1(右))。αサブユニットとβサブユニットの見かけの立体構造はよく似ていますが、その運動部位は著しく異なりCOの通る道筋も異なることがわかりました。またT状態では、一般にガス分子のタンパク質内外への出入りが凍結されると考えられている-180℃付近の低温下においても、協調的なタンパク質の運動でガス分子を能動的にサブユニット外へ送り出していることがわかりました。この発見は、ヘモグロビンが酸素濃度の低い末梢組織でT状態に変化し、酸素をより迅速に外部へ供給する仕掛けを持っていることを示唆しており、生理学的に重要な意味を持つと考えられます。
今回、研究チームは、酸素(O2)と同等の性質を持つ一酸化炭素(CO)の結合したヒトのヘモグロビンの結晶をガスの付きやすいサブユニット配置(R状態*3)と付きにくい配置(T状態*3)の両方で作製し、光解離後のCOが各サブユニット内を移動する様子を低温下のX線結晶解析法で直接観察しました(添付図1(右))。αサブユニットとβサブユニットの見かけの立体構造はよく似ていますが、その運動部位は著しく異なりCOの通る道筋も異なることがわかりました。またT状態では、一般にガス分子のタンパク質内外への出入りが凍結されると考えられている-180℃付近の低温下においても、協調的なタンパク質の運動でガス分子を能動的にサブユニット外へ送り出していることがわかりました。この発見は、ヘモグロビンが酸素濃度の低い末梢組織でT状態に変化し、酸素をより迅速に外部へ供給する仕掛けを持っていることを示唆しており、生理学的に重要な意味を持つと考えられます。
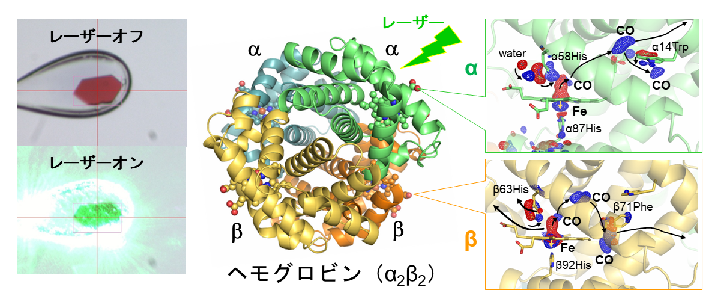
図1: COの結合したヘモグロビン結晶(T状態)のレーザー光解離とCO移動経路
(左)結晶の外観(温度は-178℃) 上:レーザー照射前 下:532 nm緑色パルスレーザー照射時
(中)リボンモデルで表現したヘモグロビン四量体
(右)光解離後のCOの動き 上:αサブユニット 下:βサブユニット
赤、青は、レーザー照射後に電子密度がそれぞれ減少、増加した領域を表す。
この情報からCOの動きを追跡できる。特にT状態では、COのサブユニット外部への放出も観察された。
(左)結晶の外観(温度は-178℃) 上:レーザー照射前 下:532 nm緑色パルスレーザー照射時
(中)リボンモデルで表現したヘモグロビン四量体
(右)光解離後のCOの動き 上:αサブユニット 下:βサブユニット
赤、青は、レーザー照射後に電子密度がそれぞれ減少、増加した領域を表す。
この情報からCOの動きを追跡できる。特にT状態では、COのサブユニット外部への放出も観察された。
用語解説
*1 レーザー光解離法:
O2、COなどのガス分子が結合したヘモグロビンにパルスレーザー光を当て、短時間でガスと鉄との結合を切り離す実験手法。
*2 熱揺らぎ:
物質を構成する分子や原子の平均位置からの無秩序な変動のこと。温度が高くなるほど変動は大きくなり、絶対零度に近づくと小さくなる。熱揺らぎのおかげでタンパク質を構成する原子は時々刻々とその位置を変えている。
*3 R状態とT状態:
ヘモグロビンは、環境に応じて自らのサブユニット配置を変え、目的に合わせてガスの付きやすさを調節している。酸素濃度の高い肺ではガスの付きやすい配置(R状態;緩んだという意味のRelaxedの略)が支配的であり、酸素濃度の低い末梢組織ではガスの付きにくい配置(T状態;張り詰めたという意味のTenseの略)が増加する。
O2、COなどのガス分子が結合したヘモグロビンにパルスレーザー光を当て、短時間でガスと鉄との結合を切り離す実験手法。
*2 熱揺らぎ:
物質を構成する分子や原子の平均位置からの無秩序な変動のこと。温度が高くなるほど変動は大きくなり、絶対零度に近づくと小さくなる。熱揺らぎのおかげでタンパク質を構成する原子は時々刻々とその位置を変えている。
*3 R状態とT状態:
ヘモグロビンは、環境に応じて自らのサブユニット配置を変え、目的に合わせてガスの付きやすさを調節している。酸素濃度の高い肺ではガスの付きやすい配置(R状態;緩んだという意味のRelaxedの略)が支配的であり、酸素濃度の低い末梢組織ではガスの付きにくい配置(T状態;張り詰めたという意味のTenseの略)が増加する。
発表雑誌
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
論文タイトル:Direct observation of ligand migration within human hemoglobin at work
著者:Naoya Shibayama*, Ayana Sato-Tomita, Mio Ohki, Kouhei Ichiyanagi, and Sam-Yong Park
(*Corresponding author)
PNAS https://www.pnas.org/cgi/doi/10.1073/pnas.1913663117
論文タイトル:Direct observation of ligand migration within human hemoglobin at work
著者:Naoya Shibayama*, Ayana Sato-Tomita, Mio Ohki, Kouhei Ichiyanagi, and Sam-Yong Park
(*Corresponding author)
PNAS https://www.pnas.org/cgi/doi/10.1073/pnas.1913663117
問い合わせ先
(内容に関するお問い合わせ)
大学院生命医科学研究科 教授 朴 三用
TEL:045-508-7229 E-mail:park@yokohama-cu.ac.jp
(取材対応窓口、資料請求等)
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510 E-mail:kenkyupr@yokohama-cu.ac.jp