2019.10.11
- プレスリリース
- 研究
グルタミン酸受容体の活性調節に重要な構造の変化を解明
~動きを指標とした脳神経疾患の新薬開発に期待~
『Structure』に掲載
横浜市立大学大学院生命医科学研究科 機能構造科学研究室の坂倉正義助教、高橋栄夫教授、理化学研究所の杉田有治主任研究員らの研究グループは、本学が有する高磁場核磁気共鳴(NMR)*1装置を用いることにより、AMPA型グルタミン酸受容体(AMPA受容体)の活性調節に重要な、リガンド結合ドメイン(LBD)*2の動きを検出することに成功しました。
研究成果のポイント
|
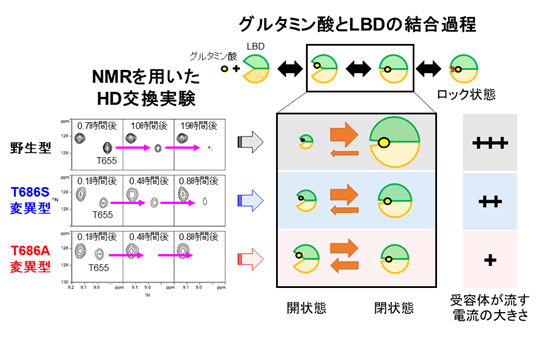
図1(左)NMRを用いて、活性の異なる3つのAMPA受容体LBDの構造比較を行った一例。HD交換実験の結果、655番目のスレオニン(T655)の水素結合が切れる速度が、変異型で増加していることが分かった。(右)グルタミン酸とLBDの結合過程の模式図。グルタミン酸が結合したLBDは、口が開いた状態(開状態)と、口が閉じた状態(閉状態)の間を行き来する。野生型では閉状態の割合が大きいが、変異に伴い開状態の割合が増加することが分かった。
研究の背景
AMPA型グルタミン酸受容体(AMPA受容体)は、脳における興奮性シナプス伝達を担う受容体であり、記憶の形成・維持などにおいて中心的に働くタンパク質です。また、AMPA受容体は、てんかん、アルツハイマー病、パーキンソン病など、多くの脳神経疾患に関与しており、薬剤の標的分子としても重要であると考えられています。
AMPA受容体は4つのサブユニットが合体した4量体として働き、各サブユニットは、N末端ドメイン(NTD)、リガンド結合ドメイン(LBD)、膜貫通ドメイン(TMD)の3つのドメインから成ります(図2)。興奮性神経伝達物質であるグルタミン酸がLBDに結合すると、昆虫がハエトリグサに捕まるときと同じように、開いていたLBDの口が閉じて、グルタミン酸が挟み込まれます。LBDの口が閉じると、その動きに連動してTMDにより構成されている細胞膜上のゲートが開き、細胞内にイオンが流れ込みます(図2)。
AMPA受容体は4つのサブユニットが合体した4量体として働き、各サブユニットは、N末端ドメイン(NTD)、リガンド結合ドメイン(LBD)、膜貫通ドメイン(TMD)の3つのドメインから成ります(図2)。興奮性神経伝達物質であるグルタミン酸がLBDに結合すると、昆虫がハエトリグサに捕まるときと同じように、開いていたLBDの口が閉じて、グルタミン酸が挟み込まれます。LBDの口が閉じると、その動きに連動してTMDにより構成されている細胞膜上のゲートが開き、細胞内にイオンが流れ込みます(図2)。
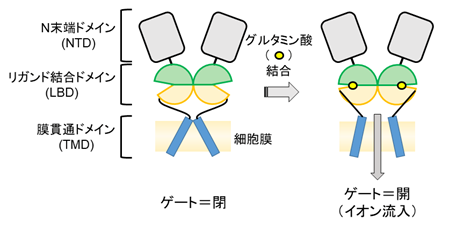
図2 AMPA受容体の構造と、グルタミン酸結合に伴うイオン流入のメカニズム。図の簡略化のため、AMPA受容体を構成する4つのサブユニットのうち、2つのみを表示した。
AMPA受容体に作用する薬の中には、グルタミン酸を作用させたときと比較して小さな電流しか流さない薬(部分アゴニストと呼ばれる)が存在します。これらの薬物がLBDに結合すると、LBDの口は完全には閉じず、少し開いた状態になります。一方、AMPA受容体を刺激したときに細胞に流れる電流の性質を詳しく調べた結果、TMDのゲートには、開いた状態と閉じた状態の二状態しかなく、中途半端に開かないことが明らかとなりました。従って、中程度の電流が流れるメカニズムは、ゲートが開く大きさでは説明できません。
LBD上に存在する686番目のスレオニン残基(T686)をセリンまたはアラニンに置換した変異体(以下それぞれT686S変異体、T686A変異体と呼ぶ)にグルタミン酸を作用させたときにも、T686S変異体、T686A変異体の順に、流れる電流が小さくなります。つまり、これらの変異体において、グルタミン酸は部分アゴニストとして働くと考えることができます。これらの変異体にグルタミン酸が結合したときのLBDの構造を調べると、野生型とほぼ同じ、口が閉じた構造をとっていることが分かりました。LBDの構造が同じなのに、なぜ流れる電流の大きさが異なるのか?この疑問に答えることができれば、AMPA受容体の部分活性化メカニズムの解明につながると考え、研究を行いました。
LBD上に存在する686番目のスレオニン残基(T686)をセリンまたはアラニンに置換した変異体(以下それぞれT686S変異体、T686A変異体と呼ぶ)にグルタミン酸を作用させたときにも、T686S変異体、T686A変異体の順に、流れる電流が小さくなります。つまり、これらの変異体において、グルタミン酸は部分アゴニストとして働くと考えることができます。これらの変異体にグルタミン酸が結合したときのLBDの構造を調べると、野生型とほぼ同じ、口が閉じた構造をとっていることが分かりました。LBDの構造が同じなのに、なぜ流れる電流の大きさが異なるのか?この疑問に答えることができれば、AMPA受容体の部分活性化メカニズムの解明につながると考え、研究を行いました。
研究の内容
先行研究では、X線結晶構造解析法により、結晶状態(=固められた状態)のLBDの構造が決定されています。我々は、AMPA受容体が機能する細胞環境に近い水溶液状態で、LBDの構造を比較したいと考え、核磁気共鳴法(NMR)を用いた構造解析を行いました。
先行研究によって、グルタミン酸とLBDの結合には3つの段階があり、第1段階では口が開いたLBDにグルタミン酸が結合し、第2段階では開いていたLBDの口が閉じ、第3段階では口が閉じたLBDに“鍵”がかかりロックされることが分かっています(図1)。各段階では特徴的な水素結合が形成されるため、これらの水素結合が切断される速度をHD交換法*3というNMR実験手法を用いて調べることにより、各段階の進みやすさ(平衡定数)を明らかにすることができます。本研究で我々は、野生型、T686S変異型、T686A変異型LBDのそれぞれについてHD交換実験を行い、チャネル活性に影響を及ぼす変異が、グルタミン酸結合のどの段階に影響を及ぼすのかを調べました(図1)。
この結果、T686変異は、結合の第2段階に影響を及ぼしており、野生型、T686S変異型、T686A変異型の順でLBDの口が閉まりにくくなっていることが明らかとなりました。この結果は、LBDの口が閉じることが、TMDのイオン透過ゲートを開く上で必要であることを示すと同時に、口が開いたり閉じたりしているLBDのうち、どのくらいの割合のLBDが口を閉じた状態でいるかが、流れる電流の大きさを決定づけており、口が閉じたLBDの割合が下がると流れる電流が小さくなることを示しています(図1)。
一方、HD交換実験の結果、野生型、変異型に関わらず、第3段階で生じたロック状態のLBDが最も安定で、存在比率が高いことが分かりました。NMRシグナルの共鳴位置(化学シフト)を解析し、ロック状態のLBDのどの部分が変異の影響を受けたか調べると、LBDの口の部分が変異の影響を大きく受けていることが分かりました(図3)。また、緩和分散法*4というNMR実験手法を用いてLBD分子内の動きを調べたところ、LBDの口が、1秒間に1,000~1,000,000回もの速さで、開いたり閉じたりしていることが分かりました。これらの結果から、野生型・T686変異型LBDの口の部分は、ロックがかかった状態でも、わずかに開いたり、閉じたりしており、野生型、T686S変異型、T686A変異型の順で閉状態の割合が少なくなっていくことが分かりました。変異体において、ロック状態のLBDの口が開きやすいことは、これらの変異型AMPA受容体が、脱感作*5しにくいことと関係している可能性が考えられます。
先行研究によって、グルタミン酸とLBDの結合には3つの段階があり、第1段階では口が開いたLBDにグルタミン酸が結合し、第2段階では開いていたLBDの口が閉じ、第3段階では口が閉じたLBDに“鍵”がかかりロックされることが分かっています(図1)。各段階では特徴的な水素結合が形成されるため、これらの水素結合が切断される速度をHD交換法*3というNMR実験手法を用いて調べることにより、各段階の進みやすさ(平衡定数)を明らかにすることができます。本研究で我々は、野生型、T686S変異型、T686A変異型LBDのそれぞれについてHD交換実験を行い、チャネル活性に影響を及ぼす変異が、グルタミン酸結合のどの段階に影響を及ぼすのかを調べました(図1)。
この結果、T686変異は、結合の第2段階に影響を及ぼしており、野生型、T686S変異型、T686A変異型の順でLBDの口が閉まりにくくなっていることが明らかとなりました。この結果は、LBDの口が閉じることが、TMDのイオン透過ゲートを開く上で必要であることを示すと同時に、口が開いたり閉じたりしているLBDのうち、どのくらいの割合のLBDが口を閉じた状態でいるかが、流れる電流の大きさを決定づけており、口が閉じたLBDの割合が下がると流れる電流が小さくなることを示しています(図1)。
一方、HD交換実験の結果、野生型、変異型に関わらず、第3段階で生じたロック状態のLBDが最も安定で、存在比率が高いことが分かりました。NMRシグナルの共鳴位置(化学シフト)を解析し、ロック状態のLBDのどの部分が変異の影響を受けたか調べると、LBDの口の部分が変異の影響を大きく受けていることが分かりました(図3)。また、緩和分散法*4というNMR実験手法を用いてLBD分子内の動きを調べたところ、LBDの口が、1秒間に1,000~1,000,000回もの速さで、開いたり閉じたりしていることが分かりました。これらの結果から、野生型・T686変異型LBDの口の部分は、ロックがかかった状態でも、わずかに開いたり、閉じたりしており、野生型、T686S変異型、T686A変異型の順で閉状態の割合が少なくなっていくことが分かりました。変異体において、ロック状態のLBDの口が開きやすいことは、これらの変異型AMPA受容体が、脱感作*5しにくいことと関係している可能性が考えられます。
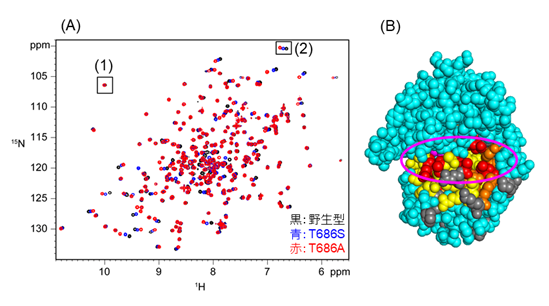
図3(A)野生型、T686S変異型、T686A変異型LBDのNMRスペクトルの重ね合わせ。1つの点がタンパク質を構成する1つのアミノ酸残基に対応する。(1)で示したシグナルは全てのLBDで重なっていることから、変異はこの残基に対して影響を及ぼさないことが分かる。一方(2)で示したシグナルは変異に伴い移動している(化学シフトが変化している)ことから、変異によりこの残基周辺の構造が変化したと考えられる。(B)LBDの立体構造を、T686A変異に伴う化学シフト変化の大きさで色分けした図。変化が大きい残基は、大きい順に赤、オレンジ、黄色で示されている。変化がなかった残基は青、解析から除外した残基はグレーで表示されている。ピンクで示した丸は、LBDの口に当たる領域を示す。
今後の展開
本研究の結果、LBDの形だけではなく、その動きがAMPA受容体の活性に影響することが明らかとなりました。これまでに作られた薬は、そのほとんどが、受容体とぴったり組み合わさることを指標として選ばれたものです。今後、LBDの動きを指標とした探索を行うことにより、新しい薬効を示す化合物が見つかる可能性が考えられ、本研究成果が、創薬研究に波及することが期待されます。
用語説明
*1 核磁気共鳴(法)(NMR):磁場中で原子核の共鳴信号を検出する分光学手法。原子ごとに共鳴信号の周波数がわずかに異なるため、原子ごとに個別の情報を取り出すことができる。タンパク質のような複雑な生体分子を解析する場合には、強力な磁場を発生させる大型NMR装置が有効となる。横浜市立大学は、日本で最も高い磁場を発生させる950 MHz NMR装置など、複数の高磁場NMR装置を保有しており、本研究ではこれらの装置を駆使して研究を行った。
*2 リガンド結合ドメイン(LBD):リガンド(AMPA受容体の場合はグルタミン酸など)が結合する最小の構造領域。この部分だけを取り出して実験を行うことができる。AMPA受容体のLBDは2個のサブドメイン(ローブ1、ローブ2)から成り、これらの2個のローブの境界面がグルタミン酸を挟みこむ口となる。
*3 HD交換法:溶媒を軽水(1H2O)から重水(2H2OまたはD2O)に置き換えた後、アミド基の水素(NH)など、溶媒中の水素と置き換わる性質を持った水素が、1Hから2Hへと変換されていく速度を解析する実験手法。NHが水素結合を形成すると、HD交換が阻害され、水素結合が切れると交換が進行する。
*4 緩和分散法:励起された原子核が元の状態に戻る速度(緩和速度)を解析することにより、原子核周りの分子構造が揺れ動く速度を測定する実験方法の一つ。分子の局所的な柔らかさを知ることができる。
*5 脱感作:グルタミン酸投与によりAMPA受容体が活性化され、電流が流れた後、引き続きグルタミン酸投与を続けても受容体のゲートが閉じ、電流が流れなくなる現象。隣り合った2個のLBDの配置変化により引き起こされる。
*2 リガンド結合ドメイン(LBD):リガンド(AMPA受容体の場合はグルタミン酸など)が結合する最小の構造領域。この部分だけを取り出して実験を行うことができる。AMPA受容体のLBDは2個のサブドメイン(ローブ1、ローブ2)から成り、これらの2個のローブの境界面がグルタミン酸を挟みこむ口となる。
*3 HD交換法:溶媒を軽水(1H2O)から重水(2H2OまたはD2O)に置き換えた後、アミド基の水素(NH)など、溶媒中の水素と置き換わる性質を持った水素が、1Hから2Hへと変換されていく速度を解析する実験手法。NHが水素結合を形成すると、HD交換が阻害され、水素結合が切れると交換が進行する。
*4 緩和分散法:励起された原子核が元の状態に戻る速度(緩和速度)を解析することにより、原子核周りの分子構造が揺れ動く速度を測定する実験方法の一つ。分子の局所的な柔らかさを知ることができる。
*5 脱感作:グルタミン酸投与によりAMPA受容体が活性化され、電流が流れた後、引き続きグルタミン酸投与を続けても受容体のゲートが閉じ、電流が流れなくなる現象。隣り合った2個のLBDの配置変化により引き起こされる。
掲載論文
Structural mechanisms underlying activity changes in an AMPA-type glutamate receptor induced by substitutions in its ligand-binding domain
Masayoshi Sakakura, Yumi Ohkubo, Hiraku Oshima, Suyong Re, Masahiro Ito, Yuji Sugita, and Hideo Takahashi
Structure(2019), https://doi.org/10.1016/j.str.2019.09.004
※本研究は、JSPS科学研究費(JP24790046、JP18H04626、JP18H05426、JP18H02393)、横浜市立大学基礎研究費、および理化学研究所パイオニアプロジェクト”Dynamic Structural Biology”の助成を受けて行われました。
Masayoshi Sakakura, Yumi Ohkubo, Hiraku Oshima, Suyong Re, Masahiro Ito, Yuji Sugita, and Hideo Takahashi
Structure(2019), https://doi.org/10.1016/j.str.2019.09.004
※本研究は、JSPS科学研究費(JP24790046、JP18H04626、JP18H05426、JP18H02393)、横浜市立大学基礎研究費、および理化学研究所パイオニアプロジェクト”Dynamic Structural Biology”の助成を受けて行われました。
問い合わせ先
(研究内容に関するお問い合わせ)
大学院生命医科学研究科 機能構造科学研究室
助教 坂倉正義
TEL:045-508-7215 E-mail:sakakura@yokohama-cu.ac.jp
教授 高橋栄夫
TEL:045-508-7213 E-mail:hidtak@yokohama-cu.ac.jp
(プレスリリースに関するお問い合わせ、取材対応窓口、資料請求等)
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510 E-mail:kenkyupr@yokohama-cu.ac.jp