2009.05.28
- プレスリリース
- 研究
~『欧州分子生物学機関誌EMBO J 』オンライン版(5月21日付)に掲載~
生命ナノシステム科学研究科の朴三用准教授(博士後期課程の杉山佳奈子氏・尾林栄治特任助教)の研究グループは、インフルエンザウイルスの複製に中心的な役割を果たしているRNAポリメラーゼのPB1-PB2サブユニット間の構造を原子レベルで解明しました。この研究は、2008年に同グループにより解明された構造(英国科学誌「Nature」発表)と合わせ、新規抗ウイルス剤開発実現へ前進した成果です。この成果は筑波大・永田恭介教授らの研究グループとの共同研究*1による成果です。
研究概要
メキシコで発生した新型インフルエンザは瞬く間に世界中に広がり、世界保健機関(WHO)による警報フェーズも5に引き上げられるなど(最高はフェーズ6)、世界的大流行の兆しを見せています。今回発生した新型インフルエンザは弱毒性であり、またタミフルが有効であることからその死亡率は高くないものの、いつこれが強毒型に変異を遂げるか、その脅威は想像に難くありません。特に最近、東南アジア諸国で家畜として飼われている豚の多くが強毒型鳥インフルエンザを保持していることが確認されており、今回の新型インフルエンザがこれらの豚に感染した際に新たな高病原性新型インフルエンザウイルスが産まれるのではないかと世界中で危惧されています。その対策として日本政府を含む世界の国々はタミフルの備蓄やプレパンデミックワクチンの作成を行ってきていますが、今回の新型インフルエンザに対してこれまでのワクチンが全く有効でなかったことなどから、実際にそのような高病原性新型ウイルスが出現した際のそれらの有効性は全く不透明であり、違った形での対策が世界中で求められています。
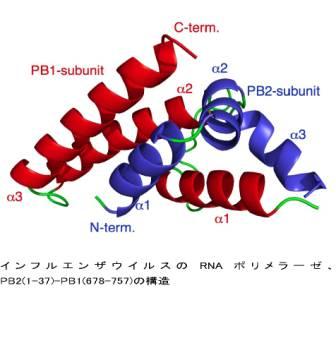
共同研究グループが構造を明らかにしたインフルエンザウイルスのRNAポリメラーゼは(A型 H1N1)、インフルエンザウイルスの複製(増殖)に中心的な役割を担っているため、その阻害剤は抗インフルエンザ薬として非常に高い有効性を示すことが予想されています。また、これまでの薬剤ターゲットとは異なり、RNAポリメラーゼは変異を起こしにくい特徴を持っていることから、鳥インフルエンザを含めどのタイプのインフルエンザが新型インフルエンザに変貌を遂げるのか予想が難しい中、理想的な薬剤ターゲットとなっています。共同研究グループは、インフルエンザウイルスのRNAポリメラーゼがPA、PB1、PB2と呼ばれる3つのサブユニットを持っており、その3つがそろってはじめてポリメラーゼとしての機能を示すことに注目し、その結合を阻害することによってウイルスの増殖を防ぐことができると考え、薬剤ターゲットとしてPB1とPB2の結合部位の立体構造解析(図)を行い、これに成功しました。さらに、明らかになった構造情報から、結合に重要な役割を果たしているアミノ酸を同定し、そのアミノ酸の変異によってポリメラーゼの活性が著しく低下することを確認しました。すでに同共同研究グループは、もう一つのサブユニット結合部位であるPA-PB1結合部位の構造を報告(英国科学誌「Nature」発表)しており、これら二つの構造の解明は、インフルエンザRNAポリメラーゼの特徴を理解するのに非常に重要であるだけでなく、これらのサブユニット間相互作用が、鳥インフルエンザウイルスをはじめとするインフルエンザウイルスに共通して存在するものであることから、本構造から設計される薬剤はどのタイプのインフルエンザウイルスにも作用する画期的な薬剤になると期待されます。
※ 本研究結果は、5月22日の朝日新聞、毎日新聞、産經新聞、日本経済新聞、日刊工業新聞に掲載されました。
*1 共同研究チーム
横浜市立大学大学院生命ナノシステム科学研究科
杉山佳奈子、尾林栄治、Jeremy Tame、朴三用
筑波大学大学院人間総合科学研究科(基礎医学系感染生物学)
川口敦史、鈴木ゆかり、永田恭介