2008.11.25
- プレスリリース
- 研究
-ドラッグデリバリーシステムに基づく新規がん治療法の確立を目指す-
横浜市立大学先端医科学研究センター・窪田吉信教授(くぼたよしのぶ・泌尿器病態学)らのグループは、体内投与可能なサブナノサイズの酸化チタンナノ粒子と超音波の外部エネルギーを組み合わせることで、標的となる腫瘍部位のみで選択的に薬効を発揮させることができる、ドラッグデリバリーシステム(DDS;薬物送達システム)に基づいた新規がん治療法の可能性を実証しました。この研究は、TOTO株式会社、神奈川歯科大学・李昌一教授(りまさいち・薬理学)との共同研究による成果であり、先端医科学研究センターが推進している研究開発プロジェクトの成果のひとつです。
研究概要
一般的にがん治療は、長期間にわたって繰り返し持続されるにつれ、治療やその副作用によって患者さんのQuality of Life(QOL;生活の質)を徐々に低下させてしまいます。そのため、このQOLが少しでも改善されるような、効果的な新規がん治療法の確立が望まれています。
本グループは、様々な化学反応を触媒・促進する酸化チタンとよばれる物質に着目しました。酸化チタンは紫外線を照射すると光触媒作用によって抗がん作用に寄与する活性酸素種を生成、強い酸化反応を引き起こすことが知られており、本グループではこれまで、これを応用して酸化チタン光触媒が抗がん作用を示すことを実証してきました。そして今回、がん部位へ選択的に集積する酸化チタンナノ粒子を開発し、集積後に超音波照射をすることで高い抗がん作用を示すことをモデルマウスで実証しました。
がん組織にある新生血管は正常組織の血管に比べて物質透過性が高いため、分子サイズの大きな高分子化合物ががん組織に透過・移行する効果が知られており、酸化チタンナノ粒子のサイズをうまくコントロールすることで腫瘍へ集積できると考えられます。そこで通常、生体内の環境で凝集してしまう酸化チタンナノ粒子の表面を親水性ポリマーであるポリエチレングリコールでコートし、50 nm程度で安定して分散させることに成功しました。この酸化チタンナノ粒子を蛍光標識して坦がんマウス(ヒト膀胱癌細胞T24)に尾静注投与すると、12時間後にはがん部位へ選択的に集積しました(図1)。
次に、酸化チタンナノ粒子に超音波照射を行うと、活性酸素種の生成が促進されることを特異的な蛍光プローブおよびESR法を用いて確認しました。そこで、坦がんマウス(ヒト膀胱癌細胞T24)に酸化チタンナノ粒子を尾静注投与し、がん部位に集積したタイミングで超音波照射を行い、腫瘍体積の推移を測定したところ、他のコントロール群に比べて抗がん作用が非常に高く、最終的には治療したすべてのマウスにおいて完全に退縮しました(図2)。
このDDS機能を有する酸化チタンナノ粒子と超音波照射による新規のがん治療を目指しますが、実現すると多くのがんに適応可能で、これまでよりも副作用が大幅に低減され、患者さんへの負担が少ない効果的な治療法を提供できるものと期待されます。
※本研究成果は、10月28日から30日まで名古屋市にて開催された日本癌学会で発表されました。
※本研究は、平成14~18年文部科学省科学研究費補助金、平成18~19年文部科学省科学研究費補助金、平成18~20年TOTO株式会社との共同研究費により行われています。
本グループは、様々な化学反応を触媒・促進する酸化チタンとよばれる物質に着目しました。酸化チタンは紫外線を照射すると光触媒作用によって抗がん作用に寄与する活性酸素種を生成、強い酸化反応を引き起こすことが知られており、本グループではこれまで、これを応用して酸化チタン光触媒が抗がん作用を示すことを実証してきました。そして今回、がん部位へ選択的に集積する酸化チタンナノ粒子を開発し、集積後に超音波照射をすることで高い抗がん作用を示すことをモデルマウスで実証しました。
がん組織にある新生血管は正常組織の血管に比べて物質透過性が高いため、分子サイズの大きな高分子化合物ががん組織に透過・移行する効果が知られており、酸化チタンナノ粒子のサイズをうまくコントロールすることで腫瘍へ集積できると考えられます。そこで通常、生体内の環境で凝集してしまう酸化チタンナノ粒子の表面を親水性ポリマーであるポリエチレングリコールでコートし、50 nm程度で安定して分散させることに成功しました。この酸化チタンナノ粒子を蛍光標識して坦がんマウス(ヒト膀胱癌細胞T24)に尾静注投与すると、12時間後にはがん部位へ選択的に集積しました(図1)。
次に、酸化チタンナノ粒子に超音波照射を行うと、活性酸素種の生成が促進されることを特異的な蛍光プローブおよびESR法を用いて確認しました。そこで、坦がんマウス(ヒト膀胱癌細胞T24)に酸化チタンナノ粒子を尾静注投与し、がん部位に集積したタイミングで超音波照射を行い、腫瘍体積の推移を測定したところ、他のコントロール群に比べて抗がん作用が非常に高く、最終的には治療したすべてのマウスにおいて完全に退縮しました(図2)。
このDDS機能を有する酸化チタンナノ粒子と超音波照射による新規のがん治療を目指しますが、実現すると多くのがんに適応可能で、これまでよりも副作用が大幅に低減され、患者さんへの負担が少ない効果的な治療法を提供できるものと期待されます。
※本研究成果は、10月28日から30日まで名古屋市にて開催された日本癌学会で発表されました。
※本研究は、平成14~18年文部科学省科学研究費補助金、平成18~19年文部科学省科学研究費補助金、平成18~20年TOTO株式会社との共同研究費により行われています。
研究成果のポイント
1.表面修飾によって生体投与に適した分散性の高い酸化チタンナノ粒子の作製に成功
2.酸化チタンナノ粒子は超音波照射時に抗がん作用に寄与する活性酸素種の生成を促進することを確認
3.マウスに静注投与した酸化チタンナノ粒子はがん部位に集積することを確認
4.集積後、超音波照射することで高い抗がん作用を示す
2.酸化チタンナノ粒子は超音波照射時に抗がん作用に寄与する活性酸素種の生成を促進することを確認
3.マウスに静注投与した酸化チタンナノ粒子はがん部位に集積することを確認
4.集積後、超音波照射することで高い抗がん作用を示す
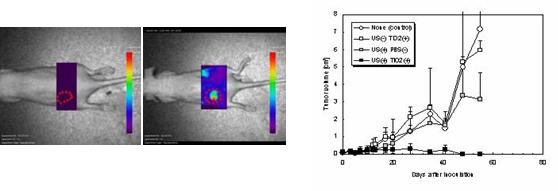
図1 蛍光イメージング像 |
図2 腫瘍体積の推移 |
|
図左は投与直後、図右は投与後12時間経過後。がん部位は図中の赤い点線部。他の正常部位に比べて強い蛍光強度を認め、酸化チタンナノ粒子はがん部位へ選択的に集積することが確認された。 |
酸化チタンナノ粒子と超音波照射との組み合わせ(図中US(+) TiO2(+) )において、他のコントロール群に比べ高い抗がん作用を示した。 (n=3, mean±SD) |