2008.04.14
- プレスリリース
- 研究
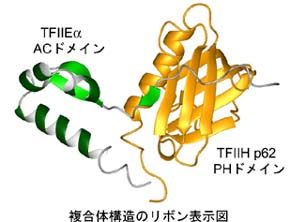
転写因子やテロメア結合タンパク質の立体構造をNMRを用いて決定し、構造に基づいて機能解析を行っている本学総合理学研究科 西村教授、奥田博士研究員と富山大学医学薬学研究部先端生命医療学域 大熊教授らの研究チームによる共同研究「Structural insight into the TFIIE /TFIIH interaction:TFIIE and p53 share the binding region on TFIIH(TFIIEとTFIIHの相互作用への構造的洞察:TFIIEとp53はTFIIH上の結合領域を共有する)」 が、欧州分子生物学機関誌EMBO Journalに掲載されました。

真核生物の転写にはRNAポリメラーゼIIのほかに5種類の基本転写子(TFIIB、TFIID、TFIIE、TFIIF、TFIIH)が必要である。これらの生体超分子の構造を解析することは発生、分化、老化、がん化など基本的な生命現象を分子レベルで解明するために不可欠である。TFIIEとTFIIHは協調しながら、転写の開始のみならず伸長段階への遷移においても重要な役割を果たすが、両者の相互作用の詳細は長い間不明であった。本研究では、TFIIEのαサブユニットの酸性(Acidic:AC)ドメインとTFIIHのp62サブユニットのプレクストリン相合(Pleckstrin homology:PH)ドメインが特異的に相互作用することを見出した。両者の複合体構造を核磁気共鳴(NMR)装置を用いて決定し認識の様子を詳しく調べたところ、興味深いことに、TFIIEαのACドメインのp62PHドメイン上の結合部位の一部が、がん抑制タンパク質p53や単純ヘルペスウィルスVP16の酸性転写活性化ドメインとの結合部位と重なり合うことが明らかになった。しかし、結合様式は全く異なっていた。機能解析を結果も踏まえ、p62のPHドメインの分子スイッチとしての可能性を提案した。