光駆動プロトンポンプにおける 重要な水素結合ネットワークを解明
2023.08.16
- TOPICS
- 研究
- 理学部
光照射NMR法で構造情報を得ることに成功
横浜市立大学大学院生命医科学研究科・機能構造科学研究室 鈴木里佳特任助教、廣西麗加さん(博士前期課程1年)、高橋栄夫教授らの研究グループは、理化学研究所・生命機能科学研究センター、千葉大学大学院理学研究院、岡山大学学術研究院医歯薬学域との共同研究により、好熱真正細菌*1由来の光駆動プロトンポンプ ロドプシンRxRが機能を発揮するうえでカギとなる、水素結合*2ネットワークを、核磁気共鳴(NMR)法*3により解明するとともに、光照射NMR法を活用することで、光反応中間体に関する構造情報を得ることに成功しました。本成果は、光遺伝学*4をはじめとする様々な生物工学的応用が期待されるロドプシンタンパク質の機能改変や安定化を進めていくうえで有用な知見であるとともに、光を活用した創薬研究への応用も期待されます。
本研究成果は、米国化学会誌「Journal of the American Chemical Society」に掲載されました(2023年7月6日オンライン公開)。
本研究成果は、米国化学会誌「Journal of the American Chemical Society」に掲載されました(2023年7月6日オンライン公開)。
研究成果のポイント
|
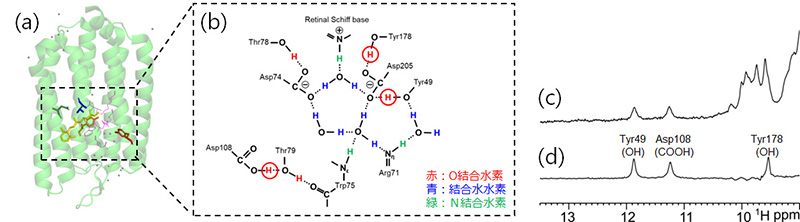
図1 (a) RxR活性部位周辺の水素結合ネットワーク [PDB: 6KFQ]、および (b) その模式図。本研究のNMR解析により検出された水素原子を赤丸で示している。(c) RxRの1H-NMRスペクトル(低磁場領域)と (d) 15N-filtered 1H-NMRスペクトル。ここで検出されているNMRシグナルは酸素原子に結合した水素由来のものであり、スペクトル上のシグナル帰属はアミノ酸置換体を活用して行った。
研究背景
ロドプシンは光を受容する膜タンパク質分子の総称であり、ヒトをはじめとする多様な生物種から見出されています。ロドプシン類は、その中心部分に光反応を担うレチナール色素が結合した共通構造をもっています。ロドプシン分子では、光を吸収するとレチナール色素の異性化反応が起き、その後に、タンパク質部分の構造変化が誘起され活性型となり、それぞれのロドプシンが有する多様な生物活性(イオンポンプ機能、イオンチャネル機能、走光性応答等)を発現することが知られています。特に細胞内から細胞外へのプロトンポンプとして機能する微生物型ロドプシンに関しては、微生物における光エネルギー変換機構において主要な役割を果たす存在として注目されています。さらに、ロドプシンを神経細胞に人為的に発現し、光依存的に神経興奮・抑制を引き起こす光遺伝学技術への応用1)、太陽光発電素子としての活用2)、光を利用した新しい創薬アプローチの開発3)等、応用研究が展開されており、ロドプシン分子の機能発現メカニズムの理解は、さまざまな光操作ツールの開発につながるものであるといえます。
研究内容
本研究では、好熱真正細菌Rubrobacter xylanophilus由来のプロトンポンプ ロドプシンRxRを研究対象として核磁気共鳴(NMR)法による解析を通し、プロトンポンプ機能発現に関わるRxRの構造的特徴を明らかにするとともに、その構造の維持に関与するアミノ酸残基の役割を理解することを目指した研究を行いました。
【RxRの活性部位における水素結合ネットワーク】
RxRの15N-filtered 1H-NMR測定を行ったところ、9.5~12ppmの低磁場領域に3つのNMRシグナルが観測されることが判明しました(図1 (d))。この結果は、水溶液中においては溶媒の水分子と速い交換を行うため1H-NMR測定では観測されることが珍しい、酸素に結合した水素(OH基、COOH基)が、RxRにおいて観測されたことを示しています。アミノ酸残基置換体を用いたNMR解析により、それらのシグナルは、レチナール近傍の水素結合ネットワーク(図1)に関与するTyr49、Tyr178のOH基、およびその近傍に存在するAsp108のCOOH基由来であることが明らかになりました。これらの残基は、RxRの活性部位近傍における水素結合ネットワーク内で、極めて安定性の高い水素結合を形成しており、RxRの活性部位の構造維持に重要と考えられました。実際に、Tyr49およびTyr178のPhe置換体は顕著なプロトンポンプ活性の低下を示すことが示されました。さらに、Asp74、Asp205というプロトンポンプ活性において重要な役割を果たす残基のAsn置換体においても、Tyr49およびTyr178のOH由来NMRシグナルは消失してしまうことが明らかになったことから、Tyr49、Tyr178を含む活性部位近傍の水素結合ネットワークの維持は、RxRのプロトンポンプとしての働きにおいて必要不可欠であることが判明しました。
【光照射NMRによる光反応中間体の検出と中間体における水素結合様式の変化】
RxRを含むプロトンポンプ ロドプシンは、光を吸収することで構造変化が誘起され活性化し、機能を発揮します。そこで、RxRの活性化状態を調べるために、私たちは光を照射した状態でのNMR測定を試みました。光を照射しながら行うNMR測定は研究グループの理研・長島氏らが開発した装置(図2)4)を活用することで実現可能となりました。光照射NMR測定の結果、先に検出した水素結合を形成していた水素由来のシグナル強度が減弱し、新たな光反応中間体に由来するシグナルが検出されました。この光照射NMR法で観測されたシグナルは約30ミリ秒の寿命の中間体であることから、光反応サイクルにおける後期中間体(O中間体)に由来することが判明しました。
さらに、NMR測定中に光照射のオン・オフを切り替える構造相関NMR(SC-NMR)測定を実施することで、レチナール近傍に存在するTrp75側鎖に由来するNMRシグナルが顕著な低磁場シフトすることが明らかとなり、後期中間体においてTrp75側鎖とAsp205側鎖の間で強い水素結合が形成されたことが示唆されました。また、光反応サイクルの解析により、このTrp75は効率的な後期中間体の形成に寄与し、光反応サイクルを円滑に進めるうえで重要な残基であることも示されました。
ロドプシンは光を受容する膜タンパク質分子の総称であり、ヒトをはじめとする多様な生物種から見出されています。ロドプシン類は、その中心部分に光反応を担うレチナール色素が結合した共通構造をもっています。ロドプシン分子では、光を吸収するとレチナール色素の異性化反応が起き、その後に、タンパク質部分の構造変化が誘起され活性型となり、それぞれのロドプシンが有する多様な生物活性(イオンポンプ機能、イオンチャネル機能、走光性応答等)を発現することが知られています。特に細胞内から細胞外へのプロトンポンプとして機能する微生物型ロドプシンに関しては、微生物における光エネルギー変換機構において主要な役割を果たす存在として注目されています。さらに、ロドプシンを神経細胞に人為的に発現し、光依存的に神経興奮・抑制を引き起こす光遺伝学技術への応用1)、太陽光発電素子としての活用2)、光を利用した新しい創薬アプローチの開発3)等、応用研究が展開されており、ロドプシン分子の機能発現メカニズムの理解は、さまざまな光操作ツールの開発につながるものであるといえます。
研究内容
本研究では、好熱真正細菌Rubrobacter xylanophilus由来のプロトンポンプ ロドプシンRxRを研究対象として核磁気共鳴(NMR)法による解析を通し、プロトンポンプ機能発現に関わるRxRの構造的特徴を明らかにするとともに、その構造の維持に関与するアミノ酸残基の役割を理解することを目指した研究を行いました。
【RxRの活性部位における水素結合ネットワーク】
RxRの15N-filtered 1H-NMR測定を行ったところ、9.5~12ppmの低磁場領域に3つのNMRシグナルが観測されることが判明しました(図1 (d))。この結果は、水溶液中においては溶媒の水分子と速い交換を行うため1H-NMR測定では観測されることが珍しい、酸素に結合した水素(OH基、COOH基)が、RxRにおいて観測されたことを示しています。アミノ酸残基置換体を用いたNMR解析により、それらのシグナルは、レチナール近傍の水素結合ネットワーク(図1)に関与するTyr49、Tyr178のOH基、およびその近傍に存在するAsp108のCOOH基由来であることが明らかになりました。これらの残基は、RxRの活性部位近傍における水素結合ネットワーク内で、極めて安定性の高い水素結合を形成しており、RxRの活性部位の構造維持に重要と考えられました。実際に、Tyr49およびTyr178のPhe置換体は顕著なプロトンポンプ活性の低下を示すことが示されました。さらに、Asp74、Asp205というプロトンポンプ活性において重要な役割を果たす残基のAsn置換体においても、Tyr49およびTyr178のOH由来NMRシグナルは消失してしまうことが明らかになったことから、Tyr49、Tyr178を含む活性部位近傍の水素結合ネットワークの維持は、RxRのプロトンポンプとしての働きにおいて必要不可欠であることが判明しました。
【光照射NMRによる光反応中間体の検出と中間体における水素結合様式の変化】
RxRを含むプロトンポンプ ロドプシンは、光を吸収することで構造変化が誘起され活性化し、機能を発揮します。そこで、RxRの活性化状態を調べるために、私たちは光を照射した状態でのNMR測定を試みました。光を照射しながら行うNMR測定は研究グループの理研・長島氏らが開発した装置(図2)4)を活用することで実現可能となりました。光照射NMR測定の結果、先に検出した水素結合を形成していた水素由来のシグナル強度が減弱し、新たな光反応中間体に由来するシグナルが検出されました。この光照射NMR法で観測されたシグナルは約30ミリ秒の寿命の中間体であることから、光反応サイクルにおける後期中間体(O中間体)に由来することが判明しました。
さらに、NMR測定中に光照射のオン・オフを切り替える構造相関NMR(SC-NMR)測定を実施することで、レチナール近傍に存在するTrp75側鎖に由来するNMRシグナルが顕著な低磁場シフトすることが明らかとなり、後期中間体においてTrp75側鎖とAsp205側鎖の間で強い水素結合が形成されたことが示唆されました。また、光反応サイクルの解析により、このTrp75は効率的な後期中間体の形成に寄与し、光反応サイクルを円滑に進めるうえで重要な残基であることも示されました。
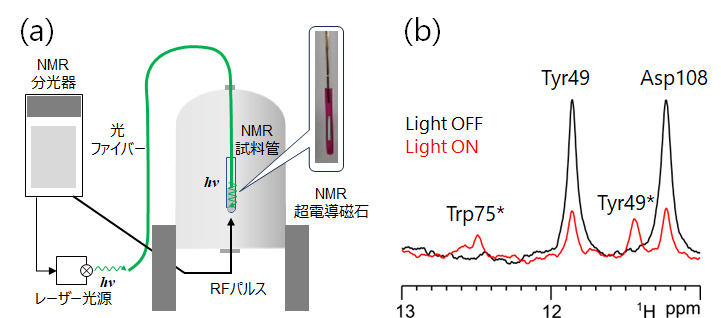
図2 (a) 光照射NMR装置の模式図。NMR装置のラジオ波パルスとレーザー光源による可視光を同調させて出力することが可能。(b) 光照射1H-NMR測定結果。黒色のスペクトルは光非照射(暗状態)のRxRのスペクトル、赤色のスペクトルは光照射(525nm/800mW, 124ミリ秒照射)状態におけるRxRのスペクトルを示している。アミノ酸残基番号の横の * 印は、光活性化状態でのみ観測されるNMRシグナルを示している。NMRシグナルの帰属はアミノ酸置換体および構造相関NMR(SC-NMR)測定により行った。
今後の展開
本研究におけるNMR解析を通し、ロドプシンのプロトンポンプ機能を推進するうえで重要な水素結合ネットワークに寄与するアミノ酸残基群、さらには、光反応中間体の生成に寄与するアミノ酸残基が明らかにされました。今後も光照射NMR法を活用することで、光反応中間体のより詳細な構造的特性が明らかになってくることが期待されます。このような機能発現に重要なアミノ酸残基の働きを理解することは、ロドプシンタンパク質の機能改変や安定化を進め、光学ツールとしてより多様な展開をしていくうえで重要な知見となります。
研究費
本研究は、JSPS科学研究費(JP18H05426、JP18H04626、JP18H02393)、横浜市立大学基礎研究費などの支援を受けて実施されました。
論文情報
タイトル:Nuclear Magnetic Resonance Detection of Hydrogen Bond Network in a Proton Pump Rhodopsin RxR and Its Alteration during the Cyclic Photoreaction
著者:Rika Suzuki, Toshio Nagashima, Keiichi Kojima, Reika Hironishi, Masafumi Hirohata, Tetsuya Ueta, Takeshi Murata, Toshio Yamazaki, Yuki Sudo, and Hideo Takahashi
掲載雑誌:Journal of the American Chemical Society
DOI:10.1021/jacs.3c02833
用語説明
*1好熱真正細菌:細胞はその構造的特徴により原核細胞と真核細胞に分類されるが、原核細胞はさらに真正細菌と古細菌に分類される。真正細菌の中で特に高温環境で生育できるものを好熱真正細菌と呼ぶ。本研究対象であるRxRが単離されたRubrobacter xylanophilusは、イギリスの絨毯工場で発見され、生育至適温度は60℃と報告されている。一般に好熱菌から単離されたタンパク質は安定性が高く、分子の機能・構造を詳細に解析することが可能となる。
*2 水素結合:酸素原子や窒素原子など電気陰性度(電子を吸引する性質)の高い原子と水素原子の間に働く非共有結合性の相互作用。水素結合は共有結合やイオン結合などに比べると弱い相互作用力だが、水分子の示す高い沸点など、物質の性質に大きな影響を与える相互作用である。特に、生体を構成するタンパク質分子の立体構造形成や、正確な遺伝子複製など、生命現象のカギを握る相互作用としても重要である。
*3 NMR(Nuclear Magnetic Resonance 核磁気共鳴):水素(1H)原子など原子核の中には磁気モーメントを有し、小さな磁石としての性質を有するものがある。それらの原子は、分子内の磁気的性質を有する他の原子と相互作用をする。NMR装置では、外部から強い磁場を与えた状態で磁気モーメントを有する原子を整列させた後、ラジオ波を照射し平衡状態からズラした際の応答を観測することで、研究対象とするタンパク質分子などを構成する原子間の化学結合様式や原子間距離、原子レベルの運動性、などに関する情報を得ることが可能となる。
*4 光遺伝学:光を使い高い時間・空間分解能で細胞機能を制御する技術。微生物型ロドプシンを神経細胞に発現させ、光依存的に神経興奮・抑制を引き起こす研究などが行われている。
参考文献
1) E. S. Boyden, F. Zhang, E. Bamberg, G. Nagel, and K. Deisseroth. Nat. Neurosci., 8, 1263-1268 (2005)
2) K. Kojima, A. Shibukawa, and Y. Sudo, Biochemistry, 59, 218-229 (2020)
3) S. Nakao, K. Kojima, and Y. Sudo, J. Am. Chem. Soc., 144, 3771–3775 (2022)
4) T. Nagashima, K. Ueda, C. Nishimura, and T. Yamazaki, Anal. Chem., 87, 11544-11552 (2015).
本研究におけるNMR解析を通し、ロドプシンのプロトンポンプ機能を推進するうえで重要な水素結合ネットワークに寄与するアミノ酸残基群、さらには、光反応中間体の生成に寄与するアミノ酸残基が明らかにされました。今後も光照射NMR法を活用することで、光反応中間体のより詳細な構造的特性が明らかになってくることが期待されます。このような機能発現に重要なアミノ酸残基の働きを理解することは、ロドプシンタンパク質の機能改変や安定化を進め、光学ツールとしてより多様な展開をしていくうえで重要な知見となります。
研究費
本研究は、JSPS科学研究費(JP18H05426、JP18H04626、JP18H02393)、横浜市立大学基礎研究費などの支援を受けて実施されました。
論文情報
タイトル:Nuclear Magnetic Resonance Detection of Hydrogen Bond Network in a Proton Pump Rhodopsin RxR and Its Alteration during the Cyclic Photoreaction
著者:Rika Suzuki, Toshio Nagashima, Keiichi Kojima, Reika Hironishi, Masafumi Hirohata, Tetsuya Ueta, Takeshi Murata, Toshio Yamazaki, Yuki Sudo, and Hideo Takahashi
掲載雑誌:Journal of the American Chemical Society
DOI:10.1021/jacs.3c02833
用語説明
*1好熱真正細菌:細胞はその構造的特徴により原核細胞と真核細胞に分類されるが、原核細胞はさらに真正細菌と古細菌に分類される。真正細菌の中で特に高温環境で生育できるものを好熱真正細菌と呼ぶ。本研究対象であるRxRが単離されたRubrobacter xylanophilusは、イギリスの絨毯工場で発見され、生育至適温度は60℃と報告されている。一般に好熱菌から単離されたタンパク質は安定性が高く、分子の機能・構造を詳細に解析することが可能となる。
*2 水素結合:酸素原子や窒素原子など電気陰性度(電子を吸引する性質)の高い原子と水素原子の間に働く非共有結合性の相互作用。水素結合は共有結合やイオン結合などに比べると弱い相互作用力だが、水分子の示す高い沸点など、物質の性質に大きな影響を与える相互作用である。特に、生体を構成するタンパク質分子の立体構造形成や、正確な遺伝子複製など、生命現象のカギを握る相互作用としても重要である。
*3 NMR(Nuclear Magnetic Resonance 核磁気共鳴):水素(1H)原子など原子核の中には磁気モーメントを有し、小さな磁石としての性質を有するものがある。それらの原子は、分子内の磁気的性質を有する他の原子と相互作用をする。NMR装置では、外部から強い磁場を与えた状態で磁気モーメントを有する原子を整列させた後、ラジオ波を照射し平衡状態からズラした際の応答を観測することで、研究対象とするタンパク質分子などを構成する原子間の化学結合様式や原子間距離、原子レベルの運動性、などに関する情報を得ることが可能となる。
*4 光遺伝学:光を使い高い時間・空間分解能で細胞機能を制御する技術。微生物型ロドプシンを神経細胞に発現させ、光依存的に神経興奮・抑制を引き起こす研究などが行われている。
参考文献
1) E. S. Boyden, F. Zhang, E. Bamberg, G. Nagel, and K. Deisseroth. Nat. Neurosci., 8, 1263-1268 (2005)
2) K. Kojima, A. Shibukawa, and Y. Sudo, Biochemistry, 59, 218-229 (2020)
3) S. Nakao, K. Kojima, and Y. Sudo, J. Am. Chem. Soc., 144, 3771–3775 (2022)
4) T. Nagashima, K. Ueda, C. Nishimura, and T. Yamazaki, Anal. Chem., 87, 11544-11552 (2015).