膜内薬物受容体に対する薬効をネイティブ質量分析により評価する実験系を構築
2023.07.05
- TOPICS
- 研究
- 理学部
構造エピゲノム科学研究室 明石グループ
横浜市立大学大学院生命医科学研究科 構造エピゲノム科学研究室 田尻道子特任助手らは、重要な創薬ターゲットタンパク質であるGタンパク質共役受容体(GPCR)の一つ、β2型アドレナリン受容体(β2AR)を、変性させずに質量分析(ネイティブ質量分析)することに成功しました。ネイティブ質量分析を用いてGPCRを観測することは極めて難しい実験であるため、これまで国内で報告はありませんでした。
そして、この手法をさらに発展させることで、β2ARに対するアゴニスト(作動薬)やアンタゴニスト(拮抗薬)の薬効を評価する実験系を、ネイティブ質量分析により構築することに世界で初めて成功しました。
研究成果のポイント
|
研究背景
Gタンパク質共役受容体(GPCR)は、細胞膜に存在しホルモンや神経伝達物質を含む様々なシグナルを受け取る受容体です。これまでに800種類を超えるヒトGPCRが同定され、そのうち160種類を超える数のGPCRが様々な疾患の重要な創薬ターゲットとなることが確認されています。GPCRの一つであるβ2型アドレナリン受容体(β2AR)は、アドレナリンと結合すると気管支や血管などの平滑筋を弛緩させる役割を担うタンパク質です。そのため、β2ARに対するアゴニスト(作動薬)は強心作用や気管支拡張作用を示し、一方、アンタゴニスト(拮抗薬)は、狭心症や不整脈の治療薬として利用されます。このβ2ARに対するアゴニストやアンタゴニストの薬効(efficacy)を調べる手法の一つとして、細胞を用いて、GPCRの活性化に伴い作られる環状アデノシン一リン酸(cAMP)を定量する方法が一般的に用いられています。この方法では、高感度分析をするために、放射性同位体で標識した試薬を用いた実験が行われます。研究グループでは、特別な標識を必要とせず、かつ微量試料で迅速に結果を得られる質量分析を利用し、β2ARのアゴニストやアンタゴニストの薬効を調べるためのプラットフォームの構築を目指して実験を行いました。
タンパク質を高感度で質量分析する際、一般には酸や有機溶媒を加えて変性させて質量分析装置に導入します。しかし、GPCRの機能を調べる目的で行う実験では、変性させてしまう一般的な質量分析手法は利用できません。そこで、GPCRを変性させずにそのまま質量分析する「ネイティブ質量分析」を用いた実験を行いました。膜タンパク質の中でも特に不安定なGPCRのネイティブ質量分析は、試料調製や質量分析装置のパラメータの調整が難しいため、国内では、これまでに報告例がありませんでした。
研究成果
膜タンパク質であるβ2ARは、組み換えタンパク質として調製した後、界面活性剤でミセル化して精製しました。そしてアゴニストおよびアンタゴニストと複合体を形成させ、ネイティブ質量分析を試みました。複合体を形成することで質量増加するので、結合の有無は質量分析で判断できます。しかしながら、一般的な薬剤は油に溶けやすい性質を持つため、質量分析計の中では複合体から薬剤が外れやすく、このことがβ2ARとの複合体の質量分析による観測を困難なものにしていました。研究グループでは、精製のための界面活性剤とネイティブ質量分析用の界面活性剤を使い分け、かつ質量分析のパラメータを最適化することで、油に溶けやすい性質を持つ薬剤とβ2ARとの複合体を観測することに世界で初めて成功しました。ただし、観測された複合体のイオン強度は弱く、薬効を議論することは困難だったため、薬剤と結合したβ2ARが相互作用するGタンパク質のインターフェースの形を模倣した人工タンパク質(mini-GsおよびNanobody80)との三者複合体を観測し、その複合体のイオンの相対強度から薬効評価をする戦略を試みました。すなわち、アゴニストの場合はmini-GsやNanobody80との複合体の形成が促進され、アンタゴニストの場合には複合体の形成が抑制されると予想して実験を行いました。その結果、ネイティブ質量分析で観測される、β2ARがmini-GsやNanobody80と形成する複合体の相対的なイオン強度は、予想した通り、活性化する能力の高いアゴニストほど高く、抑制する能力の強いアンタゴニストほど低いという結果となりました。そしてこの結果は、過去に細胞を用いて行われた放射性同位体標識したcAMPの濃度の定量による薬効評価の結果(Br J Pharmacol 2010, 160, 1048.)と矛盾しないことが分かりました(図1)。すなわち、ネイティブ質量分析を用いることで、β2ARのアゴニストやアンタゴニストの薬効の強さを調べられることを明らかにしました。
Gタンパク質共役受容体(GPCR)は、細胞膜に存在しホルモンや神経伝達物質を含む様々なシグナルを受け取る受容体です。これまでに800種類を超えるヒトGPCRが同定され、そのうち160種類を超える数のGPCRが様々な疾患の重要な創薬ターゲットとなることが確認されています。GPCRの一つであるβ2型アドレナリン受容体(β2AR)は、アドレナリンと結合すると気管支や血管などの平滑筋を弛緩させる役割を担うタンパク質です。そのため、β2ARに対するアゴニスト(作動薬)は強心作用や気管支拡張作用を示し、一方、アンタゴニスト(拮抗薬)は、狭心症や不整脈の治療薬として利用されます。このβ2ARに対するアゴニストやアンタゴニストの薬効(efficacy)を調べる手法の一つとして、細胞を用いて、GPCRの活性化に伴い作られる環状アデノシン一リン酸(cAMP)を定量する方法が一般的に用いられています。この方法では、高感度分析をするために、放射性同位体で標識した試薬を用いた実験が行われます。研究グループでは、特別な標識を必要とせず、かつ微量試料で迅速に結果を得られる質量分析を利用し、β2ARのアゴニストやアンタゴニストの薬効を調べるためのプラットフォームの構築を目指して実験を行いました。
タンパク質を高感度で質量分析する際、一般には酸や有機溶媒を加えて変性させて質量分析装置に導入します。しかし、GPCRの機能を調べる目的で行う実験では、変性させてしまう一般的な質量分析手法は利用できません。そこで、GPCRを変性させずにそのまま質量分析する「ネイティブ質量分析」を用いた実験を行いました。膜タンパク質の中でも特に不安定なGPCRのネイティブ質量分析は、試料調製や質量分析装置のパラメータの調整が難しいため、国内では、これまでに報告例がありませんでした。
研究成果
膜タンパク質であるβ2ARは、組み換えタンパク質として調製した後、界面活性剤でミセル化して精製しました。そしてアゴニストおよびアンタゴニストと複合体を形成させ、ネイティブ質量分析を試みました。複合体を形成することで質量増加するので、結合の有無は質量分析で判断できます。しかしながら、一般的な薬剤は油に溶けやすい性質を持つため、質量分析計の中では複合体から薬剤が外れやすく、このことがβ2ARとの複合体の質量分析による観測を困難なものにしていました。研究グループでは、精製のための界面活性剤とネイティブ質量分析用の界面活性剤を使い分け、かつ質量分析のパラメータを最適化することで、油に溶けやすい性質を持つ薬剤とβ2ARとの複合体を観測することに世界で初めて成功しました。ただし、観測された複合体のイオン強度は弱く、薬効を議論することは困難だったため、薬剤と結合したβ2ARが相互作用するGタンパク質のインターフェースの形を模倣した人工タンパク質(mini-GsおよびNanobody80)との三者複合体を観測し、その複合体のイオンの相対強度から薬効評価をする戦略を試みました。すなわち、アゴニストの場合はmini-GsやNanobody80との複合体の形成が促進され、アンタゴニストの場合には複合体の形成が抑制されると予想して実験を行いました。その結果、ネイティブ質量分析で観測される、β2ARがmini-GsやNanobody80と形成する複合体の相対的なイオン強度は、予想した通り、活性化する能力の高いアゴニストほど高く、抑制する能力の強いアンタゴニストほど低いという結果となりました。そしてこの結果は、過去に細胞を用いて行われた放射性同位体標識したcAMPの濃度の定量による薬効評価の結果(Br J Pharmacol 2010, 160, 1048.)と矛盾しないことが分かりました(図1)。すなわち、ネイティブ質量分析を用いることで、β2ARのアゴニストやアンタゴニストの薬効の強さを調べられることを明らかにしました。
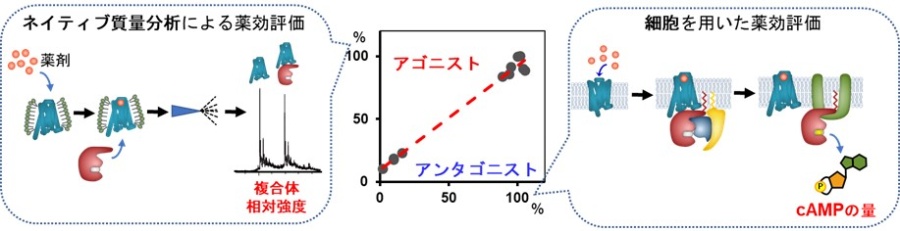 図1 ネイティブ質量分析による薬効評価と細胞を用いた薬効評価は正の相関を示した
図1 ネイティブ質量分析による薬効評価と細胞を用いた薬効評価は正の相関を示した
この方法は、迅速かつ微量試料で行え、かつ特殊な標識を必要としないという長所があります。この方法を他のGPCRに対して応用することで、その薬効評価を迅速に行うことが可能になると考えられます。
発表雑誌
論文タイトル:Evaluation of drug responses to human β2AR using native mass spectrometry.
著者: Tajiri M, Imai S, Konuma T, Shimamoto K, Shimada I, *Akashi S.
雑誌名:ACS Omega
doi: 10.1021/acsomega.3c02737
発表者:田尻 道子1, 今井 俊輔2, 小沼 剛1、島本 啓子3、嶋田 一夫2,4、明石 知子1⇒Research map
研究分野:構造生物化学
キーワード: ネイティブ質量分析、膜タンパク質、薬効評価
1 構造エピゲノム科学研究室
2 理化学研究所 生命機能科学研究センター
3 サントリー生命科学財団
4 広島大学大学院統合生命科学研究科
論文タイトル:Evaluation of drug responses to human β2AR using native mass spectrometry.
著者: Tajiri M, Imai S, Konuma T, Shimamoto K, Shimada I, *Akashi S.
雑誌名:ACS Omega
doi: 10.1021/acsomega.3c02737
発表者:田尻 道子1, 今井 俊輔2, 小沼 剛1、島本 啓子3、嶋田 一夫2,4、明石 知子1⇒Research map
研究分野:構造生物化学
キーワード: ネイティブ質量分析、膜タンパク質、薬効評価
1 構造エピゲノム科学研究室
2 理化学研究所 生命機能科学研究センター
3 サントリー生命科学財団
4 広島大学大学院統合生命科学研究科