遺伝学の松本教授、高田講師らが統合失調症の新たな遺伝的メカニズムを解明
- TOPICS
- 研究
- 医療
遺伝子産物の「切り出し」に影響するDNA多型のビッグデータ解析から
『Nature Communications』に掲載
理化学研究所(理研)脳科学総合研究センター精神疾患動態研究チームの高田篤客員主幹研究員(現横浜市立大学学術院医学群遺伝学 講師)、加藤忠史チームリーダー、横浜市立大学学術院医学群遺伝学の松本直通教授らの共同研究チームは、遺伝子産物の「切り出し(スプライシング)」に影響するDNA配列の個人差(DNA多型)の網羅的な解析を行い、統合失調症[1]の新たな遺伝的メカニズムを解明しました。
DNAから転写されたRNAは通常、そのままタンパク質として翻訳されません。一次的な転写産物であるメッセンジャーRNA(mRNA)前駆体から翻訳される部分(エクソン)のみが切り出され、最終的にタンパク質の鋳型となる成熟mRNAが形成されます。この切り出し過程は「スプライシング」と呼ばれます。また、一つのmRNA前駆体から異なる組み合わせのエクソンを持つ成熟mRNAが合成されることもあります。これは「選択的スプライシング」と呼ばれ、限られた数の遺伝子から多様な生命活動を生み出すメカニズムとして注目されています。
共同研究チームはCommonMind Consortium[2]で公開されている206名分の死後脳のRNAシーケンスデータ[3]を解析し、脳内の「選択的スプライシングを制御するゲノム領域(splicing quantitative trait loci:sQTL)」を網羅的に同定しました。さらに、これらのsQTLが過去のゲノムワイド関連解析(GWAS)[4]でさまざまな疾患との関連が報告されているゲノム領域に多いこと、なかでも統合失調症関連領域で多く認められることを明らかにしました。さらに、統合失調症を対象とした大規模なGWASのデータを解析し、脆弱X症候群[5]の原因遺伝子と相互作用を示すFXR1やシナプス[6]機能に関わるSNAP91などの選択的スプライシングを制御するsQTLが、特に統合失調症と強く関連することを明らかにしました。このことは、統合失調症と関連する一塩基多型(SNP)[7]の少なくとも一部がsQTLとして働き選択的スプライシングを制御することによって疾患リスクに寄与するという、新たな遺伝的メカニズムが存在することを示しています。
今後、これらの遺伝子の選択的スプライシングが脳神経系の機能や発達に及ぼす影響を検討することで、統合失調症の病態メカニズムの一端を解明できると期待できます。また、将来的には統合失調症に対する新たな治療法の開発に貢献する可能性もあります。なお、本研究で作成したsQTLのリストは、統合失調症のみならず、さまざまな疾患の遺伝的メカニズムの研究において有益なリソースとして利用できます。
本研究成果は、国際科学雑誌『Nature Communications』に掲載されました(2月27日付け)。
本研究は日本医療研究開発機構(AMED)「脳科学研究戦略推進プログラム」事業、日本学術振興会 科学研究費助成事業 若手研究(A)の支援を受けて行われました。
背景
また選択的スプライシングは、DNA配列の個人差(DNA多型)によって影響を受けることが知られており、「選択的スプライシングを制御するゲノム領域(splicing quantitative trait loci:sQTL)」の研究も徐々に進展しています。しかし、これまでに、最も複雑な選択的スプライシングが行われているヒトの脳由来のデータを用いて、大規模かつ網羅的に、高解像度のsQTL解析を行った研究はありませんでした。
そこで、共同研究チームはヒトの死後脳から得られた転写産物データから、大規模なsQTL解析を試みました。
注2) Merkin, J., Russell, C., Chen, P., and Burge, C.B. “Evolutionary dynamics of gene and isoform regulation in Mammalian tissues.” Science 338, 1593-1599. 2012.12
研究手法と成果
共同研究チームはまず、CommonMind Consortiumが公開しているヒト死後脳(前頭葉)サンプルのRNAシーケンス[7]データのうち206名分を解析し、脳内で観察される選択的スプライシングを網羅的に同定しました。例えば、エクソンA、B、Cの三つが並んでいるときに、ある成熟mRNAにはエクソンBが含まれているのに別の成熟mRNAには含まれていない、といった現象を検出しました。続いて、同じサンプルから得られた一塩基多型(SNP)のデータと選択的スプライシングのデータを比較し、選択的スプライシングを制御するゲノム領域のマーカーとなる多型(sQTL SNP)を同定しました。例えば、あるSNPの遺伝子型がA/A(アデニン/アデニン)だと特定のエクソンが成熟mRNAに含まれるのに、遺伝子型がA/G(アデニン/グアニン)もしくはG/G(グアニン/グアニン)だと成熟mRNAにエクソンが含まれない、といった多型がsQTL SNPです。統計学的な処理を行い、互いに独立と考えられるsQTL SNPを1,539個同定しました。
次に、さまざまなヒトの疾患を対象として行われたゲノムワイド関連解析(GWAS)のデータをGWAS Catalog[8]からダウンロードし、sQTLと疾患関連領域の関係について検討しました。まず、何らかのヒトの疾患との関連が報告されているゲノム領域にsQTL SNPが多いかどうかを、sQTLではないと考えられるSNPと比較して検討したところ、疾患関連領域では有意にsQTL SNPが多いことが分かりました。続いて、個別の疾患と関連するゲノム領域にsQTL SNPが多いかどうかを解析したところ、統合失調症、多発性硬化症[9]といった脳神経系の疾患と関連する領域で、特にsQTL SNPが多いことが分かりました(図1)。
統計学的有意差(P値)[10]、オッズ比[10]の両方の観点から評価すると、特に統合失調症関連領域でsQTL SNPが多いという結果が得られました(図1)。そのため、少なくとも一部の統合失調症関連領域では、sQTLがmRNAの選択的スプライシングに影響を与え翻訳されるタンパク質が変化することによって、疾患リスクに関わっていると考えられます。特に、あるSNPが統合失調症の有無と高い有意水準で関連し、かつそのSNPがsQTLである場合には、その可能性が高まると想定されます。
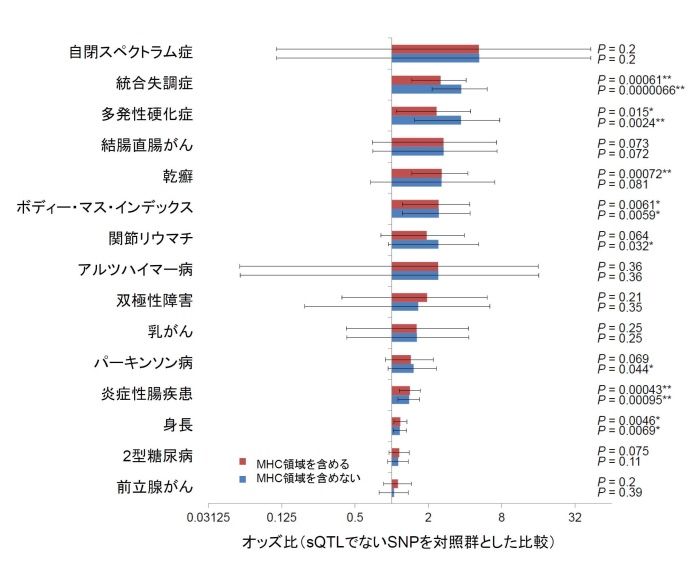 図1GWASデータを用いた各疾患の関連ゲノム領域におけるsQTL SNPの局在に関する検討
図1GWASデータを用いた各疾患の関連ゲノム領域におけるsQTL SNPの局在に関する検討
主要組織適合遺伝子複合体(MHC、下記参照)のデータを含めた解析(赤のバー)とMHCを含めない解析(青のバー)を行った。横軸はオッズ比(右に行くほど、疾患関連領域にsQTL SNPが多い)を示しており、MHCを含めない解析でオッズ比が高い順に上から並べた。なお、自閉スペクトラム症でオッズ比が高いのに統計学的に有意な関連でないのは、自閉スペクトラム症を対象として行われたGWASの規模が小さいためである。逆に、炎症性腸疾患で影響がごく小さいのに統計学的な関連が認められているのは、大規模なGWASが行われているためである。
主要組織適合遺伝子複合体とは、免疫反応に必要な遺伝子を多く含むゲノム領域。ヒトゲノムの中で最も多様性が高い領域の一つであり、さまざまな疾患と関連している一方、その解析は複雑であるため、結果にバイアスを生じる原因となることがある。そのため、本研究ではMHCを含めた解析と含めない解析の両方を行った。MHCはmajor histocompatibility complex:の略。
さらに、Psychiatric Genomics Consortium[11]による15万人以上を解析した統合失調症のGWASデータを用いて、ゲノムワイドな有意水準[12]で統合失調症と関連するsQTL SNPを探索しました。その結果、四つのゲノム領域(染色体3番に二つ、6番と14番に一つずつ)にあるNEK4、FXR1、SNAP91、APOPT1という遺伝子の選択的スプライシングに関連するsQTL SNPが、統合失調症リスクとも強く関連することが分かりました(図2)。それぞれの機能としては、NEK4はDNA損傷の修復などに関わるタンパク質を作る遺伝子であり、脳で多く発現しています。FXR1から作られるタンパク質は、脆弱X症候群の原因遺伝子(FMR1)から作られるタンパク質と相互作用を示すことが知られています。SNAP91からはシナプスを介した情報伝達に重要なタンパク質が作られ、APOPT1はミトコンドリアに局在し、細胞死などと関連するタンパク質を作ります。
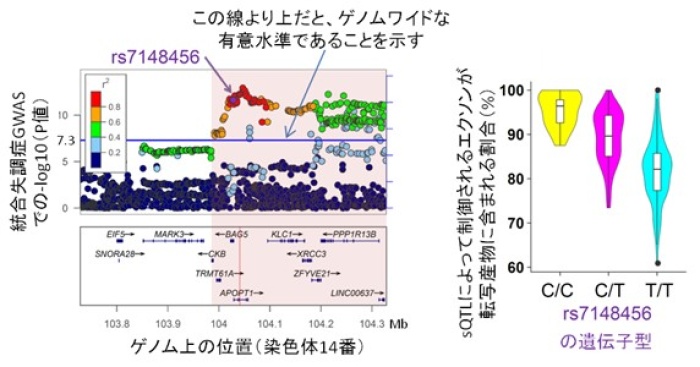 図2統合失調症と強く関連する染色体14番にあるAPOPT1遺伝子のsQTL SNP
図2統合失調症と強く関連する染色体14番にあるAPOPT1遺伝子のsQTL SNP
今後の期待
本研究で得られた、ヒト疾患関連ゲノム領域ではsQTL SNPが有意に多いという所見は、これらの疾患と関連するSNPの少なくとも一部が、sQTLとして働き選択的スプライシングを制御することによって疾患リスクに寄与するという、新たな遺伝的メカニズムが存在することを示しています。なかでも、脳組織サンプル由来のデータを用いて本研究で同定した「脳sQTL」は、統合失調症の遺伝的リスクをよく説明すると考えられます。
また通常GWASでは疾患関連座位がある程度幅広いゲノム領域として同定され、多くの場合その中には複数の遺伝子が存在します。例えば図2では左図の中央から右半分の範囲(背景がピンクの部分)でゲノムワイドな有意水準の関連SNPを認めていますが、その中だけでも9個の遺伝子(CKB、TRMT61A、BAG5、APOPT1、KLC1、XRCC3、ZFIVE21、PPPIR13B、LINC00637)があり、どの遺伝子の機能が統合失調症と関わっているかを特定するのは容易ではありません。しかし今回のsQTLのデータを用いると、それら複数の遺伝子の中で“APOPT1が特に有望な疾患感受性遺伝子の候補であり、その選択的スプライシングの異常が病態に関わっている可能性がある”という仮説を構築することができます。
こういった仮説をさらに検証するためには、sQTLを導入した細胞や動物を用いた実験や、患者由来のサンプルの解析などを行う必要がありますが、今回のsQTLのデータリソースを用いることによって、統合失調症のみならずさまざまな多因子疾患において、有望な候補遺伝子を絞り込むことができると考えられます。
また今回の研究は、CommonMind ConsortiumのRNAシーケンスデータ、Psychiatric Genomics Consortiumの統合失調症GWASデータ、GWAS Catalogに登録されているその他の疾患のGWASデータなど、大規模データを複合的に解析し、生物学的に重要な知見を引き出したという点でも意義深いと考えられます。
今後、こうしたビッグデータの複合的解析をさらに推進することによって、精神神経疾患を含む多因子疾患の遺伝的メカニズムの解明につながると期待できます。
論文情報
Genome-wide identification of splicing QTLs in the human brain and their enrichment among schizophrenia-associated loci
<雑誌>Nature Communications
<DOI>10.1038/NCOMMS14519
補足説明
統合失調症は幻覚や妄想、意欲の低下、感情の平板化などを主要な症状とする精神疾患。発症後には社会的機能の低下を伴うことが多い。生涯罹患率は人口の約1%と報告されている。
[2] CommonMind Consortium
疾患に対する専門知識と、脳組織サンプルおよびデータを提供するための官民パートナーシップで、マウント・シナイ医科大学、ペンシルベニア大学、ピッツバーグ大学、武田薬品工業株式会社、エフ・ホフマン・ラ・ロシュ社などが参加している。詳細は https://www.synapse.org//#!Synapse:syn2759792/wiki/69613
[3] RNAシーケンス
RNAから逆転写したcDNA(RNAと相補的なDNA)を、次世代シーケンサーで解析する実験手法。RNAの定量のみならず、新規転写産物の検出や、選択的スプライシングイベントの定量、新規同定を行うことができる。
[4] ゲノムワイド関連解析(GWAS)
ゲノム中の数十万から数百万のSNPを網羅的に調べ上げ、疾患の有無や、身長・体重などの形質と関連するゲノム領域を同定する研究手法。GWAS はgenome-wide association studyの略。
[5] 脆弱X症候群
X染色体上のFMR1遺伝子の異常が原因となる遺伝性疾患で、知的障害や特徴的な顔貌などの症状を示す。
[6] シナプス
神経細胞同士の情報伝達に関わる構造。情報を伝える細胞と伝えられる細胞の間には約20ナノメートル(1億分の2メートル)のすき間がある。情報を伝える細胞はこのすき間に神経伝達物質を放出し、伝えられる細胞側の神経伝達物質受容体がそれを受け取ることにより神経情報が伝わる。
[7] 一塩基多型(SNP)
DNA配列の個人差のうち、標準的な配列と1塩基だけ異なっており、かつ集団内で1%以上の頻度で観察されるもの。1人あたり2コピーのゲノムを持つので、50人中1人が、片方のゲノムでSNPを持っていると頻度1%となる。SNPはsingle nucleotide polymorphismの略。
[8] GWAS Catalog
さまざまな疾患、形質を対象としたGWASのデータがまとめられたカタログ。米国の国立ヒトゲノム研究所(National Human Genome Research Institute)と英国の欧州バイオインフォマティクス研究所(European Bioinformatics Institute)によって運営されている。詳細は https://www.ebi.ac.uk/gwas/
[9] 多発性硬化症
脱髄疾患の一種で、脳や脊髄、視神経などに神経症状が出て、しびれや麻痺などを引き起こす。治癒と再発を繰り返すことが知られており、日本では特定疾患に認定されている難病。遺伝要因、環境要因の双方が発症に関与していると考えられるが、その原因は解明されていない。
[10] P値、オッズ比
P値は、偶然にそのようなことが起こる確率のことで統計学的有意差を示す指標。数値が低いほど有意水準が高いことを表す。オッズ比は、ある事象の起こりやすさについて二つの群で比較したときの違いを示す統計学的尺度の一つ。本研究では、疾患関連領域に含まれるか否かという事象について、sQTL SNPとsQTLではないSNPの2群を比較してオッズ比を算出している。
[11] Psychiatric Genomics Consortium
精神疾患のゲノム解析データを共有し、大規模研究を行うための国際コンソーシアム。詳細は https://www.med.unc.edu/pgc
[12] ゲノムワイドな有意水準
GWASでは数十万から数百万のSNPを一度に調べるため、偶然疾患などと関連しているようにみえるSNPが多数検出される(偽陽性の問題)。そのため、「P値が5×10-8未満」という高い有意水準で関連を認めたSNPのみを真の陽性としており、このP値の基準をゲノムワイドな有意水準と呼ぶ。
発表者・機関窓口
理化学研究所脳科学総合研究センター精神疾患動態研究チーム
客員主幹研究員 高田篤(たかたあつし)(現横浜市立大学学術院医学群遺伝学講師)
チームリーダー 加藤忠史(かとうただふみ)
TEL:045-787-2606(高田)、048-467-6949(加藤)
FAX:045-786-5219(高田)、048-467-6947(加藤)
E-mail:atakata@brain.riken.jp、もしくは、atakata@yokohama-cu.ac.jp(高田) kato@brain.riken.jp(加藤)
横浜市立大学学術院医学群遺伝学教授 松本直通(まつもとなおみち)
TEL:045-787-2606FAX:045-786-5219
E-mail:naomat@yokohama-cu.ac.jp
<機関窓口>
理化学研究所広報室報道担当
TEL:048-467-9272FAX:048-462-4715
E-mail:ex-press@riken.jp
<事業に関するお問い合わせ>
日本医療研究開発機構戦略推進部脳と心の研究課
Tel:03-6870-2222Fax:03-6870-2244
E-mail: brain-pm@amed.go.jp