世界初!がん抑制タンパク質p53のリン酸化複合体の立体構造解明に成功しました—新たな抗がん剤の開発の促進に期待—
2014.10.07
- プレスリリース
- 研究
世界初!がん抑制タンパク質p53のリン酸化複合体の立体構造解明に成功しました—新たな抗がん剤の開発の促進に期待—
平成26年10月6日
研究推進課
研究推進課
~米国化学会誌『Journal of the American Chemical Society』に掲載~
(平成26年9月29日付オンライン掲載)
(平成26年9月29日付オンライン掲載)
横浜市立大学大学院生命医科学研究科 奥田昌彦特任助教と西村善文研究科長は、がん抑制タンパク質p53の転写活性化ドメインのリン酸化体が、基本転写因子TFIIH p62のPHドメインに結合した立体構造を解明しました。これはp53が持つ機能を最大限に発揮させる基盤となるため、新たな抗がん剤等の設計に有益な情報を提供することが期待できます。
本研究成果は、米国の化学会誌『Journal of the American Chemical Society』(平成26年9月29日付) にオンライン掲載されました。
※本研究は、文部科学省「創薬等支援技術基盤プラットフォーム事業」や「先端研究基盤共用・プラットフォーム形成事業」の研究の一環で行われました。
| ポイント ○がん抑制タンパク質p53のリン酸化された転写活性化ドメインの複合体として世界初の立体構造解明。 ○p53の転写活性化ドメインが、これまでに共通認識されているものとは全く異なる様式で結合している事を明らかにした。 |
研究の内容と成果
p53はゲノムのガーディアン(守護者)と呼ばれ、DNA修復、細胞周期、アポトーシス(*1)、老化、代謝等の様々な生物学的過程に関与する転写因子(*2)です。悪性腫瘍の半分以上にp53遺伝子の異常が認められていることからもその重要性が分かります。p53が多彩な機能を発揮する理由の一つに様々な標的タンパク質と特異的に結合する能力が挙げられます。加えて、p53に施される種々の翻訳後修飾(*3)が結合の多様性を増幅させます。p53のアミノ末端にある転写活性化ドメインは多くのリン酸化部位をもち、各々のリン酸化が標的タンパク質との相互作用を正、あるいは負にコントロールします。例えば、46番のセリンと55番のトレオニンがリン酸化されるとヒト基本転写因子(*4)のTFIIH p62のプレクストリン相同(PH)ドメインとの相互作用が大きく上昇します。
しかし、そのメカニズムは不明でした。p53の転写活性化ドメインと多数の標的タンパク質(7種以上)の複合体構造はこれまでに解明され、その全てでp53は両親媒性ヘリックス(*5)を形成し、その中でアミノ酸の側鎖の向きを巧妙に変えることで多くの標的タンパク質と特異的に結合していました。但し、構造が解かれたp53は全て非リン酸化体でした。今回私たちは本学の高磁場NMR分光器(*6)を用いて46番セリンと55番トレオニンがリン酸化されたp53の転写活性化ドメインと基本転写因子p62のPHドメインとの複合体の構造を解析し、リン酸化p53の複合体として世界で初となる構造を決定することに成功しました(図1A)。p53の構造は両親媒性ヘリックス(図1B)とは全く異なり、伸びた紐のような形でPHドメインに広く巻き付いていました。標的タンパク質の中には、ヒトp62の酵母ホモログであるtfb1のPHドメインも含まれていますが、p53は酵母には存在しませんので、酵母のモデルではなくヒトの系で行う必要がありました。p53はターゲットの構造に合わせて、たとえそれが同じPHドメインであっても、僅かな構造の違いを認識して最適な親和性を得られるように、今まで考えられてきたよりもずっと柔軟に構造を変え得ることが明らかになりました。また、リン酸化による結合力増加のメカニズムも解明することができました。
2008年に私たちは、遺伝子情報がRNAポリメラーゼIIによって読み取られる際にそれを補助する基本転写因子TFIIEαの酸性ドメインが、p62のPHドメインと特異的に結合することを発見しました。両者の複合体の立体構造をNMRで決定したところ、p53の転写活性化ドメインもp62と同じ位置で結合することが示唆され、2008年に欧州分子生物学機構誌『The EMBO Journal』に報告しました(参考文献1)。遺伝子の発現とp53が関与する遺伝子の修復が同じ表面で競合的に起きることが今回詳細に解明され、p53のリン酸化のスイッチが重要であることが明確になりました。
しかし、そのメカニズムは不明でした。p53の転写活性化ドメインと多数の標的タンパク質(7種以上)の複合体構造はこれまでに解明され、その全てでp53は両親媒性ヘリックス(*5)を形成し、その中でアミノ酸の側鎖の向きを巧妙に変えることで多くの標的タンパク質と特異的に結合していました。但し、構造が解かれたp53は全て非リン酸化体でした。今回私たちは本学の高磁場NMR分光器(*6)を用いて46番セリンと55番トレオニンがリン酸化されたp53の転写活性化ドメインと基本転写因子p62のPHドメインとの複合体の構造を解析し、リン酸化p53の複合体として世界で初となる構造を決定することに成功しました(図1A)。p53の構造は両親媒性ヘリックス(図1B)とは全く異なり、伸びた紐のような形でPHドメインに広く巻き付いていました。標的タンパク質の中には、ヒトp62の酵母ホモログであるtfb1のPHドメインも含まれていますが、p53は酵母には存在しませんので、酵母のモデルではなくヒトの系で行う必要がありました。p53はターゲットの構造に合わせて、たとえそれが同じPHドメインであっても、僅かな構造の違いを認識して最適な親和性を得られるように、今まで考えられてきたよりもずっと柔軟に構造を変え得ることが明らかになりました。また、リン酸化による結合力増加のメカニズムも解明することができました。
2008年に私たちは、遺伝子情報がRNAポリメラーゼIIによって読み取られる際にそれを補助する基本転写因子TFIIEαの酸性ドメインが、p62のPHドメインと特異的に結合することを発見しました。両者の複合体の立体構造をNMRで決定したところ、p53の転写活性化ドメインもp62と同じ位置で結合することが示唆され、2008年に欧州分子生物学機構誌『The EMBO Journal』に報告しました(参考文献1)。遺伝子の発現とp53が関与する遺伝子の修復が同じ表面で競合的に起きることが今回詳細に解明され、p53のリン酸化のスイッチが重要であることが明確になりました。
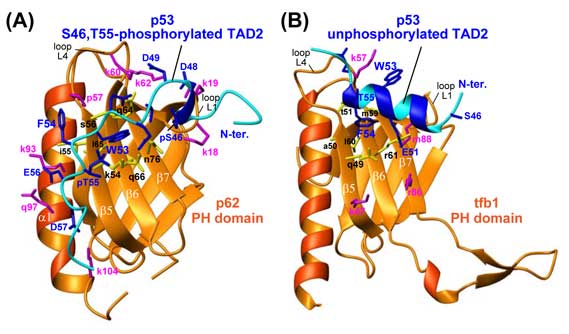
図1 p53転写活性化ドメインとp62のPHドメインの複合体構造
(A)リン酸化p53転写活性化ドメインとヒトp62 PHドメインの複合体構造
(B)非リン酸p53転写活性化ドメインと酵母tfb1 PHドメインの複合体構造
p53(青色)、p62/tfb(橙色)(参考文献2)。
今後の展開
これまでに解明されたp53の転写活性化ドメインは全て標的タンパク質との複合体中で両親媒性ヘリックスを形成していたことから、抗がん剤等はそのヘリックス構造に基づいて設計されてきました。本研究の成果は、新たな抗がん剤の設計等に有益な情報を提供することが期待されます。
(2)Di Lello, P., Jenkins, L. M., Jones, T. N., Nguyen, B. D., Hara, T., Yamaguchi, H., Dikeakos, J. D., Appella, E., Legault, P., Omichinski, J. G. Mol. Cell 2006, 22, 731-740.
プログラムされた細胞死。自ら積極的に引き起こす細胞死。
(*2)転写因子
遺伝子の転写(DNAを鋳型にしてRNAが合成される反応)をコントロールするタンパク質。
(*3)翻訳後修飾
生合成(翻訳)された後に受ける化学的な修飾。
(*4)基本転写因子
RNAポリメラーゼIIがタンパク質合成の鋳型であるメッセンジャーRNAの合成反応を開始する際に、それを補助する転写因子。
(*5)両親媒性ヘリックス
片側に親水的なアミノ酸、反対側に疎水的にアミノ酸が配置されたヘリックス。
(*6)NMR分光器
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質等に対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。
“Extended String Binding Mode of the Phosphorylated Transactivation Domain of Tumor Suppressor p53”
J. Am. Chem. Soc., doi: 10.1021/ja506351f
参考文献
(1)Okuda, M., Tanaka, A., Satoh, M., Mizuta, S., Takazawa, M., Ohkuma, Y., Nishimura, Y. EMBO J. 2008, 27, 1161-1171.(2)Di Lello, P., Jenkins, L. M., Jones, T. N., Nguyen, B. D., Hara, T., Yamaguchi, H., Dikeakos, J. D., Appella, E., Legault, P., Omichinski, J. G. Mol. Cell 2006, 22, 731-740.
用語説明
(*1)アポトーシスプログラムされた細胞死。自ら積極的に引き起こす細胞死。
(*2)転写因子
遺伝子の転写(DNAを鋳型にしてRNAが合成される反応)をコントロールするタンパク質。
(*3)翻訳後修飾
生合成(翻訳)された後に受ける化学的な修飾。
(*4)基本転写因子
RNAポリメラーゼIIがタンパク質合成の鋳型であるメッセンジャーRNAの合成反応を開始する際に、それを補助する転写因子。
(*5)両親媒性ヘリックス
片側に親水的なアミノ酸、反対側に疎水的にアミノ酸が配置されたヘリックス。
(*6)NMR分光器
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質等に対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。
論文著者、ならびにタイトルなど
Masahiko Okuda, Yoshifumi Nishimura“Extended String Binding Mode of the Phosphorylated Transactivation Domain of Tumor Suppressor p53”
J. Am. Chem. Soc., doi: 10.1021/ja506351f
お問い合わせ先
(本資料の内容に関するお問い合わせ)
○公立大学法人横浜市立大学 大学院生命医科学研究科
特任助教 奥田 昌彦
研究科長 西村 善文
横浜市鶴見区末広町1-7-29
TEL:045-508-7211/7212
E-mail:(奥田)
(西村)
(取材対応窓口、資料請求など)
○公立大学法人横浜市立大学 研究推進課長 嶋崎 孝浩
TEL:045-787-2019
○公立大学法人横浜市立大学 大学院生命医科学研究科
特任助教 奥田 昌彦
研究科長 西村 善文
横浜市鶴見区末広町1-7-29
TEL:045-508-7211/7212
E-mail:(奥田)
(西村)
(取材対応窓口、資料請求など)
○公立大学法人横浜市立大学 研究推進課長 嶋崎 孝浩
TEL:045-787-2019