慢性腎臓病における高血圧発症のメカニズムを解明 ~疾患克服のための新たな高血圧治療の可能性~
- TOPICS
- 研究
慢性腎臓病における高血圧発症のメカニズムを解明
~疾患克服のための新たな高血圧治療の可能性~
国際腎臓学会誌『Kidney International』に掲載
高血圧を合併した慢性腎臓病は、透析療法や腎移植が必要となる末期腎不全に至るリスクが高く予後不良であることが特徴的です。本研究成果により、この高血圧の発症には、①受容体結合タンパク質ATRAP/Agtrap*1が減少して1型アンジオテンシン受容体(AT1受容体)の過剰活性化の抑制が不十分となり、②特定の炎症性サイトカイン系亢進が引き起こされ、③その結果として腎臓尿細管で特異的にナトリウム再吸収を行っている上皮性ナトリウムチャネル(ENaC)が活性化されて循環血液量の増大を招く、という機序が中核的な役割を果たしていることが明らかになりました。国家的重要課題である健康寿命延伸の大きな障壁となっている末期腎不全、さらには脳・心血管疾患の根源ともなる慢性腎臓病における高血圧発症の分子レベルでの詳細な病態が明らかになり、慢性腎臓病克服のあらたな可能性が示されました。
今回の研究成果は、腎臓病学分野の主要国際雑誌「Kidney International(国際腎臓学会誌)」に掲載されました(米国1月10日オンライン)(掲載論文)。
*1田村教授らが米国Harvard大学との共同研究により発見した、強力な生活習慣病誘発因子(アンジオテンシン II)に対する受容体への結合性低分子蛋白 (AT1 receptor-associated protein; ATRAP)(文献2、文献3、文献4)
研究の背景
現在国内で血液透析治療を受けている末期腎不全患者は31万人以上になり、現在も増加傾向にあります。その予備軍とされる慢性腎臓病患者は1330万人、成人の8人に1人にのぼり、新たな国民病と位置づけられています。また、慢性腎臓病患者では末期腎不全に至るリスクのみならず、“心腎連関”という病態連関機序により脳卒中や心筋梗塞などの危険性も増大することがわかっており、世界的な傾向である長寿化にともない実現が求められている健康寿命の延伸にとって大きな障害となっています。したがって慢性腎臓病の克服は重大な国家的・国際的課題の一つですが、最大の問題は進行した慢性腎臓病を改善する治療薬が存在しないことであり、そこに重要なアンメット・メディカル・ニーズがあります。
近年では、慢性糸球体腎炎など腎臓固有の疾患が原因で慢性腎臓病になる患者は減少傾向ですが、糖尿病や高血圧などの生活習慣病が原因で慢性腎臓病になる患者は増加傾向にあります。特に、高血圧と腎臓病との関係は密接で、高血圧は慢性腎臓病の原因となりますが、同時に慢性腎臓病では高血圧になりやすく、かつ高血圧の合併は予後不良の慢性腎臓病を特徴づけるとされ、悪循環が形成されます。したがって、慢性腎臓病において高血圧を抑えることはとても重要な課題です。慢性腎臓病患者で血圧が上がる理由として、レニン-アンジオテンシン系の活性化、交感神経活性の亢進、内皮依存性血管拡張物質の減少、糸球体濾過量の低下による循環血液量の増加などが指摘されていましたが、その詳しい原因は今までわかっていませんでした。
研究の内容
マウスで腎臓の容積を1/6に減らし慢性腎臓病の状態を作製すると、腎機能の低下とともに血圧の上がるマウス種(C57BL/6マウス、高血圧抵抗性マウス)と上がらないマウス種(129/Svマウス、易高血圧発症マウス)がいることは以前から知られていましたが、原因は不明でした。本研究では、その種による違いにATRAPが関与していることを明らかにしました。慢性腎臓病の状態で、高血圧が発症する易高血圧発症マウスでは腎臓でのATRAPの発現が低下しており、一方、高血圧を発症しない高血圧抵抗性マウスでは、腎臓でのATRAPの発現が増加していました。つまり、腎機能が低下した時に、ATRAPが減少してしまいAT1受容体の過剰活性化の抑制が不十分となることが高血圧発症の原因であると考えられました。
そこで次に、慢性腎臓病でも血圧の上がらない高血圧抵抗性マウスを背景に、遺伝子工学的にATRAPを欠損させたATRAPノックアウトマウス(ATRAP-KOマウス)を作製すると、もとは高血圧抵抗性マウスであっても慢性腎臓病の状態では高血圧が発症しました。そのメカニズムについて詳細に検討した結果、ATRAP-KOマウスでは慢性腎臓病の状態では循環血液量の増加が認められました。興味深いことに、循環血液量の増加は腎機能の低下の程度とは無関係であり、腎でのナトリウムの再吸収の亢進、そして特定の炎症性サイトカイン(TNF-α*2)の増加がみられました。さらに検討を進めた結果、腎でのナトリウムの再吸収の亢進は、腎臓尿細管で特異的にナトリウム再吸収を行っている上皮性ナトリウムチャネル(ENaC)の活性化が関与し、また、特異的TNF-α阻害薬を用いると、ATRAP-KOマウスでの慢性腎臓病による高血圧発症を抑制できることがわかりました。
(図1)受容体結合タンパク質ATRAPが減少してうまく働かず、特定の炎症性サイトカイン(TNF-α)系が刺激され、その結果腎臓尿細管の上皮性ナトリウムチャネル(ENaC)が活性化されてナトリウム再吸収が亢進し、循環血液量の増大をもたらすことで高血圧を発症する。
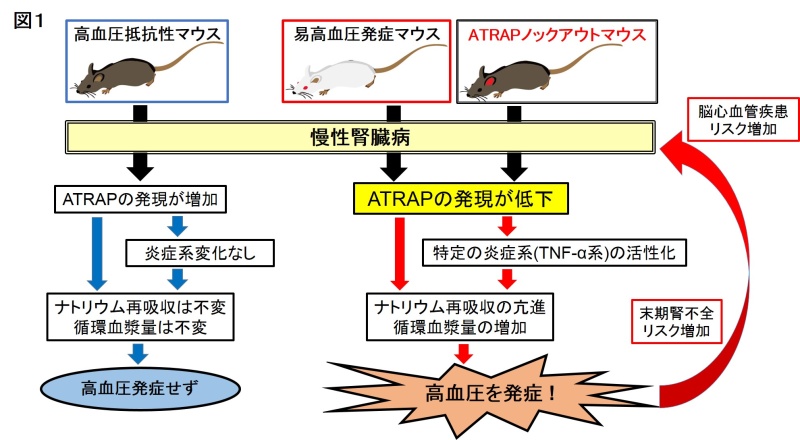
以上より、透析療法や腎移植が必要となる末期腎不全に至るリスクが高い予後不良の慢性腎臓病を特徴づける高血圧は、ATRAPが減少してAT1受容体の過剰活性化の抑制が不十分となり、腎臓での特異的な炎症性サイトカイン(TNF-α)系亢進によって腎臓尿細管の上皮性ナトリウムチャネル(ENaC)が活性化されて生じる循環血液量の増加する機序が中核的な役割を果たしていることが明らかになりました。
*2腫瘍壊死因子アルファ(Tumor necrosis factor-α;TNF-α)
今後の展開
本研究成果の最大の意義は、慢性腎臓病の状態においてATRAPが減少してAT1受容体の過剰活性化の抑制が不十分となることが高血圧発症の決定的な原因であることを明らかにした点にあります。田村教授、涌井助教らは今までに、実際にヒトの慢性腎臓病患者の腎組織ではATRAPが減少していくことも明らかにしています(文献5)。したがって、末期腎不全、そして、脳・心血管疾患の根源ともなる慢性腎臓病における高血圧発症の分子レベルでの詳細な病態が明らかになったことにより、慢性腎臓病克服のあらたな可能性が示されたと言えます。今後、開発が期待されるATRAP活性化治療により、慢性腎臓病における高血圧を効率的に改善して透析療法や腎移植が必要となる末期腎不全に至るリスクと予後不良を軽減できる可能性があり、新規治療標的として安全で効果的な新薬治療開発に大きく貢献できると考えます。
References
Kobayashi R, Wakui H, Azushima K, Uneda K, Haku S, Ohki K, Haruhara K, Kinguchi S, Matsuda M, Ohsawa M, Toya Y, Nishiyama A, Yamashita A, Tanabe K, Maeshima Y, Umemura S, Tamura K. An angiotensin II type 1 receptor binding molecule has a critical role in hypertension in a chronic kidney disease model. Kidney Int.in press.
(文献2)
Wakui H, Dejima T, Tamura K, Uneda K, Azuma K, Maeda A, Ohsawa M, Kanaoka T, Azushima K, Kobayashi R, Matsuda M, Yamashita A, Umemura S.Activation of angiotensin II type 1 receptor-associated protein exerts an inhibitory effect on vascular hypertrophy and oxidative stress in angiotensin II-mediated hypertension.Cardiovasc Res. 2013 Dec 1;100(3):511-9. doi: 10.1093/cvr/cvt225.
(文献4)
Ohsawa M, Tamura K, Wakui H, Maeda A, Dejima T, Kanaoka T, Azushima K, Uneda K, Tsurumi-Ikeya Y, Kobayashi R, Matsuda M, Uchida S, Toya Y, Kobori H, Nishiyama A, Yamashita A, Ishikawa Y, Umemura S. Deletion of the angiotensin II type 1 receptor-associated protein enhances renal sodium reabsorption and exacerbates angiotensin II-mediated hypertension. Kidney Int. 2014 Sep;86(3):570-81. doi: 10.1038/ki.2014.95.
(文献5)
※この研究は、日本学術振興会の研究補助金、上原記念生命科学財団、公益信託 循環器学研究振興基金、公益財団法人先進医薬研究振興財団、万有生命科学振興国際交流財団、公益財団法人ソルト・サイエンス研究財団、および横浜市立大学先端医科学研究センター「研究開発プロジェクト」による研究助成を受けて行われました。
お問い合わせ先
(本資料の内容に関するお問い合わせ)
学術院医学群循環器・腎臓内科学
助教涌井広道
主任教授田村功一
E-mail:(涌井)
(田村)
TEL:045-787-2635
FAX:045-701-3738
横浜市立大学研究企画・産学連携推進課長渡邊誠
TEL:045-787-2510FAX:045-787-2509
E-mail: