微生物学 梁 明秀 教授らの研究グループにより、人体が本来もつ、エイズウイルスの感染を阻害するしくみを解明~新たな治療法の開発へ期待~
2015.04.23
- TOPICS
- 研究
微生物学 梁 明秀 教授らの研究グループにより、人体が本来もつ、エイズウイルスの感染を阻害するしくみを解明~新たな治療法の開発へ期待~
~『Nature communications』に掲載~
横浜市立大学大学院医学研究科 微生物学 梁 明秀 教授、宮川 敬 助教らの研究グループは、京都大学・東京大学・国立感染症研究所・シンガポール国立大学との共同研究により、エイズの原因となるヒト免疫不全ウイルス(HIV)の感染性を軽減する細胞側因子を新たに同定しその分子機序を明らかにしました。人体が本来もつ宿主防御機構の解明に繋がる成果として、新たな治療法の開発への応用が期待されます。
※本研究成果は英国の科学雑誌「Nature Communications」(平成27年4月22日オンライン版)に掲載されました。
※本研究は、文部科学省 科学研究費および文部科学省「イノベーションシステム整備事業先端融合領域イノベーション創出拠点形成プログラム」の一環として行われ、横浜市立大学 先端医科学研究センターが推進している研究開発プロジェクトの成果の一つです。
※本研究成果は英国の科学雑誌「Nature Communications」(平成27年4月22日オンライン版)に掲載されました。
※本研究は、文部科学省 科学研究費および文部科学省「イノベーションシステム整備事業先端融合領域イノベーション創出拠点形成プログラム」の一環として行われ、横浜市立大学 先端医科学研究センターが推進している研究開発プロジェクトの成果の一つです。
研究の背景
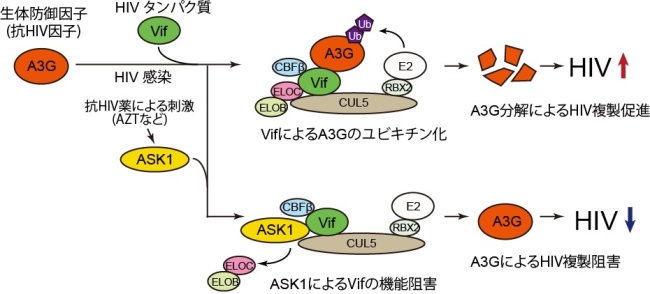
HIV(ヒト免疫不全ウイルス)が体内に侵入すると、免疫細胞が徐々に破壊され、普段は感染しない病原体に感染して病気を発症しやすくなります。このような状態をエイズ(後天性免疫不全症候群, AIDS)と言い、全世界で3500万人以上がHIVに既に感染していると推測されています。2013年には、24万人の子供を含む210万人が新たにHIVに感染しました。日本では、年間1500人が新規HIV感染者となっており、年々増加傾向がみられています。 HIV感染を未然に防ぐワクチンはまだありませんが、抗ウイルス薬の服用によってウイルスの増殖を抑え、エイズの発症を遅らせることはできます。しかし、一度感染したウイルスを体内から完全に排除する治療法は確立されておらず、HIV感染者は抗ウイルス薬を日常的に飲み続ける必要があります。また長期間の抗ウイルス薬の服用によって薬剤が効かなくなる事例も多数報告されています。そのため、HIVワクチンの開発と並行して、既存の薬剤に耐性を有するウイルスにも効果のある新しい薬剤を常に作り続ける必要があります。 本研究グループでは、新規の抗ウイルス薬の開発に向けた様々な取り組みの一つとして、人間が細胞内にもつ「生体防御因子」(*1)の活性化を試みています。HIVに対する生体防御因子の一つとしては、APOBEC3G(A3G)と呼ばれるタンパク質が知られています。HIVは感染細胞内で自らを複製するためにウイルス遺伝子をRNAからDNAへと逆転写しますが、A3Gはその際にウイルス遺伝子に過剰に変異を入れるなどして、HIV複製を抑制します。しかし一方でHIVは、A3Gを不活化するために、Vifと呼ばれるウイルスタンパク質をコードするアクセサリー遺伝子 (*2)を進化の過程で獲得しました。Vifは感染細胞内でA3Gをユビキチン化 (*3) することで分解に導き、ウイルスの複製を助けています。そこで本研究グループでは、VifのA3Gに対する働きを弱めることができれば、人が本来持つ生体防御機構が回復し、HIV複製を抑えられるのではないか、と考えました。
研究の内容と成果
研究グループによる予備実験で、細胞にある種のストレスを与えるとVifの働きが一時的に弱まることが分かりました。そこでこのストレスを感知する情報伝達タンパク質群に着目し、ASK1 (*4) と呼ばれるストレス応答因子がVifに特異的に結合することを見いだしました。ASK1とVifの結合を、コンピュータを用いてシミュレーションしたところ、ASK1はVifのBC-Box領域と呼ばれる部分に結合することが推測されました。この領域は、VifがA3Gを分解する際に必要な補助因子であるElongin B/Cの結合に重要な場所でした。そこでASK1を発現させた細胞で、Elongin B/CのVifへの結合を調べたところ、確かに両者の結合が失われたことから、ASK1がVif–Elongin B/Cの結合を競合的に阻害することで、Vifの機能を失わせる因子である可能性が示唆されました【図】。
次に、ASK1のHIV複製に対する影響を調べるため、ASK1を過剰に発現させたT細胞にHIVを感染させたところ、ウイルスの増殖が阻害されることが分かりました。この細胞ではVifが存在するにも関わらず、細胞内のA3Gが分解されておらず、またウイルス遺伝子に多数の不活化変異が見出されたことから、ASK1はHIV感染細胞においてVifを阻害してA3Gの抗ウイルス活性を亢進させることが分かりました。
ASK1はストレス応答因子であることから、様々な薬剤の刺激に応じて発現や機能が向上するのではないかと研究グループは考えました。いくつかの薬剤を細胞に添加したところ、興味深いことに、既存の抗HIV薬(逆転写酵素阻害剤)の一つであるアジドチミジン (azidothymidine, AZT) がASK1の発現を増加させることが分かりました。AZTを添加したT細胞では、ASK1の発現上昇とともにVifの活性低下が見られました。このことから、AZTには本来の作用である逆転写阻害活性だけではなく、ASK1を介したVifの機能阻害という予想外の作用があることが明らかとなりました。
次に、ASK1のHIV複製に対する影響を調べるため、ASK1を過剰に発現させたT細胞にHIVを感染させたところ、ウイルスの増殖が阻害されることが分かりました。この細胞ではVifが存在するにも関わらず、細胞内のA3Gが分解されておらず、またウイルス遺伝子に多数の不活化変異が見出されたことから、ASK1はHIV感染細胞においてVifを阻害してA3Gの抗ウイルス活性を亢進させることが分かりました。
ASK1はストレス応答因子であることから、様々な薬剤の刺激に応じて発現や機能が向上するのではないかと研究グループは考えました。いくつかの薬剤を細胞に添加したところ、興味深いことに、既存の抗HIV薬(逆転写酵素阻害剤)の一つであるアジドチミジン (azidothymidine, AZT) がASK1の発現を増加させることが分かりました。AZTを添加したT細胞では、ASK1の発現上昇とともにVifの活性低下が見られました。このことから、AZTには本来の作用である逆転写阻害活性だけではなく、ASK1を介したVifの機能阻害という予想外の作用があることが明らかとなりました。
今後の展開
本研究で見いだしたASK1はVifを機能不全に導くことで、人が本来持つA3Gによる生体防御機構を回復させるというユニークな因子です。VifのASK1結合領域は、機能的に必須な領域であり、突然変異が入りにくい”ウィークポイント”であると考えられます。今後、ASK1のVif結合領域を模倣したペプチドや化合物、さらにはASK1の発現を誘導する化合物などを探索することで、ウイルス–宿主間相互作用(Vif–A3G)を抑制する新しいタイプの治療薬開発へ展開させたいと考えています。
用語解説
(*1) 生体防御因子
ウイルスなどから宿主を守るタンパク質の総称で、体内に侵入したウイルスを強力に抑える働きを持っています。HIVを抑える生体防御因子は、APOBEC3G、BST2、SAMHD1などのタンパク質が知られています。
(*2) アクセサリー遺伝子
HIVゲノム上にはウイルスの構造や調節に関わる遺伝子以外に少なくとも6つの遺伝子を持っており、これらの遺伝子をアクセサリー遺伝子と言います。これらは発見当初、その機能的役割が明らかでなかったことから“アクセサリー”遺伝子と名付けられましたが、その後の研究により、ウイルス複製や増殖に関与するのみならず、様々な宿主細胞の調節機能を通じてウイルスの持続感染や病態発現に重要な役割を果たすことが明らかにされました。
(*3) ユビキチン化
分解されるべきタンパク質にユビキチンと呼ばれる小さなタンパク質が結合すること。ユビキチン化されたタンパク質は、多くの場合、細胞内のタンパク質分解経路に運ばれて分解されます。
(*4) ASK1 (Apoptosis signal-regulating kinase 1)
炎症性サイトカインや活性酸素などの刺激によって活性化し、細胞内シグナルを介して自発的な細胞死(アポトーシス)や細胞の分化などを誘導する因子。
論文著者・タイトル
Kei Miyakawa, Satoko Matsunaga, Kazuhiko Kanou, Atsushi Matsuzawa, Ryo Morishita, Ayumi Kudoh, Keisuke Shindo, Masaru Yokoyama, Hironori Sato, Hirokazu Kimura, Tomohiko Tamura, Naoki Yamamoto, Hidenori Ichijo, Akifumi Takaori-Kondo and Akihide Ryo: “ASK1 restores the antiviral activity of APOBEC3G by disrupting HIV-1 Vif-mediated counteraction”
Nature Communications on 22 Apr 2015 doi 10.1038/ncomms7945
用語解説
(*1) 生体防御因子
ウイルスなどから宿主を守るタンパク質の総称で、体内に侵入したウイルスを強力に抑える働きを持っています。HIVを抑える生体防御因子は、APOBEC3G、BST2、SAMHD1などのタンパク質が知られています。
(*2) アクセサリー遺伝子
HIVゲノム上にはウイルスの構造や調節に関わる遺伝子以外に少なくとも6つの遺伝子を持っており、これらの遺伝子をアクセサリー遺伝子と言います。これらは発見当初、その機能的役割が明らかでなかったことから“アクセサリー”遺伝子と名付けられましたが、その後の研究により、ウイルス複製や増殖に関与するのみならず、様々な宿主細胞の調節機能を通じてウイルスの持続感染や病態発現に重要な役割を果たすことが明らかにされました。
(*3) ユビキチン化
分解されるべきタンパク質にユビキチンと呼ばれる小さなタンパク質が結合すること。ユビキチン化されたタンパク質は、多くの場合、細胞内のタンパク質分解経路に運ばれて分解されます。
(*4) ASK1 (Apoptosis signal-regulating kinase 1)
炎症性サイトカインや活性酸素などの刺激によって活性化し、細胞内シグナルを介して自発的な細胞死(アポトーシス)や細胞の分化などを誘導する因子。
論文著者・タイトル
Kei Miyakawa, Satoko Matsunaga, Kazuhiko Kanou, Atsushi Matsuzawa, Ryo Morishita, Ayumi Kudoh, Keisuke Shindo, Masaru Yokoyama, Hironori Sato, Hirokazu Kimura, Tomohiko Tamura, Naoki Yamamoto, Hidenori Ichijo, Akifumi Takaori-Kondo and Akihide Ryo: “ASK1 restores the antiviral activity of APOBEC3G by disrupting HIV-1 Vif-mediated counteraction”
Nature Communications on 22 Apr 2015 doi 10.1038/ncomms7945
お問い合わせ先
(本資料の内容に関するお問い合わせ)
公立大学法人横浜市立大学 大学院医学研究科 微生物学教授 梁明秀
TEL:045-787-2602
E-mail:
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学 先端研究推進課長 立石建
Tel:045-787-2510E-Mail:
公立大学法人横浜市立大学 大学院医学研究科 微生物学教授 梁明秀
TEL:045-787-2602
E-mail:
(取材対応窓口、資料請求など)
公立大学法人横浜市立大学 先端研究推進課長 立石建
Tel:045-787-2510E-Mail: